鼻咽癌组织中SUMO2、TRIM21表达及临床预后意义*
2024-05-13商胜利姚雅君
商胜利,姚雅君,陈 明
1.开滦总医院耳鼻咽喉头颈外科,河北唐山 063000;2.开滦总医院唐家庄医院五官科,河北唐山 063100;3.唐山市第三医院耳鼻咽喉科,河北唐山 063100
鼻咽癌(NPC)是头颈部高发恶性肿瘤,具有位置隐匿、发展快及易转移等特点,多数患者确诊时已为中晚期,5年生存率仅为40%~50%[1]。NPC的早期诊治,对于提高治疗效果,延长患者生存预后,具有重要意义。泛素样小分子修饰因子2(SUMO2)是小泛素样修饰物蛋白家族成员,参与蛋白翻译后修饰,与核转运、转录调节、细胞凋亡等多种细胞过程密切相关[2]。有研究发现,SUMO2在胃癌[3],肝癌[4]等恶性肿瘤中表达上调,促进NOP2/Sun RNA甲基转移酶家族成员2的表达,导致肿瘤过度增殖及侵袭。三结构域蛋白家族成员21(TRIM21) 属于三重基序家族成员,具有E3泛素连接酶活性,通过泛素化下游靶蛋白,调节天然免疫反应、细胞周期等生物学过程[5]。研究表明,TRIM21能够介导抗增殖蛋白1泛素化降解,激活核因子κB活性,促进NPC肿瘤细胞的增殖及迁移,是潜在的NPC肿瘤标志物[6]。目前NPC中SUMO2、TRIM21的表达及临床预后价值尚不明确。本研究检测NPC组织中SUMO2、TRIM21的表达,探讨两者与临床病理特征及预后的关系。
1 资料与方法
1.1一般资料 选取2015年2月至2018年2月期间在开滦总医院(下称本院)诊治的96例NPC患者作为研究对象。其中,男59例,女37例;年龄33~78岁,平均(64.12±7.54)岁;既往有吸烟史40例,无吸烟史56例;病理类型:角化性鳞状细胞癌20例,分化型非角化性28例,未分化型非角化性48例;临床分期:Ⅰ~Ⅱ期32例,Ⅲ~Ⅳ期64例;肿瘤分化程度:高/中分化程度54例,低分化程度42例;淋巴结转移:有43例,无53例。纳入标准:(1)经病理活检组织学检查诊断为NPC;(2)初发且初次诊治,确诊后于本院接受放化疗治疗;(3)临床资料完整。排除标准:(1)NPC复发患者;(2)合并其他器官严重疾病患者;(3)因自身原因放弃或中断治疗患者;(4)合并精神障碍性疾病患者。
本研究符合赫尔辛基宣言原则,并经本院伦理委员会审核通过。患者及家属已签署知情同意书。
1.2方法
1.2.1检测方法 留取NPC癌和癌旁组织(距离癌组织0.5 cm以上),石蜡包埋切片。实验步骤:70 ℃烤片1 h,二甲苯脱蜡,梯度乙醇水化,将切片置于柠檬酸盐溶液中,微波炉中100 ℃ 10 min,自然冷却后,H2O2阻断15 min,3%羊血清封闭2 h,一抗(稀释比1∶1 000)4 ℃孵育16 h,SUMO2鼠单克隆抗体购自美国GeneTex公司,货号GTX35096。TRIM21兔单克隆抗体购自美国Abcam公司,货号ab207728。二抗室温孵育1 h,DAB显色液显色5 min,苏木素复染,盐酸乙醇分化后梯度脱水封片,镜下(日本奥林巴斯公司,型号DX31)观察染色情况。染色强度评分:未染色为0分,浅黄色1分,棕褐色颗粒2分。染色阳性细胞百分比评分: ≤25%为1分,>25%~50%为2分,≥50%为3分。两者的乘积为最终染色评分,≥2分定义为阳性,<2分为阴性[7]。
1.2.2治疗及随访 所有患者确诊后,均于本院接受放化疗。调强放射治疗:原发灶放疗总剂量70 Gy,转移淋巴结区64 Gy,每日1次,每周5次,30次完成;肿瘤分期Ⅲ~Ⅳ期者同时接受顺铂为基础的诱导+同步化疗或辅助化疗,诱导化疗方案为:化疗第1日多西他赛70 mg/m2(太极集团四川太极制药有限公司,国药准字 H20103665),在第1~3天给予顺铂(齐鲁制药有限公司,国药准字H20023461)25 mg/m2,第1~5天给予5氟尿嘧啶(悦康药业集团有限公司,国药准字 H11020237)500 mg/m2。每隔 21天为一个周期,总共 2~3 个周期。同期放化疗:即在放疗第1天开始给予顺铂100 mg/m2,每3周1次,21 d为1个周期,同期治疗2个周期。NPC患者治疗结束后开始随访,随访5年。随访间隔:第1~2年内每3个月随访1次,第3~5年每6个月随访1次,以门诊和电话方式进行回访,随访截止时间为2023年3月1日。终点事件为患者死亡或随访时间截止。
1.3统计学处理 采用SPSS25.0统计学软件进行数据分析。计数资料采用例数或百分率表示,组间比较采用χ2检验。SUMO2、TRIM21蛋白表达相关性采用Spearman秩相关分析。绘制Kaplan-Meier曲线,不同SUMO2、TRIM21表达生存曲线比较采用Log-rank检验。单因素及多因素Cox回归分析NPC预后影响因素。以P<0.05为差异有统计学意义。
2 结 果
2.1NPC癌与癌旁组织中SUMO2、TRIM21表达 NPC癌组织中SUMO2棕黄色阳性染色主要位于细胞核,TRIM21棕黄色阳性染色主要位于细胞质和细胞膜。NPC癌组织中SUMO2、TRIM21阳性率分别为72.92%(70/96)、75.00%(72/96),高于癌旁组织的6.25%(6/96)、7.29%(7/96),差异具有统计学意义(χ2=89.205、90.870,P<0.001、0.001)。见图1。

图1 癌组织与癌旁组织中SUMO2、TRIM21表达 (免疫组化,×200)
2.2NPC癌组织中SUMO2与TRIM21表达相关性 NPC癌组织中SUMO2与TRIM21蛋白表达呈显著正相关(r=0.756,P<0.001)。
2.3癌组织中SUMO2、TRIM21表达与NPC临床病理特征的关系 临床分期Ⅲ~Ⅳ期、低分化程度、有淋巴结转移NPC癌组织中SUMO2、TRIM21表达阳性率高于临床分期Ⅰ~Ⅱ期、高/中分化程度、无淋巴结转移癌组织,差异有统计学意义(均P<0.05)。见表1。

表1 癌组织中SUMO2、TRIM21表达与NPC临床病理特征的关系[n(%)]
2.4癌组织SUMO2、TRIM21表达与NPC患者生存预后的关系 本研究96例NPC患者随访中失访2例,死亡26例,5年生存率为72.92%(70/96)。SUMO2表达阳性及阴性组的5年生存率分别为67.14%(47/70)、88.46%(23/26),SUMO2表达阳性组5年累积生存率低于阴性组,差异有统计学意义(Log-rankχ2=4.757,P=0.029)。TRIM21表达阳性及阴性组5年生存率为66.67%(48/72),91.67%(22/24),TRIM21表达阳性组5年累积生存率低于阴性组,差异具有统计学意义(Log-rankχ2=5.303,P=0.021)。见图2。
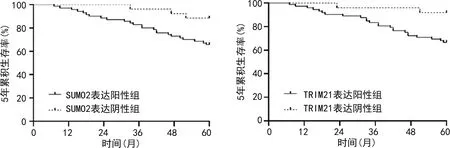
图2 Kaplan-Meier曲线分析SUMO2、TRIM21表达对NPC患者预后的影响
2.5Cox回归分析NPC患者预后影响因素 以NPC患者预后为因变量(1=死亡,0=生存,t=时间),纳入年龄、性别、吸烟史、肿瘤分化程度、病理类型、淋巴结转移、临床分期、SUMO2、TRIM21为自变量,单因素和多因素Cox回归分析结果显示,临床分期Ⅲ~Ⅳ期、低分化程度、淋巴结转移、SUMO2与TRIM21表达阳性是影响NPC预后的独立危险因素。见表2、表3。

表2 单因素Cox回归分析
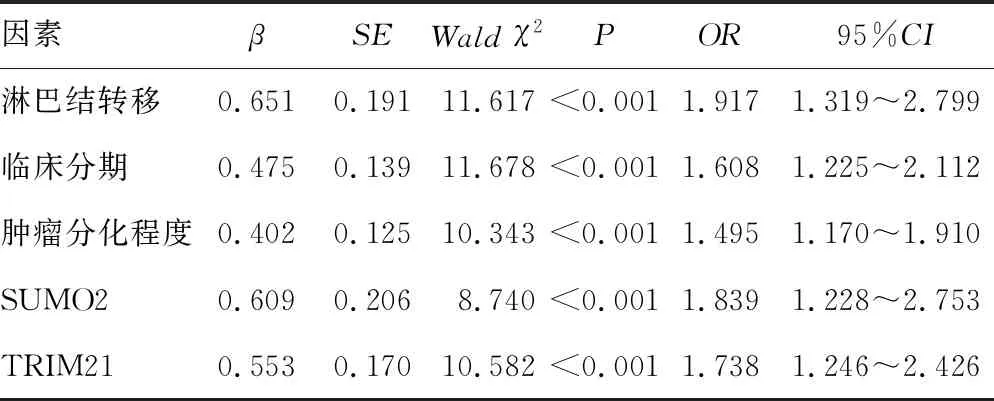
表3 多因素Cox回归分析
3 讨 论
NPC是我国高发的恶性肿瘤之一,南方较为常见。NPC临床表现为鼻塞、涕中带血及颈部淋巴结肿大等症状,由于早期症状不典型,临床上不易早期诊断。NPC解剖位置隐匿,恶性程度高,容易出现淋巴结转移,多数患者初诊时已为局部晚期[7]。放疗是NPC的主要治疗方式,虽然经积极放疗及同步辅助化疗使NPC患者临床结局有所改善,但仍有患者可出现肿瘤复发和转移,导致患者死亡[8]。深入研究NPC的疾病发生及机制,寻找能够评估NPC患者预后的肿瘤标志物,具有重要意义。
小类泛素相关修饰蛋白是分子结构类似于泛素的蛋白,包括SUMO1~4四种亚型,能够可逆性翻译后修饰蛋白,调节蛋白稳定性[9]。SUMO2主要与应激相关靶蛋白共价结合,参与DNA损伤修复、免疫应答及细胞凋亡等过程的调控[4]。近年来有研究发现,SUMO2的表达失调能激活转化生长因子β信号通路,促进肿瘤细胞的侵袭和迁移,导致膀胱癌等恶性肿瘤进展[10]。本研究中,NPC癌组织中SUMO2表达升高,与不良临床病理特征有关,提示SUMO2促进NPC的肿瘤发展。NPC中SUMO2的表达与非编码RNA调控有关。有研究发现,NPC肿瘤细胞中环状RNA circRNF13通过与SUMO2 mRNA的3′非翻译区结合,延长SUMO2 mRNA的半衰期,激活SUMO2蛋白表达,而SUMO2的表达上调通过促进葡萄糖转运蛋白1的SUMO化降解,激活肿瘤细胞糖酵解途径,促进NPC肿瘤细胞的增殖和转移[11]。尚有研究发现,胰腺癌细胞中SUMO2通过与KRAS蛋白的赖氨酸113残基处结合,诱导其过度激活,增强异质性胞核核糖核蛋白A1的外泌体分泌,促进肿瘤淋巴管生成和淋巴转移的发生[12]。本研究发现,SUMO2阳性的NPC患者预后较差,提示SUMO2是新的评估NPC预后的肿瘤标志物。分析其原因,可能是SUMO2的表达能够促进细胞DNA损伤修复,降低放化疗治疗的敏感性。ZHAO等[13]报道,SUMO2的表达上调通过促进细胞核中γ-肌动蛋白的SUMO化来促进DNA损伤修复并减轻心肌损伤,而沉默SUMO2的表达后则进一步加剧DNA损伤,促进细胞氧化应激损伤及凋亡。ZHANG等发现[14],乳腺癌中SUMO2的表达能够在DNA损伤晚期促进MORC家族CW型锌指结构蛋白2的SUMO化修饰,进而磷酸化激活DNA依赖性蛋白激酶催化亚基,促进DNA损伤修复,应用SUMO2抑制剂后能增加乳腺癌细胞对化疗药物的敏感性。因此,SUMO2的表达促进NPC的发生发展,是NPC患者不良预后的肿瘤标志物,SUMO2可能是潜在的NPC肿瘤治疗靶点。
TRIM21是TRIM家族成员,又称为Ro52,含有RING锌指、B盒及卷曲螺旋三个结构域,参与干扰素调节转录因子的泛素蛋白酶体途径降解,调节机体天然抗病毒免疫反应[15]。有研究发现,TRIM21能够通过泛素化细胞周期蛋白依赖性激酶抑制剂p27,促进细胞周期的进展,导致肿瘤过度增殖[16]。本研究中,NPC癌组织中TRIM21表达升高,与临床分期、分化程度及淋巴结转移有关,提示NPC中TRIM21的表达上调促进肿瘤的恶性进展。NPC中TRIM21表达上调与表达调控失调有关。有研究发现,NPC中WD重复结构域磷酸肌醇相互作用表达缺失,导致其不能结合并抑制TRIM21的表达及功能,抑制肿瘤细胞自噬,进而促进肿瘤的增殖、侵袭及转移[17]。此外,TRIM21还能够通过介导小G蛋白信号调节因子1的泛素化和蛋白降解,激活丝裂原活化蛋白激酶通路,促进NPC肿瘤细胞的侵袭和转移[18]。本研究中,TRIM21表达与NPC患者不良预后有关,提示检测NPC癌组织中TRIM21的表达能够评估NPC患者的生存预后。分析其原因,可能是TRIM21的表达能够增强肿瘤细胞对放化疗治疗的抵抗性。ZHANG等[19]报道,电离辐射后,TRIM21通过介导Serpin家族B成员5的泛素化降解,抑制鸟嘌呤单磷酸合成酶进入细胞核,抑制TP53的表达,从而保护NPC细胞免受辐射介导的细胞凋亡。此外,NPC中TRIM21的表达能够促进线粒体电压依赖性阴离子选择性通道蛋白2的泛素化降解,释放线粒体DNA,抑制辐射暴露后的I型干扰素反应,降低NPC细胞的抗原呈递能力及细胞毒性T细胞介导的抗肿瘤免疫[20]。
本研究中,NPC癌组织中SUMO2与TRIM21蛋白表达呈正相关,提示两者可能存在协同作用。有研究发现,结直肠癌中TRIM21的表达受SUMO化修饰的调节,肿瘤细胞中较高的SUMO化水平能上调TRIM21表达,促进POU 2类同源盒1泛素化降解,增强肿瘤细胞干细胞特性,增强化疗及放疗治疗抵抗性,促进肿瘤转移和复发[21]。因此,SUMO2与TRIM21在NPC中可能发挥协同促癌的生物学作用,值得深入研究。
综上所述,NPC中SUMO2、TRIM21表达升高,两者与NPC不良临床病理特征有关,均能促进NPC的肿瘤进展。SUMO2,TRIM21阳性的NPC患者预后较差,是新的评估NPC预后的肿瘤标志物,辅助临床医生对NPC患者进行诊治。本研究的不足在于样本量有限,未能对不同NPC亚型进行分层研究,有待今后扩大样本量深入研究二者在NPC中的作用机制。
