帕金森病患者血清LCN2、PROS1水平变化及其与疾病分期、认知障碍的相关性*
2024-05-13单树崇吴召军
单树崇,吴召军,何 清
徐州市第一人民医院神经内科,江苏徐州 221000
帕金森病(PD)是常见的神经系统变性疾病,好发于老年人群,病理上主要表现为黑质多巴胺能神经元变性坏死,临床上表现为行动迟缓、静止性震颤等典型运动症状及认知功能障碍、感觉障碍等非运动症状[1]。认知功能障碍是较为常见的非运动症状,严重影响患者的生活质量[2]。深入研究影响PD患者认知功能障碍发生的因素,对于延缓帕金森痴呆的发生,提高患者生活质量具有重要临床意义。脂质运载蛋白2 (LCN2)是脂质运载蛋白家族成员,是相对分子质量为25×103的分泌型糖蛋白,参与调节细胞死亡、细胞迁移及细菌感染等多种生物学过程[3]。近年来有研究发现,LCN2能够通过促进小胶质细胞及星形胶质细胞的凋亡,促进阿尔兹海默病等神经退行性疾病认知功能障碍的发生[4]。蛋白S基因(PROS1) 编码蛋白是一种维生素K依赖性血浆蛋白,是抗凝血酶活性蛋白C的辅因子,参与血液凝固的抑制,与恶性肿瘤等疾病关系密切[5]。近年来有学者利用生物信息学分析发现,PD患者外周血单个核细胞中PROS1表达上调,参与调节PD患者体液免疫功能,影响PD的疾病进展,是潜在的PD生物标志物或治疗靶点[6]。目前PD患者血清LCN2、PROS1水平及其与PD患者疾病分期和认知障碍的关系尚不清楚。本研究通过检测PD患者血清LCN2、PROS1水平,探讨两者的临床意义。
1 资料与方法
1.1一般资料 选取2019年1月至2022年12月本院诊治的PD患者120例为研究对象(PD组)。其中,男66例,女54例;年龄60~89岁,平均(70.41±6.72)岁;合并高血压史40例;合并糖尿病史21例,合并高血脂史33例。纳入标准:(1)PD诊断符合中华医学会神经病学分会2016年制定的《中国帕金森病的诊断标准》[7];(2)患者及家属对本研究知情同意并签署执勤同意书。排除标准:(1)继发性帕金森综合征或叠加综合征;(2)阿尔兹海默病、血管性痴呆及其他疾病引起的认知功能障碍;(3)合并精神分裂症、抑郁症等严重精神疾病;(4)合并肝肾功能不全、心肺功能衰竭及全身重度感染等严重疾病;(5)合并恶性肿瘤;(6)合并凝血功能障碍性疾病。另选择同期健康体检的60例体检健康者为对照组。其中,男32例,女28例;年龄51~87 岁,平均(68.78±9.15)岁;合并高血压史19例;合并糖尿病史7例;合并高血脂史10例。两组患者性别、年龄、高血压史、糖尿病史及高血脂史比较,差异均无统计学意义(均P>0.05),具有可比性。本研究经本院伦理委员会批准通过。
1.2方法
1.2.1血清LCN2、PROS1水平检测 留取PD组及对照组清晨空腹静脉血5 mL,室温静置1 h,3 000 r/min离心10 min,离心半径为10 cm,分离上层血清。采用酶联免疫吸附试验(ELISA)检测血清LCN2、PROS1水平。人LCN2 ELISA试剂盒购自上海优科唯生物公司(货号:YKW-112375)。人蛋白S PROS1 ELISA试剂盒购自钰博生物公司(货号:YB73319Hu)。实验步骤严格按照试剂盒说明书进行。
1.2.2PD严重程度分期及认知功能障碍评估 PD严重程度分期参考改良版Hoehn-Yahr分级表(H-Y分级)[8]。H-Y分级0~1.5级的PD患者分为早期PD组(n=50),H-Y分级>1.5~3.0级的PD患者分为中期PD组(n=39),H-Y分级>3.0~5.0级的PD患者分为晚期PD组(n=31)。采用蒙特利尔认知评估(MoCA)[9]和简易智能精神状态检查量表(MMSE)[10]对PD患者认知功能障碍判断。MoCA评分内容包括注意力、执行功能、记忆力、语言功能、视结构技能、抽象思维、计算力和定向力共8个认知领域,量表评分范围0~30分,分数越高,认知功能越好。MMSE评分内容包括时间及地点定向力、记忆力、注意力和计算力、回忆力、语言、视空间能力共7个认知领域,量表总分范围0~30分,分数越高,认知功能越好。MoCA评分<26分,MMSE评分<27分的PD患者分为认知功能障碍组(n=66),MoCA评分≥26分,MMSE评分≥27分的PD患者分为认知功能正常组(n=54)。
1.2.3观察指标 收集所有PD患者性别、年龄、教育水平、病程、高血压史、糖尿病史及高血脂病史等一般临床资料。
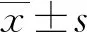
2 结 果
2.1PD组和对照组血清LCN2、PROS1水平比较 PD组血清LCN2、PROS1水平分别为(97.47±11.28)μg/L,(77.52±8.69)μg/L,明显高于对照组(40.15±6.22)μg/L,(32.49±4.37)μg/L,差异均有统计学意义(t=36.641、37.783,P<0.001)。
2.2不同疾病分期PD患者血清LCN2、PROS1水平比较 单因素方差分析显示,早期、中期及晚期PD组患者血清LCN2、PROS1水平之间比较,差异均有统计学意义(均P<0.05),进一步两两比较,晚期PD组血清LCN2、PROS1水平高于中期PD组,中期PD组血清LCN2、PROS1水平高于早期PD组,差异均有统计学意义(均P<0.05)。见表1。
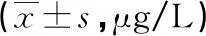
表1 不同疾病分期PD患者血清LCN2、PROS1水平比较
2.3不同认知功能PD患者临床资料及血清LCN2、PROS1水平比较 认知障碍组PD患者病程、血清LCN2、PROS1、H-Y分级均高于认知正常组患者,而MoCA评分、MMSE评分低于认知正常组,差异均有统计学意义(P<0.05)。见表2。
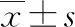
表2 不同认知功能PD患者临床资料及血清LCN2、PROS1水平比较[n/n或或 n(%)或M(P25~P75)]
2.4血清LCN2、PROS1水平与PD患者认知功能障碍的相关性 Spearman相关性分析显示,血清LCN2、PROS1水平与PD患者MoCA评分,MMSE评分呈负相关,与H-Y分级呈正相关(均P<0.05)。见表3。
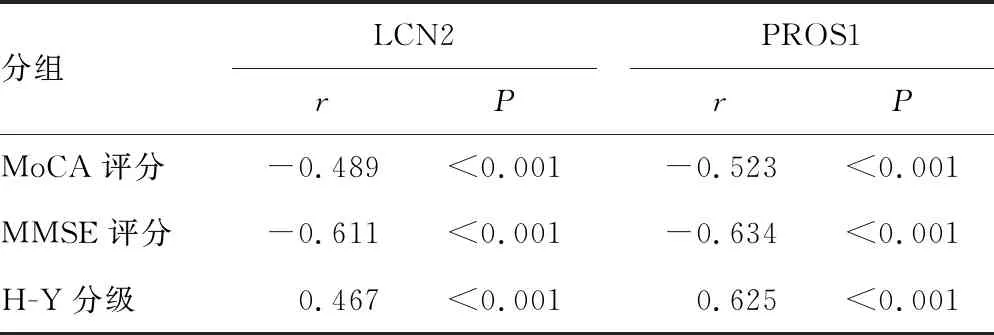
表3 血清LCN2、PROS1水平与PD患者认知功能障碍的相关性
2.5多因素Logistic回归分析影响PD患者认知功能障碍的相关因素 以PD患者是否发生认知功能障碍为因变量,以血清LCN2、PROS1为自变量,以病程、MoCA评分、MMSE评分、H-Y分级同时校正,纳入多因素Logistic回归分析,结果血清LCN2、PROS1是影响PD患者认知功能障碍的相关危险因素。见表4。

表4 多因素Logistic回归分析影响PD患者认知功能障碍的相关因素
2.6血清LCN2、PROS1对PD患者认知功能障碍的预测价值 ROC曲线分析结果显示,血清LCN2、PROS1单独及两者联合检测对PD患者认知功能障碍预测的曲线下面积(AUC)为0.803(95%CI:0.764~0.849),0.836(95%CI:0.770~0.867),0.905(95%CI:0.868~0.955),血清LCN2、PROS1联合检测AUC明显高于单独检测,差异具有统计学意义(Z=5.558,4.974,P<0.001)。两者联合检测的灵敏度为0.884,特异度为0.755。见表5。
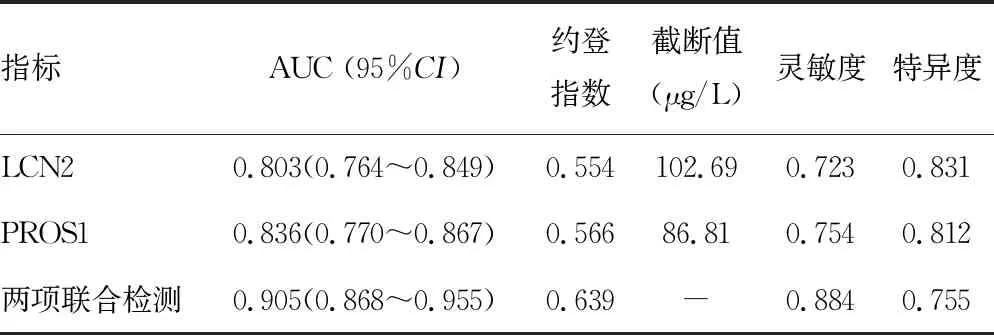
表5 血清LCN2、PROS1对PD患者认知功能障碍的预测价值
3 讨 论
PD是老年人群神经系统最常见的疾病之一。PD患者的症状包括运动症状和非运动症状,其中认知功能障碍是PD典型的非运动症状,严重影响PD患者的功能结局和生活质量,严重时可导致患者残疾,甚至死亡。PD患者认知功能障碍的发生机制尚不清楚,可能与线粒体损伤、细胞能量衰竭、氧化应激及α突触核蛋白聚集等因素有关[2]。深入研究PD患者认知功能障碍的疾病机制,寻找能够早期诊断的血清标志物,对于延缓病情进展,改善患者临床预后具有重要的临床意义。本研究120例PD患者中,伴有认知功能障碍者66例,占55%,这与既往学者报道的PD患者伴有认知功能障碍发生率50%~60%的结果一致[11-12]。
LCN2是一种相对分子质量为25×103的先天性免疫蛋白,在生理条件下参与铁代谢调控[13]。近年来有研究发现,在炎症、多发性硬化及神经退行性疾病中,LCN2水平上调,与神经系统损伤有关[14]。本研究中,PD患者血清LCN2水平升高,并与PD疾病严重程度有关,提示LCN2参与PD疾病的发生、发展。PD中LCN2的水平上调与神经系统炎症调节关系密切。有研究表明,PD中α-突触核蛋白及促炎性细胞因子的释放能够促进大脑星形胶质细胞中LCN2的表达[15]。LCN2水平上调进一步诱导促炎性细胞因子的表达,加重神经元的铁超载,造成神经元氧化应激损伤,导致实验动物严重的行为学缺陷[16]。此外,相比于LCN2野生型,LCN2基因敲除能够明显抑制海藻酸盐诱导的神经元细胞死亡、血脑屏障破坏和神经炎症[17]。因此,LCN2是新的PD血清标志物,其水平升高有助于反映PD疾病严重程度。LCN2主要表达于海马星形胶质细胞中,其受体主要分布于神经元、小胶质细胞和星形胶质细胞中。本文推测,LCN2的异常表达可能与PD患者认知功能障碍有关。本研究证实,PD患者血清LCN2水平升高与认知功能障碍有关,是影响PD患者认知功能障碍的相关危险因素,提示LCN2是新的评估PD患者认知功能障碍的新的血清标志物。有研究发现,海马神经元中的LCN2的水平升高能够通过抑制血红素加氧酶-1的表达,促进组织巨噬细胞浸润、神经炎症,增加血脑屏障通透性,导致记忆缺陷和认知功能障碍[18]。此外,脑缺血动物实验中证实,LCN2基因缺陷小鼠海马神经元促炎细胞因子产生减少,海马神经元凋亡减少,实验动物认知能力得到改善[19]。
TAM受体是受体酪氨酸激酶家族的一个亚群,包括Tyr3、Axl和Mertk三种受体。PROS1是TAM受体的配体,在中枢神经系统如蓝斑和脉络丛等组织中表达,不仅作为凝血因子降解的辅助因子参与抗凝过程,还参与组织修复、炎症和细胞存活、增殖和迁移等多种生物学过程,与阿尔兹海默病、多发性硬化及PD等神经退行性疾病相关[20]。本研究中,PD患者血清PROS1水平升高,这与既往学者在PD外周血单个细胞中检测PROS1水平上调的结果一致[6]。此外,血清PROS1水平与PD疾病严重程度有关,提示PROS1参与PD疾病的发生发展。分析其原因,PD中小胶质细胞中转录因子核因子红细胞2的水平下调导致TAM受体中Axl和Mertk的表达缺失,不能与PROS1结合,导致PROS1水平升高,而该通路的抑制降低了小胶质细胞的吞噬和炎症清除能力,加剧了α突触核蛋白的沉积,进而加重神经系统的炎症和神经元损伤,促进PD疾病进展[21]。近年来,有学者发现PROS1在成年海马神经干细胞和祖细胞中表达,参与海马神经干细胞和祖细胞的神经元分化调节[22]。鉴于海马神经元在认知功能的重要作用,本文推测血清PROS1水平可能有助于评估PD患者认知功能障碍情况。本研究证实,PD患者血清PROS1水平升高与认知功能障碍有关,是影响PD患者认知功能障碍的相关危险因素,表明血清PROS1水平有助于评估PD患者认知功能障碍。本文分析,PROS1的水平升高提示中枢神经系统TAM受体通路功能失调,导致神经发生和神经元迁移、突触可塑性、髓鞘形成和神经修复等功能障碍,促进PD患者认知功能障碍的发生。有研究报道,PROS1能够通过TAM受体,激活Notch1信号通路,促进海马神经干细胞的增殖及分化,但PROS1的异常表达上调促进Bmi-1的信号传导,增加海马神经元的神经毒性,造成海马神经元的损伤,导致 PD患者认知功能障碍的发生[22-23]。本研究结果显示,血清LCN2、PROS1联合检测对PD患者认知功能障碍具有较高的预测价值,联合检测的灵敏度为0.884,特异度为0.755。临床医生可根据血清LCN2、PROS1水平,对PD患者认知功能障碍的发生风险进行评估,积极采取相应治疗措施,改善PD患者认知功能障碍的病情,提高患者生活质量。
综上所述,PD患者血清LCN2、PROS1水平升高,两者表达与PD疾病严重程度分期及认知功能障碍程度有关。血清LCN2、PROS1升高是影响PD患者认知功能障碍的相关危险因素,血清LCN2、PROS1联合检测对PD患者认知功能障碍具有较高的预测价值。但本研究未能前瞻性研究血清LCN2、PROS1对PD患者认知功能障碍发生的影响,有待后续进行更全面的研究,为临床早期诊治提供新方向。
