血清Ang-2、IL-33与慢性阻塞性肺疾病急性加重期并发呼吸衰竭患者预后的相关性分析*
2024-05-13岑欣媛唐丹丹严晓娟
岑欣媛,胡 辉,甘 晟,唐丹丹,严晓娟△
1.洪湖市人民医院呼吸内科,湖北洪湖 433200;2.湖北文理学院附属医院/襄阳市中心医院呼吸内科,湖北襄阳 441021
慢性阻塞性肺疾病(COPD)是临床上常见的一种破坏性肺部疾病,其主要是以不完全可逆气流受限为主,COPD急性加重期(AECOPD)使患者症状加重,破坏肺功能正常运行,最终导致患者出现呼吸衰竭(RF),AECOPD并发RF会给患者带来极大的痛苦,且累及损伤较多的器官、组织,使病死率逐步上升[1]。有研究表明,AECOPD并发RF的发病机制复杂,目前尚未有明确定论,其预后差[2]。血清标志物是近年来研究的热点,其检测方法简便,受到研究者的广泛青睐。血管生成素-2(Ang-2)属于血管生成素家族,是一种分泌糖蛋白,其可通过抑制血管内皮功能参与血管重塑,并与COPD的发生密切相关[3]。另外,有研究发现,AECOPD患者血清Ang-2水平升高,与动脉血氧分压(PaO2)呈负相关,当患者从急性加重期临床恢复后,Ang-2水平显著降低[4]。白细胞介素(IL)-33是IL家族成员,其通过在气道上皮和炎症细胞之间形成正反馈环来促进免疫应答,在COPD患者血清中上调,并会影响患者肺功能[5]。但关于Ang-2与IL-33在AECOPD并发RF患者预后的关系目前研究较少,基于以上分析,本研究主要探讨血清Ang-2与IL-33在AECOPD并发RF患者预后中的预测价值,以及与预后的关系,以期为AECOPD并发RF患者的预后评估提供更可靠的生物指标。
1 资料与方法
1.1一般资料 选取2019年12月至2021年12月在洪湖市人民医院(下称本院)进行诊治的AECOPD并发RF患者120例作为研究组,纳入标准:(1)符合有关AECOPD的诊断标准[6];(2)经肺功能检测及胸部CT检测确诊为AECOPD;(3)合并有RF;(4)年龄>20岁;(5)依从性良好能完成随访。排除标准:(1)伴有心、肝、肾等其他脏器功能不全患者;(2)合并有其他呼吸疾病患者;(3)合并恶性肿瘤、先天性免疫系统疾病患者;(4)合并有精神疾病及认知功能障碍患者;(5)孕产妇。另选取同期在本院进行诊治的单纯AECOPD未发生RF患者120例作为AECOPD组,以及同期在本院行健康体检的体检健康者120例作为对照组。本研究已通过本院伦理委员会的审核并批准(伦理号:2019-000705),患者知情同意并签署知情同意书。
1.2血清指标与肺功能检测 采集患者入院后24 h内空腹静脉血5 mL,经离心后收集血清,置于-80 ℃保存备用。采用酶联免疫吸附试验(ELISA)测定患者血清Ang-2(试剂盒购自上海恒斐生物科技有限公司,货号:CSB-E04500h-1)与IL-33(试剂盒购自武汉菲恩生物科技有限公司,货号:P8572)水平。严格按照试剂盒操作说明书进行。用肺功能检测仪记录患者第1秒用力呼气容积占预计值比例(FEV1%)、第1秒用力呼气容积与用力肺活量比值(FEV1/FVC)。
1.3预后分组及一般资料收集 患者出院后进行1年随访,随访截止时间为2022年12月,依据肺功能损伤程度[7]将研究组患者分为预后良好组(n=85)和预后不良组(n=35),预后良好组患者咳嗽、呼吸困难等临床症状改善,患者肺功能损伤减轻;患者咳嗽、呼吸困难等临床症状未得到改善,肺功能损伤程度加重为预后不良组。收集患者一般资料[包括年龄、性别、体重指数(BMI)、高血压史、糖尿病史、吸烟史、病程],血脂指标[三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)],血气指标[动脉血氧分压(PaO2)、动脉二氧化碳分压(PaCO2)、血氧饱和度(SaO2)],炎症指标[IL-8、肿瘤坏死因子α(TNF-α)、C反应蛋白(CRP)]等。
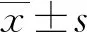
2 结 果
2.1各组受试者血清Ang-2与IL-33水平比较 与对照组相比,AECOPD组和研究组血清Ang-2与IL-33水平升高,差异有统计学意义(P<0.05);与AECOPD组相比,研究组血清Ang-2与IL-33水平升高,差异有统计学意义(P<0.05),见表1。
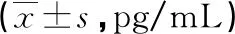
表1 各组受试者血清Ang-2与IL-33水平比较
2.2预后良好组与预后不良组血清Ang-2与IL-33水平比较 与预后良好组相比,预后不良组患者血清Ang-2、IL-33水平升高,差异有统计学意义(P<0.05),见表2。

表2 预后良好组与预后不良组血清Ang-2与IL-33水平比较
2.3预后不良组与预后良好组的一般资料比较 预后不良组患者年龄、性别、BMI、高血压史、糖尿病史、吸烟史、TG、TC、HDL-C、LDL-C等指标与预后良好组比较,差异无统计学意义(P>0.05);预后不良组患者PaO2、PaCO2、SaO2、FEV1%、FEV1/FVC显著低于预后良好组,IL-8、TNF-α和CRP水平显著高于预后良好组,差异有统计学意义(P<0.05),见表3。
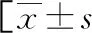
表3 预后不良组与预后良好组的一般资料比较或n(%)]
2.4研究组血清Ang-2、IL-33与一般资料和炎症指标的相关性 校正年龄、性别、BMI后,经偏相关性分析显示,血清Ang-2分别与FEV1%、FEV1/FVC呈负相关(r=-0.202、-0.187,均P<0.05),与IL-8、TNF-α、CRP水平呈正相关(r=0.149,0.157,0.239,均P<0.05);血清IL-33分别与FEV1%、FEV1/FVC呈负相关(r=-0.195、-0.229,均P<0.05),与IL-8、TNF-α、CRP水平呈正相关(r=0.285,0.256,0.167,均P<0.05)。
2.5ROC曲线分析血清Ang-2与IL-33对研究组患者预后不良的诊断价值 以患者预后结局为检验状态(预后良好=0,预后不良=1),以Ang-2与IL-33为检验变量,并采用二元Logistic回归模型将两指标预测概率转化得到联合预测概率,同时将预测概率也作为检验变量绘制ROC曲线,结果显示,血清Ang-2预测患者预后不良的AUC为0.864(95%CI:0.822~0.908),血清IL-33预测患者预后不良的AUC为0.850(95%CI:0.788~0.917);采用二元Logistic回归分析建立各项指标诊断AECOPD并发RF的联合检测方程:Logit(P)=1.278×Ang-2+1.479×IL-33-5.809,并绘制ROC曲线,二者联合预测患者预后不良的AUC为0.945(95%CI:0.902~0.990),优于二者单独预测(Z两者联合-Ang-2=1.995、P=0.035;Z两者联合-IL-33=1.978,P=0.023),见表4。
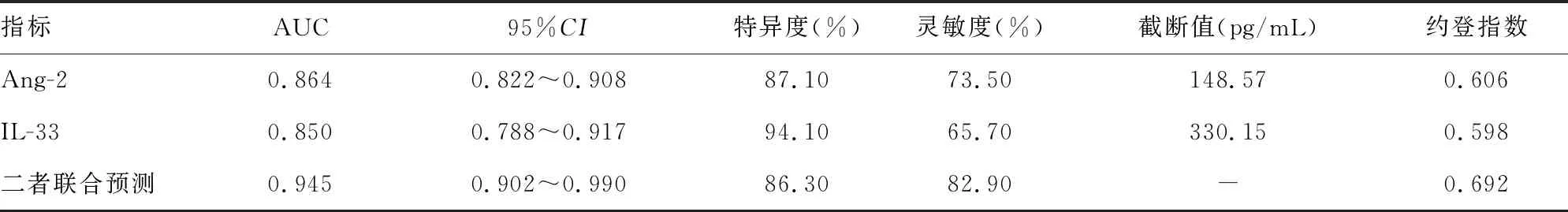
表4 ROC曲线分析血清Ang-2与IL-33对AECOPD并发RF患者预后不良的诊断价值
2.6Logistic回归分析影响患者预后不良的危险因素 以ROC曲线中血清Ang-2与IL-33截断值为界限,其中血清Ang-2≥148.57 pg/mL为高表达,<148.57 pg/mL为低表达;血清IL-33≥330.15 pg/mL为高表达,<330.15 pg/mL为低表达;PaO2、PaCO2、SaO2中位数分别为68.11 mmHg、57.06 mmHg、81.61%,以中位数为界限将其分为高水平和低水平。
以AECOPD并发RF患者预后为因变量(预后不良=1,预后良好=0),将单因素分析中有统计学意义的指标,即以PaO2(低水平=1,高水平=0)、PaCO2(低水平=1,高水平=0)、SaO2(低水平=1,高水平=0)、Ang-2(高表达=1,低表达=0)、IL-33(高表达=1,低表达=0)为自变量进行多因素Logistic回归分析,结果显示Ang-2、IL-33、PaO2、PaCO2、SaO2是患者预后不良的影响因素(P<0.05),见表5。
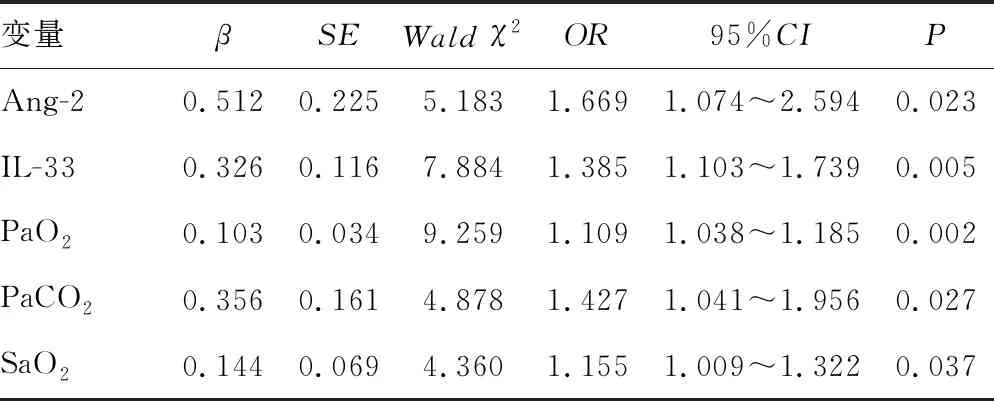
表5 Logistic回归分析AECOPD并发RF患者预后不良的影响因素
3 讨 论
COPD的主要病理表现有气道壁结构破坏及炎症导致的肺动脉高压、肺气肿形成及管腔狭窄,当器官损伤严重到一定程度后,其换气与通气功能受到一定的影响,引发呼气衰竭的现象,对患者的生命造成严重威胁[8]。目前随着医学技术的不断发展,对于AECOPD并发RF的诊治取得了一定的疗效,但由于其预后较差,据调查约有30.00%的患者出现预后不良[9]。本研究中预后不良的发生率为29.17%(35/120),与上述结果基本一致,表明AECOPD并发RF预后不良发生的风险较高,因此积极找寻能够预测患者预后的生物指标对于改善患者预后意义重大。
有研究发现COPD与慢性炎症有关,多种细胞因子参与组织损伤的病理过程中[10]。有学者认为,IL-8、TNF-α直接参与了COPD气道炎症的全过程,不仅直接导致肺组织慢性损伤,而且也严重影响氧化/抗氧化的系统平衡[11]。Ang是一种分泌型的生长因子,而Ang-2具有明显的促炎作用,在一些重症疾病患者中,大量的Ang-2可激活血管内皮生长因子,增加血管的通透性,使炎症反应加重[12]。本研究发现预后不良组患者血清Ang-2水平显著高于预后良好组,与炎症指标IL-8、TNF-α、CRP水平呈正相关,且是影响预后不良的危险因素,提示Ang-2的异常升高与患者的预后不良关系密切。有研究表明,Ang-2可以诱导活性氧簇生成核因子和巨噬细胞,增加炎症因子的释放,扩大炎症反应,加快器官衰竭[13]。AECOPD并发RF疾病本身与炎症反应有关,可能是Ang-2促进了炎症因子释放,引起患者的炎症反应,从而加重了患者的病情。
近年来有研究发现,IL-33是新型的内源炎症因子,由黏膜分泌而产生,刺激核转录因子信号转导,促进T细胞2释放炎症介质,可促进黏膜的局部炎症反应[14-15]。汪矗等[16]通过回顾性分析,发现IL-33在AECOPD患者血清中明显高于健康者,其水平的异常升高使Th1/Th2的平衡移向Th2,削弱了AECOPD患者防御机制,患者的喘息症状加剧。本研究中血清IL-33在预后不良组患者中水平异常升高,与炎症指标IL-8、TNF-α、CRP水平呈正相关,且是预后不良的影响因素,提示IL-33的异常表达与患者的预后有关,原因可能是其水平升高导致炎症反应,引起患者病情加重。王新刚等[17]研究发现Ang-2、IL-33在重症医学科创伤后急性呼吸窘迫综合征患者中水平显著升高,可用于评估患者的病情和预后。本研究中血清Ang-2、IL-33联合对AECOPD并发RF患者预后的预测价值优于二者单独预测,提示临床上可通过检查血清Ang-2、IL-33水平,评估患者预后,并及时采取相应的治疗措施,改善预后不良情况。
PaO2、PaCO2是临床上常见的血气指标,也用于评价COPD的预后[18]。有研究发现,对AECOPD合并的RF患者采取科学有效的治疗方案,能改变PaO2、PaCO2的表达,提高对患者的治疗效果[19]。本研究中PaO2、PaCO2在预后不良组与预后良好组中差异有统计学意义(P<0.05),提示临床上可注意对患者PaO2与PaCO2指标检测,以初步判断患者的病情程度。FEV1%与FEV1/FVC是常见的评价肺功能的指标,本研究中预后不良组患者FEV1%、FEV1/FVC水平显著低于预后良好组,提示预后不良组的肺功能更差,病情越严重,FEV1%、FEV1/FVC水平越低,原因可能是AECOPD合并RF患者的炎症反应较强,炎症因子破坏了肺部的小气道和肺泡组织,进而导致患者的肺功能出现明显的下降。另外本研究中血清Ang-2、IL-33与FEV1%、FEV1/FVC分别呈负相关,表明了Ang-2与IL-33的异常表达与患者肺功能下降有关,再次证明了二者与患者预后关系密切。
综上所述,血清Ang-2、IL-33在AECOPD合并RF预后不良患者中均表达上调,二者联合对患者预后的评估价值良好,且是影响患者预后不良的危险因素,可作为AECOPD合并RF患者的预后指标,本研究具有一定的创新性和临床意义。本研究局限在于研究血液样本量相对较少,所取样本范围较为及集中,未能纳入不同分期患者且未通过动态分析血清Ang-2、IL-33水平与COPD的关系,后续本研究也将继续扩大样本量,进一步探究血清Ang-2、IL-33的水平与COPD的关系,并深入探究其作用机制,为二者作为临床预后生物指标提供更充分的依据。
