血浆脂肪酸乙酯与酒精性急性胰腺炎炎症和疾病严重程度的相关性研究*
2024-05-13臧桂芹孙艳艳
臧桂芹,叶 丹,孙艳艳
北京航天总医院急诊科,北京 100076
乙醇摄入过量是引起急性胰腺炎(AP)的常见原因[1],然而临床上对酒精性急性胰腺炎(AAP)的诊断还具有挑战性,因为它依赖于可靠的病史,尚缺乏客观的依据来支持或反驳诊断[2]。而且乙醇在血液中的水平通常在摄入后1~2 h内达到峰值,随后数小时内消除,因此当患者出现AAP时,通常已无法依靠乙醇检测做出判断[3]。乙醇本身并不会引起AP,而对于大量饮酒甚至乙醇中毒者,胰腺会通过氧化或非氧化代谢途径降解乙醇。非氧化乙醇代谢是依靠脂肪酸乙酯合成酶来完成的,而脂肪酸乙酯(FAEE)是非酯化脂肪酸(NEFA)和乙醇的非氧化代谢物[4]。在胰腺中,脂肪酸乙酯合成酶活性相较于肝脏更高,因此非氧化途径的乙醇代谢率也相对较高[5]。本文推测FAEE的产生可能在乙醇相关的胰腺功能障碍和AAP的发展中起着重要作用。为了证实该推断,本研究试图通过回顾性队列研究调查血浆FAEE水平对AAP鉴别诊断和疾病严重程度的预测效能,希望寻找有效的AAP诊断生物标志物。
1 资料与方法
1.1一般资料 本研究回顾性筛查了2017年1月至2022年1月期间本院重症医学科收治的227例AAP患者,以及年龄、性别相匹配的213例非酒精性AP患者(包括91例高三酰甘油血症患者,78例胆源性患者,21例饮食不节性患者和23例非酒精性复合因素患者)。根据《中国急性胰腺炎诊治指南(2021)》[6],AP被定义为特征性腹痛,血浆脂肪酶或淀粉酶水平至少增加3倍。在本研究中,纳入的患者都具有急性腹痛和呕吐临床症状并伴有腹膜炎症状,如腹胀、腰椎肋骨压痛和肿胀,提示腹腔渗出、炎症和腹腔内高压。于入院后24 h内采集所有患者的血样,并测定血浆淀粉酶(参考值25~125 U/L)和脂肪酶(参考值23~300 U/L)活性。采用腹部CT扫描作为标准成像方法,对诊断不明确的患者进行增强CT扫描。排除标准:(1)慢性胰腺炎、内镜下逆行胰胆管造影术后胰腺炎、壶腹周围癌症、导管内乳头状黏液性肿瘤和自身免疫性胰腺炎;(2)急慢性肝脏疾病;(3)症状出现后>24 h入院。AAP组患者共227例,在发病前24 h内有大量饮酒史或乙醇摄入量>80 g/d[7],其中男175例,女52例,年龄19~80岁,平均(47.23±12.71)岁。非酒精性AP组患者共213例,女性饮酒量<20 g/d,男性饮酒量<20 g/d,且所有患者均有确切病因,其中男159例,女54例,年龄19~80岁,平均(48.53±19.56)岁。本研究获得了本院医学伦理委员会的批准(2021伦审科字第G028号 ),该委员会因回顾性研究性质放弃了知情同意的要求。
1.2疾病严重程度 所有患者均采用第二代双源CT扫描仪(Siemens Healthcare,德国)进行CT扫描。上腹部CT参数为120 kVp,200 mAs,探测器准直为64 mm×0.6 mm,螺距1.2,球管旋转时间0.5秒/周,层厚为5.0 mm,采用标准重建算法。首先进行腹部CT扫描,然后以3~5 mL/s的流速注射造影剂,以确定胰腺坏死。根据Bathazar CT分级[8-9]评估患者的疾病严重程度:0~3分为轻度,>3~6分为中度、>6~10分为重度。
1.3血浆检测 所有患者进入急诊室后第一时间采集血样,离心收集血浆后,保存在-70 ℃样本库中。化学试剂(分析纯,≥98%)均购自美国Sigma-Aldrich试剂公司。将375 μL患者血浆(按1∶20稀释)加入含有55 μmol/L十七烷酸乙酯的3 mL冷丙酮中作为内标。混悬10 s并离心10 min后,加入3 mL己烷提取脂质,重复提取2次。合并后在真空下干燥。将样品在含有10 ppm咖啡因的75 μL己烷中重组,并通过Agilent 7693自动液体采样器将1 μL样品注入260 ℃进样口中。采用Agilent 7890B仪器和HP-5 ms(5%苯基)-甲基聚硅氧烷超惰性色谱柱进行气相色谱(GC),氦载气流速保持在1 mL/min。将样品注入色谱柱上,温度以30 ℃/min升高至150 ℃并保持2 min,然后以4 ℃/min缓慢升至250 ℃,最后以20 ℃/min升至300 ℃并保持2 min。使用Agilent 5977A质谱仪对样品进行定量。通过保留时间和选择离子监测鉴定FAEE成分。FAEE检测下限为10 nmol/L。在本院实验室通过GC检测血浆游离脂肪酸(NEFA)。另外,采用酶标(ELISA)仪检测血浆中白细胞介素(IL)-1β、IL-6水平,检测试剂盒及标准品购自Beijing Human Diagnostics公司(中国)。
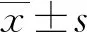
2 结 果
2.1AAP组和非酒精性AP组基本资料比较 AAP组和非酒精性AP组性别、年龄、体重指数(BMI)、吸烟状况、糖尿病或高血压史、疾病严重程度及常规的实验室检查比较,差异无统计学意义(P>0.05)。然而,与非酒精性AP组相比,AAP组患者血浆FAEE(P<0.001)和NEFA(P=0.019)水平更高。经ROC曲线分析,血浆FAEE在鉴别诊断AAP组和非酒精性AP组患者曲线下面积(AUC)分别为0.926(95%CI:0.901~0.951)和0.515(95%CI:0.459~0.571);在最佳截断值时,血浆FAEE≤93.50 nmol/L鉴别诊断的灵敏度和特异度分别为79.70%和90.60%。见表1、图1。
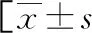
表1 AAP组和非酒精性AP组患者临床病理特征比较或n(%)或M(P25~P75)]

图1 血浆FAEE和NEFA水平鉴别诊断AAP组和 非酒精性AP组患者的ROC曲线
2.2血浆FAEE水平与AAP患者临床病理特征的相关性 根据AAP组血浆FAEE水平的中位值(146.61 nmol/L)进行亚组分层,比较2组的临床病理特征发现,高水平亚组(>146.61 nmol/L)AAP患者年龄相对较大、重症患者比例更高,而PLT则较低水平亚组(≤146.61 nmol/L)更低,差异有统计学意义(P<0.05)。见表2。
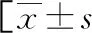
表2 血浆FAEE水平与AAP患者临床病理特征的相关性或n(%)或M(P25~P75)]
2.3AAP组血浆FAEE、NEFA水平与疾病严重程度的相关性 根据AAP患者的疾病严重程度评估,中度[158.77(127.01~230.55)nmol/L]和重度[274.49(208.32~309.31)nmol/L]患者血浆FAEE水平高于轻度患者[126.15(84.37~166.52)nmol/L],而且重度患者较中度患者更高,3组比较,差异有统计学意义(H=64.069,P<0.001)。血浆NEFA水平也随着疾病加重而升高,轻度、中度和重度患者血浆NEFA水平比较,差异有统计学意义[1 252.78(781.25~1687.48)μmol/Lvs.1 610.70(1 092.51~2 040.78)μmol/Lvs.2 581.88(1 567.49~3 803.56)μmol/L;H=41.594,P=0.108]。
2.4单因素Logistic回归分析重度AAP的危险因素 经单因素Logistic回归分析血浆FAEE水平>146.61 nmol/L是重度AAP的危险因素(P<0.05),见表3。

表3 单因素Logistic回归分析重度AAP的危险因素
2.5ROC曲线分析血浆FAEE水平对重度AAP的预测价值 血浆FAEE水平预测重度AAP时的AUC为0.786(95%CI:0.705~0.867),当血浆FAEE水平≥146.57 nmol/L时,血浆FAEE水平能以83.3%的灵敏度和62.4%的特异度预测重度AAP。见图2。

图2 血浆FAEE水平预测重度AAP的ROC曲线
2.6相关性分析 Spearman秩相关分析结果显示,AAP患者血浆FAEE与IL-1β及IL-6水平呈正相关(rS=0.298、0.475,均P<0.001),见图3A、B;此外,分析显示其与NEFA水平呈正相关(rS=0.302,P<0.001),见图3C。

注:A为血浆FAEE与IL-1β的相关性;B为血浆FAEE与IL-6的相关性;C为血浆FAEE与NEFA的相关性。
3 讨 论
在本研究中,发现血浆FAEE水平对鉴别AAP和非酒精AP有一定效能,而且在AAP组中,随着疾病严重程度的加重,患者血浆FAEE水平也逐渐升高,这提示FAEE可能与AAP疾病发生和进展相关。进一步经Logistic回归分析和ROC曲线分析,结果显示,血浆FAEE水平具有独立预测重度AAP的良好效能,AUC为0.786(95%CI:0.705~0.867),灵敏度为83.3%。这些结果均支持血浆FAEE水平升高具有AAP的病理生理作用及临床实用性。
近些年,乙醇诱发AP的发病率持续增加[10]。一般将AP 严重程度分为轻度、中度和重度,大多数病例为轻度,有病程自限性,通常不合并器官功能障碍,可在一周内恢复;中度AP消退较慢,存在短暂性器官衰竭;而大约25%的AP 患者出现严重并发症,必须住进重症监护病房。重度AP的病死率可达30%,迫切需要找到合适的生物标志物来辅助临床诊疗[2]。FAEE已被提出可作为婴儿产前暴露于乙醇的已知生物标志物[11],即使在没有乙醇中毒的情况下,也会存在于酗酒者的内脏脂肪中[4]。FAEE是在乙醇存在下通过特定的脂肪酸乙酯合成酶和其他酶从三酰甘油或游离脂肪酸等中产生的。这些非氧化乙醇代谢产物可以在血液、组织和头发中检测到[12]。乙醇的非氧化代谢物在胰腺中形成的比任何其他单位质量的组织都多,因此,FAEE被认为是一种重要的胰腺炎毒素[13]。NEFA已被确认在人胰腺炎中升高,但是其并不能区分AAP患者和非酒精性AP患者。这种急性非酯化NEFA水平升高,是由于内脏脂肪组织坏死导致的。高NEFA可抑制线粒体复合物Ⅰ和Ⅴ,导致胰腺坏死、肾小管损伤、急性呼吸窘迫综合征,甚至多系统器官衰竭。不同的是,在本研究中,AAP组患者血浆FAEE水平与NEFA水平呈正相关,说明乙醇代谢可促使胰腺通过非氧化途径代谢乙醇,使得内脏NEFA和FAEE持续释放,这可能由乙醇与脂质前体反应的有害成分介导[4]。
有报道称,FAEE可通过诱导内质网第二信使受体钙通道释放引起胰腺腺泡细胞浆钙超载,导致线粒体损伤和三磷酸腺苷生成减少,以及细胞内消化酶过早激活[13]。然而除了上述机制,FAEE还可能与AAP炎症反应相关。AP是一种复杂的炎症反应,异常激活胰蛋白酶,导致胰腺组织自我消化、水肿、出血,甚至坏死。在蛋白质触发的炎症级联反应中,Toll样受体(TLR),尤其是TLR4,通过一系列信号转导整个激活的TLR4和核因子κB(NF-κB)途径,最终促进细胞合成,分泌促炎细胞因子,如IL-1β和IL-6[14]。据报道,在注射乙醇和棕榈油酸诱导的FAEE-AP小鼠模型中,发现血浆淀粉酶和包括促炎细胞因子在内的细胞因子水平特征性升高[15]。本研究中,AAP患者血浆FAEE与IL-1β及IL-6水平呈正相关。上述结果表明,血浆FAEE水平可能具有提示AAP患者炎症反应程度的作用,进一步证明血浆FAEE水平作为AAP疾病严重程度诊断标志物的可行性。
但本研究有一定的局限性。首先,纳入患者CT的检查时间不统一,而AP的局部并发症可能取决于CT检查时间。其次,因为纳入的大多数患者都是慢性饮酒者,很难在入院时获得准确的饮酒史细节,因此本文没有评估饮酒量与血浆FAEE水平的相关性。
综上所述,本研究的结果表明,血浆FAEE可用于鉴别诊断AAP患者和非酒精性AP患者,且在AAP患者中,随着疾病严重程度加重,血浆FAEE水平也逐渐升高,可用于预测重度AAP。因此,血浆FAEE有可能成为AAP鉴别诊断和预测疾病严重程度的潜在生物标志物。
