嘧菌酯与甲基硫菌灵在荔枝采后贮藏保鲜中的应用及膳食暴露评估
2024-05-12李晓琴唐雪妹朱富伟江薰垣邓义才
肖 璐,李晓琴,唐雪妹,朱富伟,王 刚,刘 帅,江薰垣,邓义才,万 凯,*
(1.广东省农业科学院农业质量标准与监测技术研究所,广东广州 510640;2.广东省农产品质量安全风险评估重点实验室,广东广州 510640;3.华中农业大学资源与环境学院,湖北武汉 430070)
荔枝(Litchi chinensisSonn.)是我国岭南地区的特产水果,素有“岭南佳果”的美誉,因其具有较高的营养价值和保健功效,深受广大消费者的喜爱[1]。荔枝成熟于高温高湿季节,极易发生病虫害,采后呼吸代谢旺盛,极易发生褐变腐烂,极大地影响了荔枝的食用品质和商业价值[2-4]。荔枝在常温无包装下贮藏期仅为1~2 d,短暂的贮藏期和货架期成为荔枝远销和出口的瓶颈。我国荔枝年产量占世界总产量的70%,但每年因荔枝的褐变腐烂问题所造成的损失达年产量的20%以上,极大地影响我国荔枝产业可持续健康发展[5-7]。
化学药剂处理是一种重要的荔枝采后保鲜方法,可以起很好的杀菌、防腐等作用。而杀菌剂作为化学药剂的一种,在农药中使用较为频繁,具有针对性强、使用简单方便等优点,不仅可用于预防果实采收前的真菌感染,还能有效预防果实采后处理、贮运以及销售期间的病菌感染,有效地延长了贮藏期以及货架期。前期对荔枝生产过程中农药的使用情况进行调研,发现部分收购商更倾向于收购采前打过药的荔枝,原因是这种荔枝更利于保存。其中,嘧菌酯和甲基硫菌灵是在农残监测中发现使用较多的两种杀菌剂。已有研究报道,常温下分别使用25%嘧菌酯1500 倍稀释液与70%甲基硫菌灵600 倍稀释液浸泡砂糖桔,可以使果实腐烂率降至7%左右,贮藏45 d 后残留量低于国家标准[8]。段志坤等[9]发现,将1%的甲基硫菌灵与50 mg/L 的防落素进行复配后处理柑橘果实,其保鲜效果明显提升。嘧菌酯和甲基硫菌灵在猕猴桃采后保鲜中也发挥较好的防腐效果,与其它杀菌剂和保鲜剂相比,采用70%甲基硫菌灵600 倍稀释液处理猕猴桃的保鲜效果最好,贮藏31 d 后的腐烂率最低[10]。刘清化等[11]发现,采用低浓度的甲基硫菌灵(0.1%)处理柠檬时,可以通过降低果实的失重率从而提高柠檬的保鲜效果,而采用较高浓度的甲基硫菌灵(0.5%)处理柠檬时,果实的失重率和坏果率则显著增加,保鲜效果较差。章豪等[12]发现在冷藏条件下用甲基硫菌灵处理桃果实可以有效抑制桃表面霉菌的繁殖,且较好地保持了可溶性固形物含量,维持果实的贮藏品质。
荔枝在生产过程中极易发生微生物滋生而引发腐烂,采前和采后进行病菌抑制是提高保鲜效果的重要方式。当前,荔枝采后常用的杀菌剂有麦角甾醇生物合成抑制剂、苯并咪唑、噻菌灵和甲氧基丙烯酸酯等,通过透过果皮的角质层,扑灭初期侵染的酸腐病菌[13-15],有效延长了荔枝采后货架期。广东荔枝主要存在霜疫霉病和炭疽病两种病害,而杀菌剂嘧菌酯和甲基硫菌灵对这两种病害均有一定的防治作用,其主要的原理是杀菌剂通过作用于病原菌菌丝的细胞壁来有效杀死病原菌[16-18]。目前关于嘧菌酯和甲基硫菌灵的相关研究主要集中在采前病害的预防与控制[19-23],在果蔬采后保鲜中的应用相对较少(柑橘、柠檬、桃等),并且在荔枝采后贮藏保鲜中的应用目前尚未有相关报道。本研究探究了常温条件下不同浓度的嘧菌酯和甲基硫菌灵对荔枝的保鲜效果,并针对贮藏期间荔枝果实中杀菌剂的残留量进行监测和膳食暴露评估,最终筛选并优化出兼顾保鲜效果、食用安全性以及经济成本为一体的保鲜剂配方,该研究为荔枝以及其他非呼吸跃变型水果保鲜技术的研发提供了技术参考。
1 材料与方法
1.1 材料与仪器
晚熟荔枝 品种为‘淮枝’,分别于2022 年7 月18 日、7 月28 日在广州市从化丰和园果蔬专业合作社采摘,采摘后立即运回实验室。挑选成熟度基本一致、无病虫害、无腐烂、无机械损伤且果型大小基本一致的荔枝进行试验;乙腈、甲醇 色谱纯,德国Merck 公司;氯化钠、无水硫酸镁 分析纯,广州化学试剂厂;甲酸、甲酸铵 优级纯,上海阿拉丁生化科技股份有限公司;二水合草酸 分析纯,国药集团化学试剂有限公司;氢氧化钠标准溶液 分析纯,深圳市博林达科技有限公司;2,6-二氯靛酚、碳酸氢钠 分析纯,上海麦克林生化科技股份有限公司;25%嘧菌酯(可湿性粉剂)龙发化工有限公司;70%甲基硫菌灵(悬浮剂)先正达南通作物保护有限公司;PSA 吸附剂(40~60 μm)天津博纳艾杰尔科技有限公司。
LCMS-8060 液相色谱质谱联用仪 日本岛津公司;SiO-6512 本立QuEChERs 自动样品处理系统北京英贝迪科技有限公司;Milli-Q 超纯水仪Merk Millipore 公司;FA11002C 电子天平 梅特勒-托利多仪器有限公司;KQ-250DE 数控超声波清洗器昆山市超声仪器有限公司;RX-5000i 数显台式折光仪 广州市爱拓科学仪器有限公司;3051H 果蔬呼吸测定仪 杭州绿博仪器有限公司;DDS-307A 电导率仪 上海仪电科学仪器股份有限公司;JXFSTPRP-24 全自动样品快速研磨仪 上海净信有限公司;5804R 冷冻离心机 德国Eppendorf 公司;UV-2600 紫外分光光度计 Techcomp 公司。
1.2 实验方法
1.2.1 分组及处理条件 保鲜剂浓度及配方组合:对照组(去离子水)、25%嘧菌酯1200 倍稀释液、25%嘧菌酯1600 倍稀释液、70%甲基硫菌灵500倍稀释液、70%甲基硫菌灵700 倍稀释液、25%嘧菌酯1200 倍稀释液+70%甲基硫菌灵500 倍稀释液、25%嘧菌酯1200 倍稀释液+70%甲基硫菌灵700 倍稀释液、25%嘧菌酯1600 倍稀释液+70%甲基硫菌灵500 倍稀释液、25%嘧菌酯1600 倍稀释液+70%甲基硫菌灵700 倍稀释液。
采用上述杀菌剂配方将荔枝分别浸泡3 min(参照常用杀菌剂的浸泡时间),以清水浸泡作为对照,沥干后用PE 保鲜袋挽口包装(袋内RH80%~90%),于常温(25 ℃)贮藏,每袋装65 个果,每组三个重复,在贮藏第0、2、4、6、8 d 的固定时间点对荔枝感官品质和腐烂情况进行评价,筛选出较好的保鲜剂配方,并对保鲜效果进行再次验证。
1.2.2 腐烂率的测定 腐烂率的测定参照林河通等[24]的方法,略有改动。以果皮表面出现真菌生长、发生腐烂或者褐变面积超过整个果实的1/4 为烂果标准计算腐烂率。
1.2.3 呼吸强度的测定 呼吸强度的测定参考王秋芳等[25]的方法进行测定。将30 个荔枝果实称重后放于体积为2.5 L 带有通气导管的密闭塑料盒中,然后将通气口与呼吸仪接口连接,打开通气管,记录5 min 内每隔1 min 的呼吸强度值,取5 次呼吸强度值的平均值作为呼吸强度。
1.2.4 可滴定酸含量的测定 可滴定酸(TA)含量的测定参考GB 12456-2021[26],称取15~20 g 荔枝果肉匀浆至250 mL 烧杯中,加入沸水150 mL,水浴(100 ℃)30 min 后冷却,定容至250 mL,过滤至锥形瓶。取50 mL 滤液,加入2~3 滴酚酞指示剂,用0.1 mol/L 的NaOH 标准溶液滴定,出现微红色且30 s 内不褪色,立即停止滴定并读数。
式中:C 为氢氧化钠标准滴定溶液的浓度(mol/L);V1为滴定试液时消耗氢氧化钠标准滴定溶液的体积(mL);V2为空白试验时消耗氢氧化钠标准滴定溶液的体积(mL);K 为酸的换算系数;F 为试液的稀释倍数;m 为试样的质量或体积(g 或mL);1000 为换算系数。
1.2.5 可溶性固形物含量的测定 可溶性固形物的测定参照武惠桃[27]的方法。每袋随机取10 个荔枝果实,取果肉榨汁后用4 层纱布过滤,用折光仪测定滤液可溶性固形物的含量,重复三次,用百分率表示。
1.2.6 VC含量的测定 VC含量的测定参照Zhang等[28]的方法,略有改动。称取荔枝果肉样品100 g加入2%草酸100 mL 进行研磨,称取40 g 样品加入2%的草酸溶液进行溶解,然后转移至200 mL 容量瓶中进行定容,过滤备用。吸取滤液10 mL 于三角瓶中,用已标定过的2,6-二氯靛酚钠盐溶液滴定至桃红色且15 s 不褪色为止,记下标准液用量。吸取2%草酸溶液10 mL,用染料作空白滴定记下用量。
式中:V 为滴定样品所用的染料数(mL);V1为空白滴定所用的染料(mL);A 为1 mL 染料溶液相当于抗坏血酸的毫克数;B 为滴定时吸取样品溶液的毫升数(mL);b 为样品液稀释后的总毫升数(mL);a 为样品的重量(g)。
1.2.7 甲基硫菌灵和嘧菌酯残留量的测定 甲基硫菌灵和嘧菌酯残留量的测定参考唐雪妹等[29]和黄健祥等[30]的方法,略作修改。对于全果检测,称取10 g研磨后的荔枝果皮和果肉匀浆于50 mL 离心管中,加入5 颗陶瓷均质子,然后依次加入20 mL 乙腈、1 g 氯化钠、4 g 无水硫酸镁,摇匀,使用振荡离心一体化装置先在1000 r/min 下振荡5 min,于常温3800 r/min 离心5 min。吸取振荡离心后的上清液8 mL 于15 mL 离心管中,加入1 g 净化剂,在800 r/min下振荡2 min 后在3800 r/min 下离心2 min。吸取1 mL 上清液过0.22 μm 尼龙滤膜。上机检测残留量,果肉检测则单独称取果肉部分。
1.2.8 膳食暴露与风险评估 按以下两公式进行农药的慢性膳食摄入风险评估。
式中:C 为荔枝中该高风险因子的所有样品平均检出值(小于0.001 mg/kg 的忽略不计),F 为每日水果摄入量,评估所用的体重参数bw 采用成年人(Food and agriculture organization of the united nations 2009),ADI 值来源于中国政府发布的GB 2763-2021(MOA 2021)[31]。若RQ>1,暴露人群有明显的健康风险;RQ≤1,无显著健康风险,RQ 越大表明相应的风险越大。
1.3 数据处理
使用SPSS 26.0 进行数据处理与分析,采用单因素分析法进行显著性分析,P<0.05 表示差异显著,采用SigmaPlot 10.0 对数据进行作图,每个测试指标重复3 次,测定值以3 个重复实验数据的平均值±标准差(Mean±SD)表示。
2 结果与分析
2.1 杀菌剂保鲜效果分析与保鲜配方筛选
常温贮藏过程中,对照组和杀菌剂处理组的荔枝果实表观变化情况如图1 所示。从图中可以看出,对照组的荔枝果实从贮藏第2 d 开始出现褐变和霉变,而杀菌剂处理组大多在贮藏第6 d 开始出现褐变,在贮藏第8 d 发生霉变。且经对比后发现,M1600 处理组在贮藏第8 d 仅出现少量褐变而无霉变发生,M1600+J700 处理组在贮藏第8 d 少量出现霉变,其余处理组均出现较为严重的褐变和霉变。因此,M1600 处理组的保鲜效果好于M1600+J700 处理组,优于其它杀菌剂处理组,优于对照组。

图1 25 ℃下不同浓度杀菌剂对荔枝果实的保鲜效果Fig.1 Preservation effects of different concentrations of fungicides on litchi fruit at 25 ℃
2.2 优选配方杀菌剂对荔枝贮藏品质的影响
基于以上杀菌剂配方保鲜效果的分析,筛选出保鲜效果较好的M1600 以及M1600+J700 处理组进行实验验证。从图2 可以看出,常温贮藏第2 d,对照组荔枝果皮有轻微褐变发生,而贮藏至第4 d,荔枝果皮开始发生明显的褐变和霉变,而两处理组荔枝果皮仅出现少量褐斑。贮藏至第6 d,对照组腐烂严重,出现大量霉斑,M1600 处理组个别出现霉变,而M1600+J700 处理组尚未出现霉变,但褐变情况较单独使用M1600 处理组褐变情况严重。贮藏第8 d,对照组基本全部褐变腐烂,复配杀菌剂处理组发生大面积褐变和部分霉变,但单独使用M1600 处理组褐变情况明显轻于复配杀菌剂组。由此可以看出,复配杀菌剂在杀菌效果上比较有优势,但在抑制果皮褐变方面效果并不显著。

图2 25 ℃下两组杀菌剂对荔枝的保鲜效果Fig.2 Preservation effects of two groups of fungicides on litchi at 25 ℃
2.3 优选配方杀菌剂对荔枝呼吸强度、腐烂率以及电导率的影响
常温贮藏条件下,对照组、M1600 和M1600+J700 处理组的荔枝果实的呼吸强度、腐烂率以及电导率均随着贮藏时间的延长而增加(图3)。荔枝是非呼吸跃变型果实,采后呼吸代谢旺盛。从图3A 中可以看出,对照组荔枝的呼吸强度随贮藏时间的延长迅速升高,而两处理组的荔枝果实呼吸强度自贮藏第2 d 起基本维持在80 mg/kg/h,呼吸强度远低于对照组(130 mg/kg/h),表明该处理可显著抑制果实的呼吸强度(P<0.05),延缓果实采后的衰老劣变。从图3B 中可以看出,从贮藏第2 d 开始,对照组的腐烂率均明显高于两处理组,贮藏第8 d,处理组的腐烂率比对照组降低了约50%。相对电导率,也被称为膜透性,是衡量荔枝果皮细胞膜衰老程度的重要指标之一。从图3C 中可以看出在整个贮藏过程中对照组荔枝果皮的相对电导率为直线上升的变化趋势,而处理组从贮藏第2 d 到第4 d 基本保持相对稳定,从贮藏第6 d 起迅速升高,但整体低于对照组。综上,在常温贮藏条件下,杀菌剂处理在一定程度上抑制了荔枝果实的呼吸强度,降低了果实的腐烂率以及果皮相对电导率,保鲜效果明显优于对照组,但贮藏期间两处理组的保鲜效果差异并不显著(P>0.05)。

图3 25℃下不同浓度杀菌剂对荔枝呼吸强度、腐烂率以及果皮相对电导率的影响Fig.3 Effects of different concentrations of fungicides on the respiratory intensity,rotten rate,and relative conductivity of litchi peel at 25 ℃
2.4 优选配方杀菌剂对荔枝果肉TSS、TA 以及VC 含量的影响
可溶性固形物(TSS)和可滴定酸(TA)是影响荔枝风味的重要因素[32],而VC是衡量果实营养品质的重要指标。由图4 可以看出,TSS 和VC含量在贮藏期间均呈逐渐下降的变化趋势。自贮藏第6 d,对照组荔枝果肉中可溶性固形物含量和VC含量下降迅速,显著低于两个杀菌剂处理组(P<0.05)(图4A 和图4C)。各组的荔枝果肉中可滴定酸含量呈先下降后上升的变化趋势,且对照组的可滴定酸含量从贮藏第6 d 开始迅速升高,显著高于处理组(P<0.05)(图4B),这可能与贮藏后期荔枝果实发生腐烂有关,腐烂的果实中存在大量的微生物,微生物滋生产生腐酸,从而导致对照组的荔枝果肉中可滴定酸含量在贮藏后期有所升高。综上,杀菌剂处理在一定程度上维持了荔枝果肉可溶性固形物和VC含量,提高了荔枝果实的营养品质和食用价值。

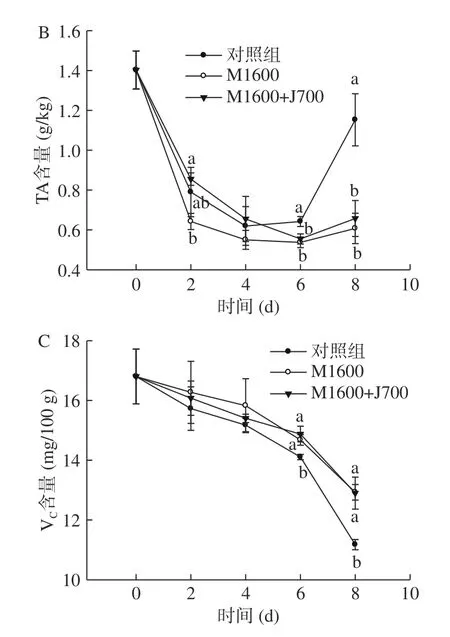
图4 25 ℃下不同浓度杀菌剂对荔枝果肉可溶性固形物(A)、可滴定酸(B)以及VC(C)含量的影响Fig.4 Effects of different concentrations of fungicides on TSS(A),TA (B) and VC (C) content of litchi pulp at 25 ℃
2.5 贮藏期间杀菌剂残留量的变化及其膳食暴露评估
GB 2763-2021 中规定嘧菌酯在荔枝上的最大残留量为0.5 mg/kg[31],甲基硫菌灵的残留量为甲基硫菌灵和多菌灵两种物质,以多菌灵计,其在荔枝上的最大残留量为0.5 mg/kg。从贮藏第2 d 对两个杀菌剂处理组荔枝果实的全果和果肉中嘧菌酯和甲基硫菌灵的残留量进行检测,如表1 和表2 所示。从表中可以看出,两个杀菌剂处理组的嘧菌酯和甲基硫菌灵在全果和果肉中的含量随贮藏时间的延长逐渐降低。其中,单独使用M1600 处理的荔枝果肉中嘧菌酯的残留量在整个贮藏期间一直保持较低水平,贮藏第2 d 残留量为0.069±0.004 mg/kg,M1600+J700处理组的荔枝果肉中嘧菌酯的残留量为0.081±0.001 mg/kg,甲基硫菌灵在贮藏第2 d 的残留量为0.295±0.002 mg/kg,均低于残留量的限量值标准。
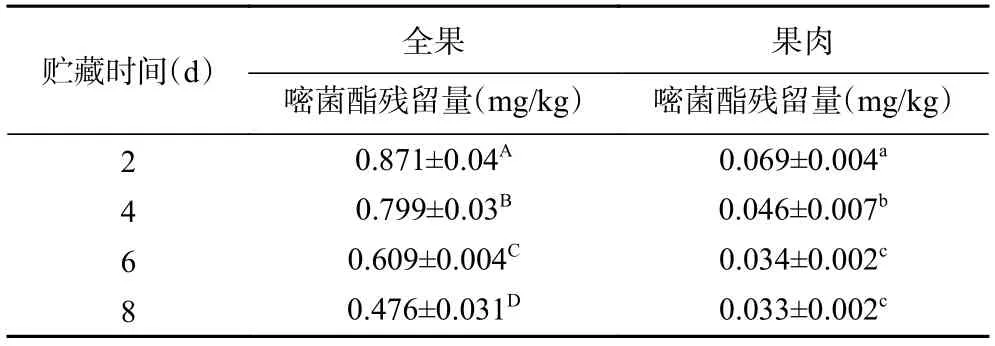
表1 M1600 处理组荔枝中嘧菌酯残留量变化Table 1 Changes of residual amount of azoxystrobin in litchi after treatment with M1600
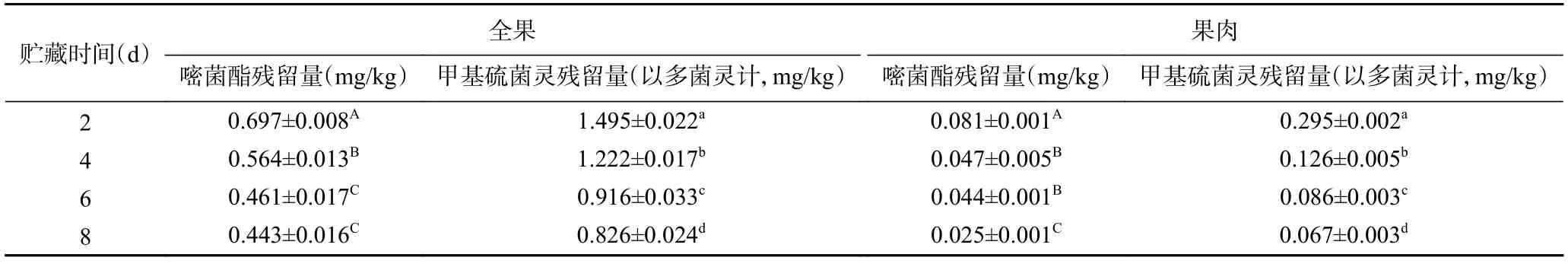
表2 M1600+J700 处理组荔枝中农药残留量变化Table 2 Changes of residual amount of pesticide residues in litchi after treatment with M1600+J700
表3 和表4 分别对两个处理组的嘧菌酯和甲基硫菌灵在荔枝全果中的膳食暴露进行评估。结果发现,整个贮藏期间各杀菌剂对于普通人群的风险熵值分别为:M1600 处理组中嘧菌酯RQ 值在0.00173~0.00316,远小于1,M1600+J700 处理组中嘧菌酯RQ 值 在0.00161~0.00253,甲基硫菌灵RQ 值在0.00599~0.01084,同样均远小于1,表明二者在荔枝中的残留量膳食风险较低。加之本研究只取荔枝果肉部分食用,因此,按照推荐剂量食用上述保鲜后的荔枝对人体是安全的。综合保鲜效果、降低经济成本以及食用安全性而言,单独使用M1600 处理荔枝果实可集保鲜品质提升、食用安全性以及降低经济成本为最佳。
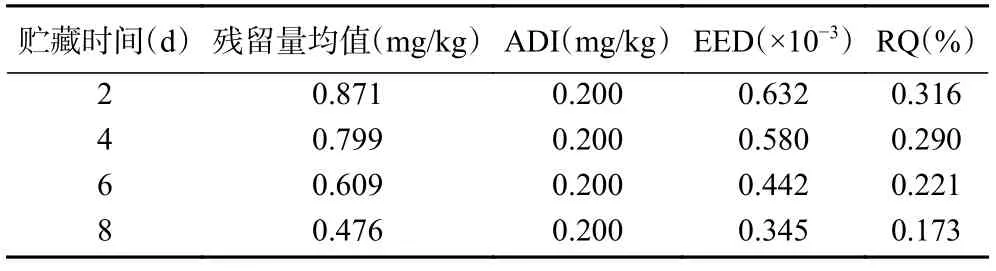
表3 M1600 处理组中嘧菌酯在荔枝全果中的膳食暴露评估Table 3 Dietary exposure assessment of azoxystrobin for litchi in the M1600 treatment group
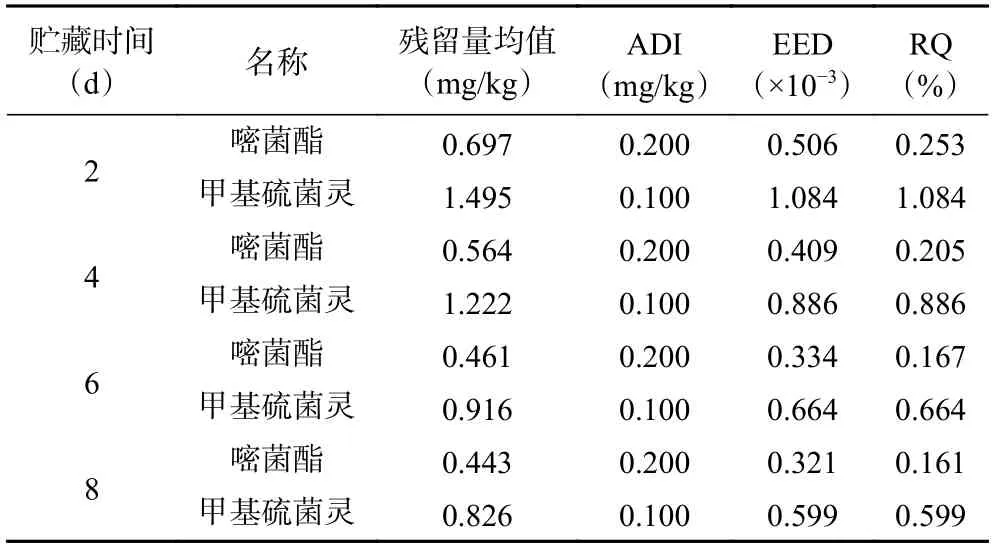
表4 M1600+J700 处理组中嘧菌酯和甲基硫菌灵在荔枝全果中的膳食暴露评估Table 4 Dietary exposure assessment of azoxystrobin and thiophanate-methyl for litchi in the M1600+J700 treatment group
3 讨论与结论
荔枝采后褐变及腐烂的原因除了果皮失水、酶促褐变以及自身呼吸代谢外,还有生长过程中所携带的病原菌侵染,而抑制病原菌的生长在很大程度上可延缓荔枝果实褐变和腐烂,从而延长货架期。荔枝的主要病害包括霜疫霉病、炭疽病、白粉病和煤烟病等,其中,以霜疫霉病和炭疽病最为常见,也是造成荔枝损失最为重要的病害[33-34]。杀菌剂对荔枝病害可以有效地抑制,具有见效快和成本低等优点。
当前,果农所用到的杀菌剂主要有代森锰锌、苯醚甲环唑、嘧菌酯、异菌脲以及甲基硫菌灵等。其中,嘧菌酯是专门抑制真菌线粒体呼吸的一种抑制剂,通过抑制病菌的呼吸来抑制病菌的侵染[17]。甲基硫菌灵对炭疽病有一定的防治作用,主要是作用于病原菌的菌丝,使细胞壁中毒,从而杀死病原菌[18]。有研究表明嘧菌酯和甲基硫菌灵在猕猴桃保鲜中可以减少果实腐烂,减弱呼吸强度,从而延长猕猴桃的货架期[10],且在沙糖桔和桃的贮藏中可减少可滴定酸、可溶性固形物和VC含量的下降[8,12]。在本研究中,常温贮藏条件下,两种杀菌剂不仅可以有效抑制荔枝果实的呼吸强度、腐烂率以及相对电导率的升高(P<0.05),还能在一定程度上起到维持荔枝果肉中TSS 和Vc 等营养物质含量(P<0.05)。在贮藏后期,与处理组相比,对照组荔枝果肉的可滴定酸含量明显升高,这主要与对照组果实在贮藏后期出现大范围腐烂有关,由于腐烂的果实中繁殖出大量的微生物滋生产生腐酸而导致果肉可滴定酸含量的升高[27]。可见,杀菌剂处理显著提高了荔枝的贮藏品质和食用品质,这表明嘧菌酯和甲基硫菌灵在果实采后贮藏保鲜中可能具有一定的普适性。最后,进一步对两个杀菌剂处理组的保鲜效果进行对比,发现两个处理组对荔枝的保鲜效果差异性不明显,复配杀菌剂在杀菌效果上比较有优势,但在抑制果皮褐变方面效果并不突出。因此,推测嘧菌酯在荔枝保鲜中可能发挥了更为重要的作用。
杀菌剂用于果蔬采后保鲜效果虽然显著,但其残留量也与食用安全性息息相关。本研究对贮藏期间处理组荔枝全果和果肉中的杀菌剂的残留量进行定时监测,并对荔枝全果进行膳食暴露评估,结果发现虽然两种杀菌剂在荔枝中的膳食风险较低。全果检测中,嘧菌酯在贮藏第6 d 降至残留量标准,而甲基硫菌灵在贮藏第8 d 依旧高于限量值标准,但二者在果肉中的残留量远低于限量值标准,且考虑消费者仅食用荔枝的果肉部分,因此,均在安全范围内。综上,结合荔枝的贮藏品质、食用安全性以及经济成本,采用25%嘧菌酯1600 倍稀释液保鲜荔枝果实较优。
研究前期对荔枝生产过程中农药的使用进行了大量的调研和筛查,本实验在荔枝采摘末期进行,此时荔枝果实已经进入后熟阶段,果实成熟与贮藏品质的保持息息相关,因此,推测在荔枝采摘成熟度合适(7~8 成)的情况下,其贮藏品质会有进一步提升。根据贮藏期间两种杀菌剂的代谢规律可以发现,随贮藏时间的延长,其残留量也会进一步降低。当前,通过低温贮藏延长荔枝采后货架期的研究已经较为成熟,而常温贮藏条件下提升荔枝的贮藏品质一直是生产上的难题。本研究发现,25%嘧菌酯的1600 倍稀释液可以延长采后荔枝果实在常温下贮藏的货架期,提高了荔枝贮藏品质和食用价值,该研究可以为常温下荔枝以及其它非呼吸跃变型果蔬采后贮藏品质提升提供一定的理论依据和技术支持,为其经济价值的提升提供一定的帮助。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).
