小麦B 淀粉一步酶解产糖优化及酒精发酵
2024-05-12张晶晶陈家新冯军伟胡景婷马欣荣解心月
张晶晶,陈家新,冯军伟,胡景婷,马欣荣,张 楠,解心月,刘 娜,王 心,4,5,6,惠 明,5,6,*
(1.河南工业大学生物工程学院,河南郑州 450000;2.河南工业大学小麦和玉米深加工国家工程研究中心,河南郑州 450001;3.河南飞天农业开发股份有限公司,河南鹤壁 456750;4.许昌学院食品与药学院,河南许昌 461000;5.工业微生物菌种保藏与选育河南省工程实验室,河南郑州 450001;6.小麦生物加工与营养功能河南省重点实验室,河南郑州 450001)
小麦淀粉是对小麦面粉进一步深度加工的产物,工业化生产的小麦淀粉一般分有A、B 两种类型,A 淀粉粒径为10~35 μm,颗粒较大呈透镜型,B 淀粉粒径为2~5 μm,颗粒较小呈圆形[1-2]。A 淀粉是精制淀粉,基本不含杂质或含量极少,广泛应用于食品、化工、医药等方面。B 淀粉作为生产A 淀粉的副产物,其含量占原料小麦面粉总量的10%~20%[3]。小麦B 淀粉除含有大量淀粉外,还有蛋白质、戊聚糖[4-6]等杂质,由于特殊的理化性质无法像A 淀粉那样用于商品淀粉制作。国内外研究者均对提高小麦B 淀粉利用价值进行了一些探索,研究表明,利用小麦B 淀粉生产高麦芽糖浆[7-8],B 淀粉中由于含有戊聚糖和粗脂肪等成分,使得高麦芽糖浆过滤脱色困难[2],从而影响了产品质量;莲花味精集团将小麦B 淀粉与A 淀粉混合制糖,用作发酵生产味精的原料,B 淀粉因存在一定量的非淀粉多糖,使得制糖过程中糖液黏度过高,从而影响发酵工艺[9]。也有将小麦B 淀粉浆用作饲料添加组分,但B 淀粉浆容易滋生大量微生物,其中霉菌会导致动物中毒,降低饲料营养价值[10];此外,B 淀粉含有木聚糖等糖类,动物难以利用,影响其对食物吸收率,继而阻碍动物健康生长[9]。因此,优化B 淀粉的利用方式,解决其中的问题,对于提升小麦B 淀粉的利用价值具有重要意义。
酒精(乙醇)常用于医药、化工等领域,目前发酵酒精所用的原料主要糖蜜、淀粉、玉米和木质纤维素等。我国酒精发酵生产主要原料为玉米,玉米作为饲料最主要的原料,同时在保证肉类、奶制品等食品供应方面发挥重要作用,因此用玉米原料生产酒精存在“与人争粮”问题,原料多元化发展势在必行[11-12]。小麦B 淀粉价格低廉,以B 淀粉为原料发酵生产酒精,可以降低粮耗、节约资源,减少环境污染,提高经济效益。张军合等[13]与杜丽娜[14]采用传统发酵工艺生产酒精,即先利用α-淀粉酶将小麦B 淀粉进行高温蒸煮液化,然后利用糖化酶进一步水解成可发酵的糖,该法淀粉转化效率低耗时长,所需设备多[15]。研究表明,α-淀粉酶和糖化酶协同作用于淀粉可以提高水解效率,缩短酶解反应时间[16-18]。双酶法水解糖液纯度高,酶解反应条件温和、可控性好,因此利用双酶法酶解小麦B 淀粉制备可发酵糖可以有效的解决产量低、品质差的问题。
本研究以小麦B 淀粉为原料,在对其基本成分进行分析基础上,使用α-淀粉酶和糖化酶组成复合酶对B 淀粉进行一步酶解,为进一步提高酶解效率,详细考察复合酶用量、料液比、酶解温度、酶解时间及pH 对还原糖得率影响,并在此基础上利用正交优化确定最佳工艺参数。然后利用酿酒酵母菌株发酵上述酶解液生产酒精,为拓宽酒精生产原料,提高小麦B 淀粉利用价值提供参考。
1 材料与方法
1.1 材料与仪器
小麦B 淀粉浆 河南飞天农业有限公司;酿酒酵母菌株 实验室保存;氢氧化钠、浓盐酸、无水乙醇 天津市致远化学试剂有限公司;DNS 显色液 福州飞净生物科技有限公司;地衣酚 上海麦克林生化科技有限公司;α-淀粉酶(3700 U/g)、糖化酶(100000 U/g)北京奥博星生物技术有限责任公司;D-木糖、D-无水葡萄糖 国药集团化学试剂有限公司;酵母粉、胰蛋白胨 英国Oxoid 公司;YPD 培养基:10 g/L 酵母提取物、20 g/L 胰蛋白胨、20 g/L 葡萄糖,固体培养基加20 g/L 琼脂粉。
BSA124S 分析天平 北京赛多利斯仪器系统有限公司;DHG-9140A 电热恒温鼓风干燥箱、DHG-9140A 电热恒温培养箱 上海一恒科技有限公司;FE28 pH 计 梅特勒-托利多仪器(上海)有限公司;T2600 紫外分光光度计 上海佑科仪器仪表有限公司;MS-H-S 磁力搅拌器 大龙兴创实验仪器(北京)有限公司;ZWF-110X30 恒温水浴振荡器 上海智城分析仪器制造有限公司;JP-800C-6 多功能高速粉碎机 永康市久品工贸有限公司;LC-2030 液相色谱仪 日本岛津公司;BTP-3ES00X 台式冻干机 美国Virtis 公司;Qunata 250FEG 扫描电子显微镜 浙江纳德科学技术有限公司。
1.2 实验方法
1.2.2 小麦B 淀粉基本成分分析 还原糖含量和淀粉含量测定参照3,5-二硝基水杨酸(DNS)比色法[20],用DNS 法测得葡萄糖标准曲线方程y=1.6786x-0.0754,R2=0.9997;蛋白质含量采用GB 5009.5-2016凯氏定氮法[21];灰分含量采用GB 5009.4-2016 中灰分含量的测定方法[22];戊聚糖含量测定采用NY/T 2335-2013 谷物中戊聚糖含量测定方法中的分光光度法[23](即地衣酚-盐酸法)进行戊聚糖含量的测定。
式中,m′为带入葡萄糖标准曲线得的含量,mg;V 为样品提取液总体积,mL;N 为稀释倍数;Vs 为测定时所取样品提取液体积,mL;m 为称取小麦B 淀粉的质量,g。
式中,G 为水解样中葡萄糖含量,mg;0.9 为淀粉与葡萄糖的转换系数;n 代表稀释倍数;m 为称取小麦B 淀粉的质量,g。
1.2.3 小麦B 淀粉酶解工艺流程 首先称取一定量的α-淀粉酶和糖化酶溶解在水中,配制成α-淀粉酶含量为24 U/mL,糖化酶含量为150 U/mL 的复合酶溶液[24-25]备用。称取2.0000 g 小麦B 淀粉末,并加入50 mL 蒸馏水配制成淀粉浆。用0.5 mol/L 稀盐酸和氢氧化钠溶液调节pH 至5.0 左右,在沸水浴中加热15 min,使淀粉充分糊化。冷却到60 ℃左右,加入配制好的复合酶溶液,使其在恒温水浴振荡器中进行酶解反应。反应结束取1 mL 酶解液,沸水浴灭酶5 min,12000 r/min 离心2 min 后取上清液,测定葡萄糖当量(DE 值),计算公式如下:
式中:干物质含量为B 淀粉添加量。
1.2.4 单因素及优化工艺试验设计
1.2.4.1 单因素实验 以DE 值为评价指标,在某一因素的研究中,其他因素设置为相应的固定值,即复合酶添加量为2 mL,料液比为1:20 g/mL,酶解温度为60 ℃,酶解时间为6 h,初始pH 为5,研究复合酶添加量(1、2、3、4、5 mL)、料液比(1:5、1:15、1:20、1:25、1:30 g/mL)、酶解温度(50、55、60、65、70 ℃)、酶解时间(2、4、6、10、14、18、22、24 h)及pH(3、4、5、6、7)五个因素对DE 值的影响。
Countermeasures of constructing trade and logistics center of Xuzhou
1.2.4.2 正交试验优化 在单因素实验的基础上,选取α-淀粉酶和糖化酶复合酶溶液添加量、料液比、酶解温度、酶解时间及pH 进行正交试验,每个因素安排3 个平行水平,以DE 值为评价指标,设计正交试验表(表1),研究利用酶法水解小麦B 淀粉的最佳工艺条件。
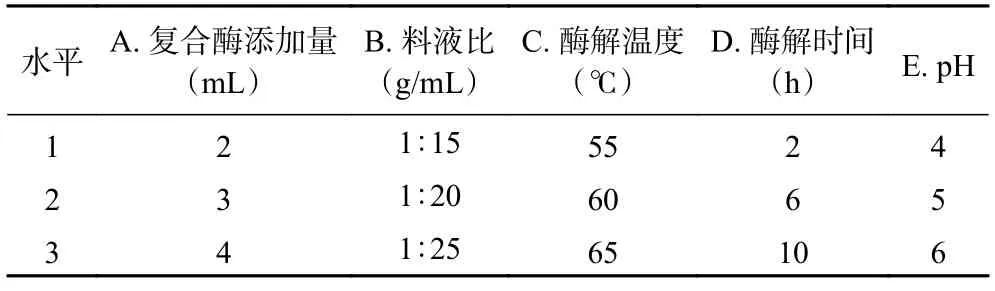
表1 正交试验因素与水平Table 1 Factors and levels of the orthogonal test
1.2.5 B 淀粉酶解前后扫描电镜 参照黄冬等[26]的方法并稍做修改。利用扫描电子显微镜(SEM)对B 淀粉及其糖化残渣的微观结构进行观察。将酶解后的残渣均匀的平铺在玻璃平板上,冷冻干燥24 h备用。剪取一段导电胶粘在铝制样品台上,用棉棒蘸取适量的样品,均匀涂抹在导电胶上,洗耳球吹去未粘紧的样品,喷金后置于电镜下依次用不同倍数放大扫描。
1.2.6 酿酒酵母发酵小麦B 淀粉生产酒精
1.2.6.1 小麦B 淀粉发酵液制备 称取2.0000 g 小麦B 淀粉于250 mL 摇瓶中,并加入50 mL 蒸馏水将其溶解。用0.5 mol/L 氢氧化钠溶液和稀盐酸溶液调节pH 至5.0。然后在沸水浴中加热15 min,使淀粉充分糊化,冷却到60 ℃以下,加入4 mL 配制好的复合酶液并置于60 ℃恒温水浴振荡器中酶解10 h。10 h 后取出煮沸灭酶,待冷却至室温后,用高速冷冻离心机8000 r/min 离心5 min,取上清液。
1.2.6.2 酒精发酵实验 从冷冻甘油菌液中沾取划线YPD 平板,置于30 ℃恒温培养箱培养2~3 d,获得酿酒酵母菌株单菌落。挑取单菌落接种于3 mL YPD 液体培养基中,30 ℃,240 r/min 培养24 h。菌液12000 r/min,离心5 min,去上清,用无菌水冲洗两次,按10%接种量接种到上述优化后酶解液中,30 ℃,240 r/min 摇瓶培养。发酵过程中,每隔4 h 取样一次直至发酵60 h[27]。发酵结束后,8000 r/min 离心5 min 取上清液冷冻保存。
1.2.6.3 发酵液中酒精和葡萄糖含量测定 用高效液相色谱法[28]测定发酵液中葡萄糖含量和酒精,并计算酒精原料得率和葡萄糖制乙醇转化率。色谱条件:检测器为示差检测器;色谱柱为Biorad HPX-87H;流动相为5 mmol/L 稀硫酸-水溶液;流速为0.6 mL/min;柱温为65 ℃;进样量为20 μL,每个样品收集时间为25 min。葡萄糖转化率、酒精原料得率和葡萄糖制乙醇转化率[29]计算公式如下:
式中:Cg 为所得葡萄糖浓度,g/L;V 为酶水解的体积,L;M 为干B 淀粉量,g;W 为干燥B 淀粉释放葡萄糖的最大量,%;Ce 为乙醇浓度,g/L;0.51 为葡萄糖转化为乙醇的理论值。
1.3 数据处理
实验重复三次以上,实验数值以平均值±标准差表示,利用Excel、IBM SPSS Statistics 26 对数据进行处理并利用GraphPad Prism 9 软件进行作图。
2 结果与分析
2.1 小麦B 淀粉的各组分含量
对小麦B 淀粉的各组分含量进行分析,结果见表2。由表2 可知,B 淀粉中含一定非淀粉物质,蛋白质和灰分均在2%左右,戊聚糖含量接近5%,这些是影响淀粉品质的主要因素,尤其是蛋白质和戊聚糖含量[30]。据研究,戊聚糖具有较强的胶凝性和黏性[31-32],是造成B 淀粉浆粘性大,在制糖浆时过滤困难的主要原因之一,也是限制B 淀粉加工利用的一个因素。淀粉作为小麦B 淀粉中的最重要成分,含量达85.61%,是利用小麦B 淀粉进行酶解产糖的主要来源,同时也说明了其作为酒精发酵底物的潜力。

表2 小麦B 淀粉各组分含量(%)Table 2 Content of each component of wheat B starch (%)
2.2 单因素实验结果
2.2.1 酶添加量对小麦B 淀粉酶解产糖效果的影响考察复合酶添加量对小麦B 淀粉酶解产糖效果的影响。结果如图1 所示,酶添加量在3 mL 时,淀粉水解效率最为显著(P<0.05)。这是因为随着酶添加量的增加,酶与底物的接触机会增多,加速B 淀粉水解,DE 值随之增加。酶添加量在此基础上再增加时,DE 值保持不变,推测酶量已经达到饱和,由此可知复合酶溶液为3 mL 时为最优添加量,即α-淀粉酶添加量为36 U/g、糖化酶添加量为225 U/g,此时DE 值为85.91%。
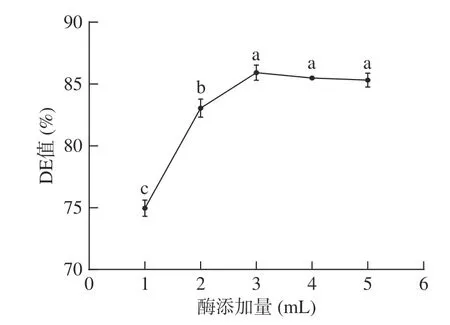
图1 酶添加量对DE 值的影响Fig.1 Effect of enzyme addition on DE value
2.2.2 料液比对小麦B 淀粉酶解产糖效果的影响考察料液比对小麦B 淀粉酶解产糖效果的影响,由图2 可以看出,料液比为1:20 g/mL 时,小麦B 淀粉酶解产糖的效果最好,DE 值达到87.34%。在一定范围内,随着底物浓度增加,在这个范围内酶处于过量阶段,酶与底物接触范围变大,使淀粉水解程度增大,DE 值随之升高;但底物浓度过高时,会抑制酶的活性,导致DE 值降低[33]。因此选择料液比为1:20 g/mL 进行后续正交试验。
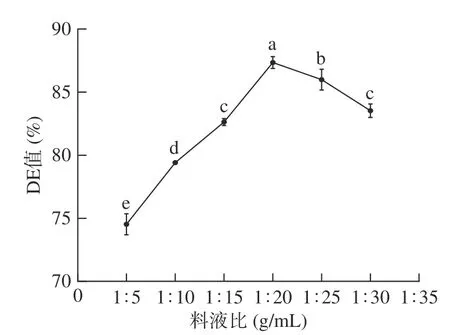
图2 料液比对DE 值的影响Fig.2 Effect of solid-to-liquid ratio on DE value
2.2.3 酶解温度对小麦B 淀粉酶解产糖效果的影响 考察酶解反应温度对小麦B 淀粉酶解产糖效果的影响,结果如图3 所示,50~60 ℃时,酶的活性随着温度的升高逐渐增大,60 ℃时DE 值达到最高值82.77%;高于60 ℃时,超过酶的最适工作温度,酶的活性降低,DE 值呈下降趋势。与先前研究一致,两种酶同时作用于淀粉水解,在60 ℃时葡萄糖释放量最高[34],因此选择60 ℃的最佳温度进行后续正交试验。
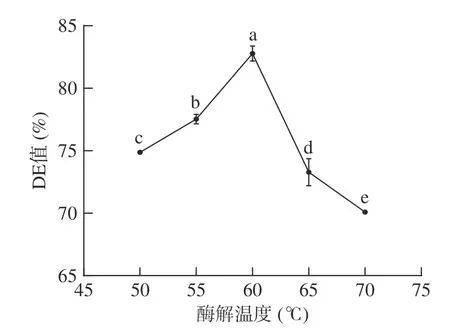
图3 温度对DE 值的影响Fig.3 Effect of temperature on DE value
2.2.4 酶解时间对小麦B 淀粉酶解产糖效果的影响考察酶解时间对小麦B 淀粉酶解产糖效果的影响,由图4 可见,随着酶解时间的延长,DE 值显著增加(P<0.05)。当酶解时间小于6 h,酶解时间过短,小麦B 淀粉酶解不完全,无法充分利用酶的效果,DE 值较低。反应时间10 h 时,DE 值达到88.59%,超过10 h 后,DE 值无显著变化。为了考虑时间的成本,选择10 h 进行后续试验。
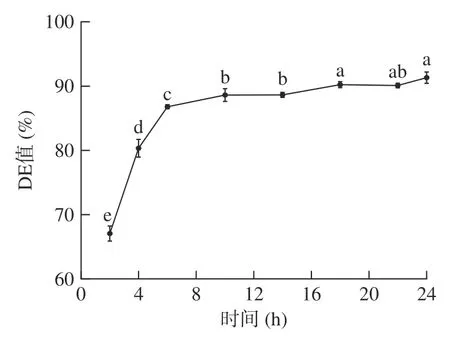
图4 反应时间对DE 值的影响Fig.4 Effect of time on DE value
2.2.5 pH 对小麦B 淀粉酶解产糖效果的影响 由图5 可以看出,pH 为5 时,此时水解效率最为显著,DE 值达到76.91%,这是因为pH 过高或过低都会导致酶活力下降[35]。在pH 小于5 时,随着pH 的升高,还原糖量逐渐增多;而当pH 高于5 时,随着pH 的升高,小麦B 淀粉酶解产生的还原糖含量下降,DE 显著降低(P<0.05)。因此选择pH 为5 时进行后续试验。

图5 pH 对DE 值的影响Fig.5 Effect of pH on DE value
2.3 正交试验结果
为了优化小麦B 淀粉酶解工艺,将复合酶用量、pH、温度、料液比及时间这5 个因素进行正交试验,以DE 值为评价指标,实验结果如表3 及表4 所示。其中试验14 中所利用条件,DE 值可以达到89.01%±1.4%。从各个因素的不同水平分析可以得到,各个因素影响DE 值顺序分别为A3>A2>A1、B3>B2>B1、C2>C1>C3、D3>D2>D1、E2>E3>E1,因此可以确定小麦B 淀粉酶解产糖最佳工艺条件为A3B3C2D3E2,即最佳酶解产糖工艺的最佳条件是复合酶添加量4 mL(α-淀粉酶添加量48 U/g,糖化酶添加量300 U/g),料液比1:25 g/mL,酶解温度60 ℃,酶解时间10 h,pH=5。在最佳工艺条件下进行三次平行测定实验,DE 值达到94.60%±1.40%,大于正交试验结果的最高值89.01%±1.40%,说明本参数条件可提高小麦B 淀粉酶解产糖效率。

表3 正交试验结果Table 3 Results of orthogonal experiments
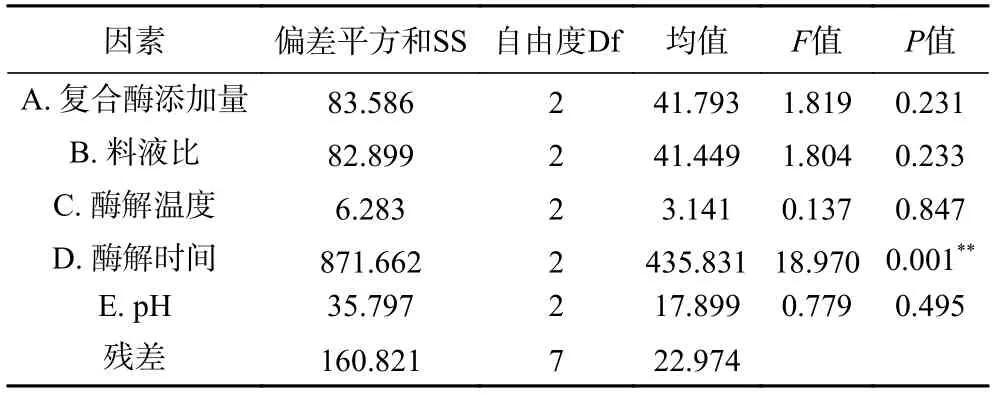
表4 正交试验方差分析Table 4 Analysis of variance for orthogonal experiments
2.4 B 淀粉酶解前后扫描电镜分析
利用扫描电镜对酶解前后小麦B 淀粉进行分析,结果如图6 所示。从图6a 中可以观察出,酶解前的小麦B 淀粉以小颗粒为主,还含有较大的损伤淀粉颗粒。图6b 是经α-淀粉酶和糖化酶酶解后的样品,从图中可以观察到淀粉颗粒形态发生了明显变化,球形淀粉颗粒观察不到,在α-淀粉酶和糖化酶作用下淀粉被完全水解[36]。

图6 小麦B 淀粉酶解前后电镜图Fig.6 Scanning electron microscopy (SEM) of wheat B starch before and after enzymatic hydrolysis
2.5 使用小麦B 淀粉酶解糖液酒精发酵
使用酿酒酵母对小麦B 淀粉酶解液发酵,酶解液中葡萄糖初始浓度29.343 g/L(表5),随着发酵时间地进行,葡萄糖含量逐渐下降,酒精浓度逐渐升高,最终酒精浓度达到12.761 g/L,酒精原料得率为31.90%±0.28%,如表5 及图7 所示。该结果证明了利用一步酶解发酵小麦B 淀粉生产酒精的潜力,为B 淀粉废弃资源利用提供了参考价值。
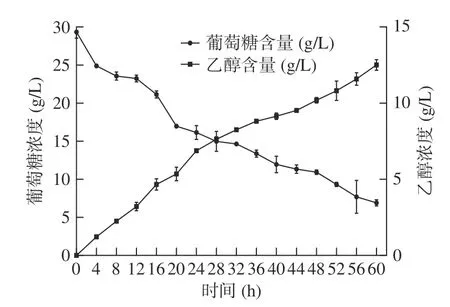
图7 酿酒酵母发酵小麦B 淀粉酶解液生产酒精糖降解及酒精生成情况Fig.7 Fermentation of wheat B starch hydrolysate by brewing yeast to produce alcoholic sugar degradation and alcohol production

表5 利用小麦B 淀粉酶解液发酵生产酒精Table 5 Alcohol production by fermentation using enzyme digest of wheat B starch
3 结论
本研究采用一步酶解法水解小麦B 淀粉,系统考察了酶添加量、酶解时间、pH、料液比、温度对还原糖得率的影响。利用正交工艺进行参数优化,采用价格比较便宜的中温α-淀粉酶和糖化酶酶解淀粉得出了最佳工艺条件:α-淀粉酶用量48 U/g,糖化酶用量300 U/g,pH5,酶解温度60 ℃,料液比1:25 g/mL,酶解时间时间10 h。在该条件下,DE 值为94.6%。使用酿酒酵母菌株发酵酶解液生产酒精乙醇可获得12.76 g/L,酒精原料得率可达31.28%。本研究开发了一步酶解制备可发酵糖用于生产酒精的简便方法,不仅可以减少资源浪费,提高经济效益,同时也可以拓宽酒精生产原料。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).
