姜黄素调控KLF2表达对BV2细胞OGD模型中的作用及机制*
2024-05-12魏建明曹湘玉叶紫阳
魏建明 曹湘玉 叶紫阳 杨 霞
湖南医药学院, 湖南省怀化市 418000
缺血性脑卒中(Ischemic stroke, IS)占脑卒中总数的70%~80%,具有高发病率、病死率、致残率、复发率及年轻化趋势等特点[1],已成为威胁人类健康的重要公共卫生问题。IS发生机制主要包括炎症反应、氧化应激损伤、铁死亡、细胞焦亡等,其中炎症反应是关键机制之一。小胶质细胞作为中枢神经系统的免疫效应细胞,在调控神经炎症方面发挥关键作用。研究表明脑缺血再灌注损伤后,脑缺血区小胶质细胞过度激活,加剧炎症因子的释放,导致脑缺血损伤导致神经元死亡[2]。Kruppel样因子2(Kruppel-like factor 2,KLF2)是一类具有锌指结构域的核转录因子,结合靶基因启动子GC富含序列,调控相应基因的表达[3]。研究表明激活KLF2能抑制内皮细胞及巨噬细胞分泌的炎症因子、趋化因子的表达,发挥抗炎作用[4]。姜黄素(Curcumin)是姜黄根茎的主要生物活性成分,有天然的抗氧化性、抗炎特性和抑制凋亡等多种生物学功能[5]。研究证实姜黄素对IS具有神经保护作用,但具体作用机制仍未明确[6]。本研究拟通过(Oxygen-Glucose Deprivation, OGD)模型模拟神经元缺血缺氧环境诱导BV-2小胶质细胞活化,观察姜黄素对BV-2小胶质细胞损伤后的抗炎作用,探讨KLF2是否介导姜黄素治疗IS的神经保护作用。
1 材料与方法
1.1 材料
1.1.1 BV2细胞。小鼠源性BV2细胞(中国科学院典型培养物保藏委员会细胞库,批号SCSP-5208)。
1.1.2 试剂与仪器。 姜黄素(长沙鼎国生物技术有限公司),胎牛血清(美国Gibco公司),DMEM细胞培养基(美国Gibco公司),MTT细胞增殖及细胞毒性检测试剂盒、ELISA试剂盒(上海碧云天生物技术有限公司),KLF2-si RNA(上海吉玛制药技术有限公司),Lipofectamine2000试剂(美国Invitrogen公司),KLF2抗体(abs124444)、p-NF-κB抗体(SAB4301496)、NF-κB抗体(SAB4502615);酶标仪(美国BioTek公司)、Forma Steri-Cycle型CO2细胞培养箱(美国赛默飞公司)、凝胶成像系统(美国Bio-Rad公司)。
1.2 实验方法
1.2.1 细胞培养。BV2细胞采用含4.5g/L葡萄糖和10%胎牛血清的新鲜DMEM培养基在37℃、95%氧气、5%CO2细胞培养箱进行培养,观察细胞密度达到约90%以上进行消化,按1∶4比例进行传代培养。
1.2.2 OGD建模及处理。将BV2细胞随机分为正常培养的对照组(Control组)、氧糖剥夺模型组(OGD组)、姜黄素干预组(Cur组)。对照组在培养箱中正常培养细胞,模型组加入无糖DMEM培养基在37℃、95%氮气、5%CO2环境中培养2h,然后更换含糖DMEM培养基并置于37℃、5%CO2环境中孵育24h。姜黄素组在构建OGD模型后采用不同浓度(1、5、10、20μmol/L)的姜黄素处理BV2细胞24h。
1.2.3 噻唑蓝 (Methylthiazolyldiphenyl-tetrazolium bromide, MTT)检测BV2细胞活力。 将细胞接种于96孔细胞培养板,每孔细胞密度5×104个,每组各孔加入20μL的MTT溶液,37℃孵育4h,3 000r/min离心5min,吸取并弃去上清液,各孔再加150μL二甲基亚砜(DMSO)溶解,振荡混匀10min,使用酶标仪在490nm波长处测定其吸光度(OD)。细胞活力=(OD值实验组-OD值空白组)/OD值空白组,其中OD值实验组为实验组的吸光度,OD值空白组为空白组的吸光度。
1.2.4 Western blot检测KLF2、p-NF-κB、NF-κB蛋白表达水平。将BV2细胞接种于6孔细胞培养板,细胞密度为106个/孔,加入600μL细胞裂解液,冰上裂解5min, 用细胞刮轻轻刮下细胞,收集于离心管中,4℃离心5min,取上清蛋白溶液,进行蛋白定量检测,采用聚丙烯酰胺凝胶进行电泳后,切胶、转膜,5%脱脂牛奶封闭2h,加入KLF2、p-NF-κB、NF-κB抗体(1∶1 000),4℃孵育过夜。用1×TBST洗膜3次,每次10min, 加入稀释后的二抗溶液 (1∶5 000),室温孵育1h,洗膜3次,用化学发光法分析仪显影,使用Image J软件进行条带灰度值分析。
1.2.5 细胞转染。将BV2细胞接种于6孔细胞培养板,细胞密度为106个/孔,24h后, 分别加入KLF2-siRNA或乱序-siRNA(SC-siRNA)孵育6h后,然后根据转染试剂说明书步骤,使用Lipofectamine2000试剂进行辅助转染,37℃孵育24h,Western blot检测KLF2表达水平,以评价干扰效果,β-actin作为内参。
1.2.6 ELISA检测炎症因子TNF-α、IL-1β水平。吸取各组细胞上清液至离心管中,4℃ 2 000r/min离心5min,小心吸取上清,分装后-20℃冻存。取出ELISA试剂盒平衡至室温,按试剂盒内说明进行操作。

2 结果
2.1 不同剂量姜黄素对OGD诱导的BV2细胞活力的影响 为观察姜黄素对OGD诱导的BV2细胞的保护作用,我们将BV2细胞分为6组,分别为Control组、OGD组、OGD+1μmol/L Cur组、OGD+5μmol/L Cur组、OGD+10μmol/L Cur组、OGD+20μmol/L Cur组。MTT结果显示(见表1):与Control组相比,OGD组BV2细胞活力显著降低 (P<0.05),而与OGD组相比,OGD+10μmol/L Cur组、OGD+20μmol/L Cur组均可显著升高BV2细胞活力 (P<0.05)。本研究还发现,在姜黄素的浓度为10μmol/L时,细胞存活率最高。因此,本研究后续的实验选择姜黄素的浓度为10μmol/L。

表1 不同剂量姜黄素对OGD诱导的B V2细胞活力的影响
2.2 姜黄素可调控OGD诱导的BV2细胞KLF2、p-NF-κB、NF-κB的表达 为探索KLF2是否介导姜黄素的神经保护作用,分别检测Control组、OGD组和OGD+10μmol/L Cur组KLF2、p-NF-κB、NF-κB蛋白的表达。Western blot结果显示 (见表2):与Control组相比,OGD组KLF2蛋白表达水平显著降低(P<0.05),p-NF-κB蛋白表达水平显著升高(P<0.05),而姜黄素可显著增加OGD诱导的BV2细胞KLF2蛋白表达(P<0.05),降低p-NF-κB蛋白的表达(P<0.05)。

表2 各组BV2细胞的KLF2、p-NF-κB、NF-κB蛋白表达比较
2.3 姜黄素可降低OGD诱导的BV2细胞炎症因子TNF-α、IL-1β的水平 为探讨姜黄素在OGD诱导的BV2细胞的神经保护作用机制,分别检测Control组、OGD组和OGD+10μmol/L Cur组炎症因子TNF-α、IL-1β的水平,ELISA结果显示(见表3):与Control组相比,OGD组炎症因子TNF-α、IL-1β的水平显著升高(P<0.05),而姜黄素可显著降低OGD诱导的BV2细胞TNF-α、IL-1β的水平(P<0.05)。
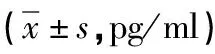
表3 各组BV2细胞的TNF-α、IL-1β水平比较
2.4 KLF2- siRNA显著逆转了姜黄素对OGD诱导的BV2细胞的保护作用 为进一步研究KLF2在姜黄素保护OGD诱导的BV2细胞中的作用,采用KLF2-siRNA干扰BV2细胞KLF2的表达以评价干扰效果。先将细胞分为3组,分别为Control组、KLF2-siRNA组和SC-siRNA组。Western blot结果显示(见表4):与Control组相比,KLF2-siRNA可显著下调细胞KLF2蛋白表达水平(P<0.05),SC-siRNA未对KLF2表达产生显著影响(P>0.05)。

表4 各组BV2细胞的KLF2蛋白表达比较
随后,我们将细胞分为5组,分别为Control组、OGD组、Cur+OGD组、KLF2-siRNA+Cur+OGD组、SC-siRNA+Cur+OGD组。Western blot结果显示 (见表5) :与Control组相比,OGD组p-NF-κB蛋白表达显著增高(P<0.05),姜黄素组p-NF-κB蛋白表达显著降低(P<0.05),KLF2-siRNA处理可显著消除Cur对p-NF-κB表达的降低作用(P<0.05),SC-siRNA处理未对p-NF-κB表达产生显著影响(P>0.05)。ELISA结果显示(见表6):与Control组相比,OGD组炎症因子TNF-α、IL-1β的水平显著升高(P<0.05),而姜黄素可显著降低OGD诱导的BV2细胞TNF-α、IL-1β的水平(P<0.05),KLF2-siRNA处理可显著消除Cur对TNF-α、IL-1β水平的影响(P<0.05),SC-siRNA处理未对TNF-α、IL-1β的水平产生影响(P>0.05)。

表5 各组BV2细胞的KLF2、p-NF-κB、NF-κB蛋白表达比较
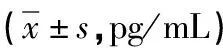
表6 各组BV2细胞的TNF-α、IL-1β水平比较
3 讨论
缺血性脑卒中(IS)是由于脑部血管内发生缺血而造成大脑血液供应中断和能量提供不足,可促使神经元发生不可逆性损伤坏死。目前主要通过静脉溶栓及血管内再通治疗以挽救缺血区脑细胞并改善神经功能,仍有部分患者遗留神经功能障碍。研究表明[7-8],炎症反应是 IS的关键发病机制之一,而IS后炎症反应造成的神经功能损伤与小胶质细胞过度激活密切相关,而抑制炎症反应能保护神经元细胞和改善神经功能缺损,对IS的治疗具有重要的意义。
据报道,姜黄素是姜黄的主要成分,具有抗炎、抗氧化、抗肿瘤等作用,且具有亲脂性,容易透过血脑屏障,有利于治疗中枢神经系统疾病,尤其是脑血管疾病的治疗[9]。TNF-α、IL-1β是机体重要的促炎细胞因子,在炎症和免疫中起关键作用。研究表明急性脑梗死患者血清TNF-α、IL-1β水平明显增高,且与病情严重程度呈正相关,提示TNF-α、IL-1β可用于急性脑梗死的程度判断及预后评估[10-11]。研究表明[7],姜黄素能抑制小胶质细胞的活化及增殖,降低炎症因子TNF-α、IL-1β的水平,对脑缺血再灌注损伤有一定的保护作用。研究表明,姜黄素通过抑制Toll样受体4(TLR4)及炎症因子TNF-α、IL-6、IL-1β的表达,进而降低MCAO大鼠脑梗死体积,改善神经功能缺损起到脑保护作用。本研究显示,姜黄素抑制ODG诱导的BV2细胞TNF-α、IL-1β的表达,减轻炎症反应而发挥神经保护作用,与上述研究[7-8]报道一致。
KLF2是一种锌指转录因子,可调节炎症反应、细胞凋亡和增殖等细胞应激过程,参与多种疾病的病理生理发展过程。研究发现[12-13]急性脑梗死患者血清KLF2下降,随着梗死面积增大,KLF2水平降低,且与病情严重程度呈负相关,表明血清KLF2水平是评估急性脑梗死的病情严重程度的重要指标之一。研究表明,在脑出血大鼠模型中,去泛素化酶USP11表达增高,抑制KLF2表达,激活核因子κB(Nuclear factor kappa-B,NF-κB)通路,引起小胶质细胞活化,增强促炎介质IL-1β、TNF-α的释放,导致脑出血后炎症[14],而下调USP11表达,促进KLF2表达,能明显减轻炎症反应。Shi 等[15]在大鼠肺组织纤维化模型中发现,过表达KLF2可减轻肺间质的破坏和胶原增生,抑制促炎因子TNF-α、IL-1β、IL-6的合成与释放,减轻炎症反应,改善肺组织纤维化和肺组织损伤。研究表明[16],姜黄素能抑制猪脂肪间充质干细胞(AMSCs)的增殖和成脂分化作用与其增加KLF2 mRNA的表达相关。本研究结果显示,姜黄素能上调KLF2表达,抑制炎症因子的释放;而下调KLF2表达,姜黄素产生的上述保护作用也随之消失。由此可见,KLF2可能介导了姜黄素对OGD诱导BV2细胞损伤的神经保护作用。
NF-κB是一种转录调节蛋白,参与调节脑缺血缺氧后炎症反应并释放促炎细胞因子、趋化因子及黏附分子等[17]。徐飞飞等[2]研究发现脑缺血时小胶质细胞中的NF-κB被激活后,炎性因子TNF-α、IL-1β、IL-18的合成和释放增加,同时这些促炎细胞因子又可以激活NF-κB,从而使该过程在脑细胞间不断扩散,加重炎症反应。研究表明[18]KLF2能直接与p300及其相关因子PCAF相互作用来抑制NF-κB转录活性,负调控炎症反应发挥抗炎作用[19-20]。有研究证实[21],姜黄素通过抑制NF-кB的激活以减轻阿尔茨海默病(AD)大鼠大脑中的炎性反应,提高其学习记忆能力。本研究结果显示,姜黄素上调KLF2表达,降低促炎细胞因子TNF-α、IL-1β的水平,可能是通过抑制NF-κB信号通路来实现对神经元缺血缺氧损伤的神经保护作用。另有研究表明[22]姜黄素减轻脑梗死后炎症反应,其机制可能与其阻断NLRP3/Caspase-1信号通路有关。结合本研究和其他学者的研究,可以确定姜黄素能通过多种信号通路对脑缺血再灌注损伤发挥神经保护作用。
综上所述,姜黄素对OGD诱导的BV2细胞发挥神经保护作用,可能是通过上调KLF2,抑制NF-κB信号通路,降低炎症因子TNF-α、IL-1β的水平,以减轻脑缺血再灌注损伤。本研究为探索姜黄素的现代应用提供新靶点,也为IS治疗提供理论支持、实验依据及带来临床应用前景。
