γ-谷氨酰转移酶/血小板在乙肝肝硬化失代偿期患者中的表达及临床意义
2024-05-11杨晓曼
杨晓曼
(商丘市中心医院 检验科,河南 商丘 476000)
乙肝肝硬化根据病情进展可分为代偿期和失代偿期,其中失代偿期患者肝功能损害程度重,不良预后风险更高[1]。因此,积极探寻与乙肝肝硬化失代偿期患者病情及预后的相关生物学指标,对早期实施干预及治疗措施、改善患者预后有重要意义。人体血清中γ-谷氨酰转移酶(gamma-glutamyl transferase,GGT)主要来自肝脏,其水平升高通常与病毒性肝炎、酒精性肝炎、脂肪性肝炎有关,是临床评估肝损伤的重要指标[2]。血小板(platelet,PLT)是血液中的重要成分,肝细胞受损和肝纤维化的加重会导致PLT生成素以及分泌减少,继而引起PLT数量减少,因而其也是临床评估肝硬化病情的常用指标[3]。但单一指标检测结果易受多种因素影响,影响评估的准确性。近年来,有研究将GGT/PLT用于丙肝纤维化患者临床诊断中,且取得一定的价值[4]。本研究观察GGT/PLT在乙肝肝硬化失代偿期患者中的表达,并探究其临床意义。
1 资料与方法
1.1 研究对象
回顾性研究。收集2019年1月至2023年1月医院65例乙肝肝硬化失代偿期患者的临床资料。男34例,女31例;年龄58~67(62.56±1.52)岁;体重指数18.26~23.25(20.74±0.83)kg·m-2;有酗酒史49例。
1.2 入选标准
(1)纳入标准:①乙肝肝硬化符合《慢性乙型肝炎防治指南(2015更新版)》[5]中的诊断标准,且通过病史及体格、影像学、实验室检查证实;②乙肝肝硬化处于失代偿期,患者出现腹胀、纳差、全身水肿、腹水、食管静脉曲张或脓毒血症及肝肾综合征;③完成为期6个月随访;④临床资料保存完整,无缺失。(2)排除标准:①合并恶性肿瘤或全身传染性疾病;②合并原发性凝血功能障碍;③长期服用抗凝、抗PLT药物;④既往有肝脏手术史。
1.3 干预方法
1.3.1Child-Pugh分级评估
患者入院时行体格检查、实验室检查、影像学检查。(1)实验室检查:采集患者空腹外周肘静脉血5 mL分别置于两支试管中。取其中一支试管以4 000 r·min-1(离心半径为15.0 cm)离心5 min取血清,检测血清总胆红素(total bilirubin,TBil)、白蛋白(albumin,ALB),试剂购自宁波美康生物科技有限公司;取另一支抗凝试管,采用全自动血凝分析仪(深圳迈瑞生物科技有限公司,EXC-800)检测凝血酶原时间(prothrombin time,PT)。(2)影像学检查:行CT检查评估患者有腹水情况。(3)经体格检查、神经心理学测试检查患者有无肝性脑病。根据检查结果评估Child-Pugh分级[6]。①以下各项计1分:无肝性脑病、无腹水、TBil<34 μmol·L-1、ALB>35 g·L-1、PT延长<4 s。②以下各项计2分:1~2级肝性脑病、轻度腹水、TBil 34~51 μmol·L-1、ALB 28~35 g·L-1、PT延长4~6 s。③以下各项计3分:3~4级肝性脑病、重度腹水、TBil>51 μmol·L-1、ALB<28g·L-1、PT延长>6 s。根据患者得分进行Child-Pugh分级:A级,5~6分,手术危险程度较小,预后最好;B级,7~9分,手术危险程度中等;C级,≥10分,手术危险程度较高,预后最差。
1.3.2血清GGT、PLT检查
入院时常规采集患者空腹外周肘静脉血5 mL,进行离心处理取血清,使用贝克曼库特AU5800 型全自动生化分析仪检测患者血清GGT水平,使用迈瑞BC-6800P全自动血球仪检测PLT水平,并计算GGT/PLT。
1.3.3治疗方案
患者入院后卧床休息,给予高蛋白及低钠饮食,口服恩替卡韦分散片进行抗病毒治疗。对于转氨酶、胆红素升高患者给予降酶、退黄治疗,尿少患者给予利尿药物及ALB治疗,必要时进行腹水穿刺。
1.4 统计学处理

2 结果
2.1 一般资料
65例乙肝肝硬化失代偿期患者中Child-Pugh B级38例,Child-Pugh C级27例。Child-Pugh C级患者肝硬化病程长于Child-Pugh B级患者(P<0.05)。两组间其他资料比较,差异无统计学意义(P>0.05)。见表1。
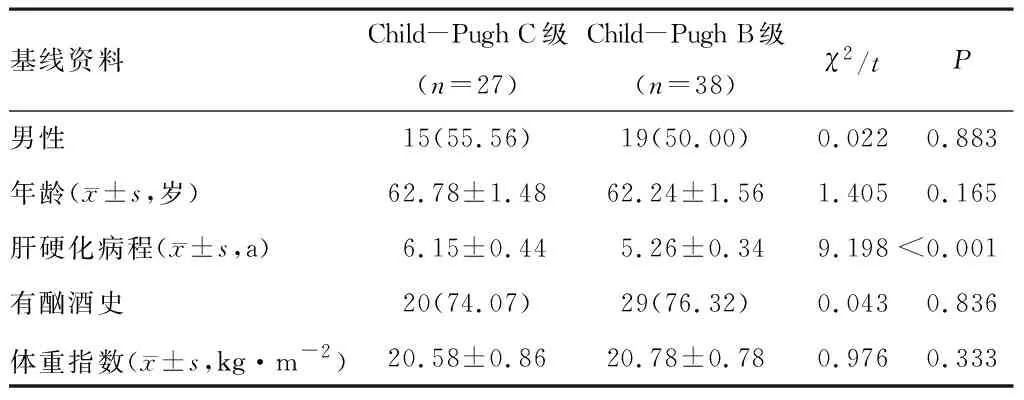
表1 不同Child-Pugh分级患者一般资料比较
2.2 不同Child-Pugh分级患者GGT、PLT、GGT/PLT水平
Child-Pugh C级患者GGT、GGT/PLT高于Child-Pugh B级患者,PLT低于Child-Pugh B级患者(P<0.05)。见表2。
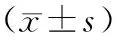
表2 不同Child-Pugh分级患者GGT、PLT、GGT/PLT水平比较
2.3 GGT、PLT、GGT/PLT与患者Child-Pugh分级相关性
经Kendall’s tau-b相关系数检验显示,GGT、GGT/PLT与患者Child-Pugh分级呈正相关(r=0.528、0.559,P<0.001),PLT与患者Child-Pugh分级呈负相关(r=-0.461,P<0.001)。
2.4 预后及不同预后结局患者GGT、PLT、GGT/PLT水平
65例乙肝肝硬化失代偿期患者随访期间存活42例,病死23例;病死患者GGT、GGT/PLT高于存活患者,PLT低于存活患者(P<0.05)。见表3。
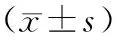
表3 不同预后结局患者GGT、PLT、GGT/PLT水平比较
2.5 GGT、PLT、GGT/PLT对患者近期预后的预测价值
以乙肝肝硬化失代偿期患者近期预后结局作为状态变量(病死=1,存活=0),纳入GGT、PLT、GGT/PLT作为检验变量,绘制ROC曲线,结果显示,血清GGT、PLT、GGT/PLT预测乙肝肝硬化失代偿期患者短期预后的AUC均≥0.7,均有一定的预测价值。见表4。
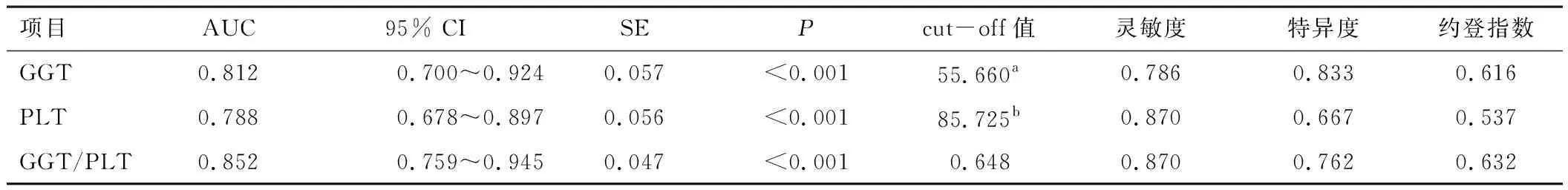
表4 GGT、PLT、GGT/PLT对乙肝肝硬化失代偿期患者近期预后的预测价值
3 讨论
乙肝肝硬化失代偿期患者常伴严重肝功能损伤,常需终身服用抗病毒药物,但仍会引起多种器官功能障碍,导致其生存率低。因此,临床对乙肝肝硬化失代偿期患者病情诊断及预后评估格外重视。Child-Pugh分级是评估肝功能的主要方法,结合实验室检查、体格检查及影像学检查,利于综合评估肝功能及相关并发症情况,进而明确肝功能损害程度[7]。但Child-Pugh分级检查流程复杂,且部分检查项目受患者主观因素,易产生一定误差。
GGT/PLT模型对慢性乙型肝炎患者明显纤维化和肝硬化诊断的准确性高于传统的丙氨酸转氨酸酶/PLT模型、基于透明质酸酶、Ⅲ型前胶原蛋白、Ⅳ型胶原以及层黏连蛋白4因素的肝纤维化指数模型[8]。
本研究结果显示,Child-Pugh C级患者GGT/PLT高于Child-Pugh B级患者,且经Kendall’s tau-b相关系数检验显示GGT/PLT与患者Child-Pugh分级呈正相关,说明GGT/PLT与Child-Pugh分级有关。分析其原因在于,Child-Pugh C分级患者肝损伤、肝硬化程度较Child-Pugh B更严重,易出现肝外胆管狭窄和肝内梗阻,导致胆汁反流入血;而血清中GGT主要来自于肝脏系统中肝内胆管上皮和肝细胞浆,出现肝外胆管狭窄和肝内梗阻时,其会随着胆汁反流入血,继而导致GGT水平持续升高[9-10]。乙肝肝硬化失代偿期患者存在不同程度的脾功能亢进,随着患者肝硬化病情的加重,Child-Pugh分级提高,单核-巨噬细胞系统会大量吞噬并破坏PLT,导致PLT含量持续减少;同时Child-Pugh C级的肝硬化患者肝脏受损程度更重,肝脏受损程度越重越会阻碍PLT生成素合成,进而影响PLT含量及体积,导致PLT水平降低[11-12]。但GGT、PLT都可能受乙肝肝硬化以外其他各种疾病的影响,而GGT/PLT越高表示患者肝脏正常解剖结构遭到严重破坏,肝细胞已经难以满足机体正常需要,患者病情更重[13]。
本研究结果还显示,病死患者GGT/PLT高于存活患者,这与GGT/PLT水平越高患者肝功能损害程度越重有密切关系,或可考虑将之用于患者临床预后预测。ROC曲线显示,血清GGT、PLT、GGT/PLT预测乙肝肝硬化失代偿期患者近期预后的AUC均≥0.7,说明GGT/PLT在乙肝肝硬化失代偿期患者近期预后预测中具有一定的应用价值。由此,建议早期监测乙肝肝硬化失代偿期患者GGT/PLT以预测患者病死风险,并以此辅助制定患者针对性的治疗及干预措施。
4 结论
GGT/PLT与乙肝肝硬化失代偿期患者Child-Pugh分级呈正相关,早期检测患者GGT/PLT水平可用于预测患者短期不良预后风险,继而可指导患者干预及治疗措施的优化,改善患者预后。
