碳酸酐酶9在口腔鳞癌中的表达及其预后诊断价值
2024-05-11李晓宇李丽娜高瑞马欣
李晓宇,李丽娜,高瑞,马欣
(1.河南省人民医院 口腔科,河南 郑州 450000;2.宁夏医科大学总医院 口腔科,银川 宁夏 750000;3.郑州市第七人民医院 口腔科,河南 郑州 450000)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)起源于鳞状上皮,其发生率在所有恶性肿瘤中排第9[1-2],且近些年其发病率有年轻化趋势[3]。OSCC的致病因素众多,除了先天遗传因素外,烟、酒、槟榔为主要的后天致病因素[4]。据统计,全球每年新诊断口腔癌病例超过300 000例,且每年总死亡人数超过140 000例[5]。OSCC的预后与其分期密切相关,据统计,Ⅰ期5 a生存率为80%,Ⅱ期为65%,Ⅲ期和Ⅳ期5 a生存率分别为49%和30%[6-7]。因此,寻找有价值的生物标志物和治疗靶点对于OSCC的预后至关重要。
碳酸酐酶9(carbonic anhydrase 9,CA9)是一种跨细胞膜金属蛋白酶,在调节体内pH值和细胞生长、黏附方面发挥重要作用[8]。CA9通过催化二氧化碳合成碳酸氢盐和质子,促进肿瘤环境酸化,导致肿瘤易发生转移和对弱碱性抗癌药物的化疗耐药[9]。研究表明,CA9在乳腺癌[10]、肺癌[11]、肾癌[12]等多种恶性肿瘤中表达异常。本研究通过生信分析和相关的实验检测探讨CA9的表达水平与OSCC临床病理参数的相关性及其预后诊断价值,为临床OSCC的早期诊断和治疗提供理论依据。
1 资料与方法
1.1 标本收集
课题组成员于2017—2021年在河南省人民医院口腔颌面外科随机收取了86对已配对完成的OSCC组织及癌旁组织标本。5对新鲜的OSCC组织及其配对癌旁组织(癌灶外≥5 mm的正常组织)于2020—2022年随机收集,EP管液氮罐转运,置于-80 ℃冰箱中保存备用。所有患者均无糖尿病等严重并发症,术前均未行放、化疗,且均接受手术切除,术后配合适当的放疗或化疗。组织学诊断和OSCC临床分级由本研究2名工作者共同判定。本研究内容已通过医院医学伦理委员会审查,所有受试对象知情同意。此外,通过肿瘤基因组图谱(The Cancer Genome Atlas,TCGA)数据库(https://portal.gdc.cancer.gov/)下载OSCC患者的mRNA表达谱信息(格式为TPM,平台为RNAseq)。
1.2 细胞培养
口腔鳞癌细胞系(SCC-15、CAL-27、HSC-3、SCC-25)置于高糖DMEM培养基中培养,人正常口腔角质形成细胞置于无血清培养基中培养,补充1%(质量分数)角质形成细胞生长因子加上皮生长因子混合物。在全部培养基中按顺序分别加入10%(体积分数)胎牛血清和100 U·mL-1青、链霉素,所有培养基均放置在37 ℃,含5% CO2的恒温培养箱中孵育,注意按时换新的细胞培养液(2~3 d)。
1.3 定量反转录聚合酶链反应(quantitative reverse transcription polymerase chain reaction,qRT-PCR)
取新鲜组织50~80 mg,提取总RNA。荧光定量PCR引物采用引物设计软件Primer Premier 5.0,设计完成后用PubMed Blast程序对所有碱基对序列进行验证。PCR反应过程在LightCyc1er480实时荧光定量PCR仪内完成,按照PCR试剂盒说明书进行PCR扩增。按照说明书的反应条件进行,反应完毕后利用PCR仪中的软件绘制扩增曲线和融解曲线,算得每个样本的Ct值。每个样本均重复检验3次。ΔCt求得组织中mRNA的相对量。引物设计:CA9上游引物5’-CGGCAAGTTGTCGGAGACG-3’,下游引物5’-CCTGGAGGTTGGGATGCTCT-3’;β-actin上游引物 5’-AGGGAAATCGT GCGTGAC-3’,下游引物5’-CGCTCATTGCCGATAGTG-3’。
1.4 免疫组化染色
将包埋好的蜡块使用切片机沿矢状长轴切片,制备5 μm切片,经脱蜡、水化后用内源性过氧化物酶进行阻断处理,柠檬酸钠盐缓冲液修复抗原,滴加50 μL封闭液在组织切片上,放在湿盒之中在37 ℃条件下孵育30 min,滴加一抗、二抗,显色,复染,浓度梯度逐渐升高的酒精(50%、75%、95%、100%)脱水,使用二甲苯洗净切片表面,最后加中性树脂1滴,盖上玻片,封片,待干片后显微镜下拍照。
最终的染色结果由本院两位病理科医生通过双盲法进行评估,随机选取5个不同的视野,发现棕褐色的颗粒出现在细胞质或细胞核内为阳性表达,根据染色的强度和染色细胞的百分数分级。染色强度的分级如下:0,无染色;1+,浅色染色;2+,中度染色;3+,重染色。染色面积的分级如下:0,无染色;1+,<30%组织染色为阳性;2+,30%~60%组织染色为阳性;3+,>60%组织染色为阳性。以染色强度和染色面积的评分之和评估CA9表达,<3分为CA9低表达,≥3分为CA9高表达。
1.5 随访
患者手术后,每6个月随访1次,截至2022年6月,详细记录所有OSCC患者的总生存期,并保证所有OSCC患者(除死亡外)均接受3 a以上的随访,如有中途失访者,则记录最后一次随访时间。随访形式以致电患者本人或其家属为主,以患者门诊复诊为辅。
1.6 统计分析

2 结果
2.1 生物信息学分析CA9 mRNA在OSCC中的表达
在TCGA数据库中,CA9mRNA在OSCC组织中的表达高于正常组织(P<0.001),见图1A。在32例配对的OSCC组织和癌旁组织中,CA9mRNA在OSCC组织中的表达也高于其配对癌旁组织(P<0.001),见图1B。为了进一步评估CA9mRNA在人类恶性肿瘤中的表达,分析了TCGA数据库中CA9mRNA在泛癌中的表达水平,结果显示CA9mRNA在浸润性乳腺癌、头颈部鳞状细胞癌、胃腺癌等绝大多数恶性肿瘤中表达异常(P<0.05),见图1C。
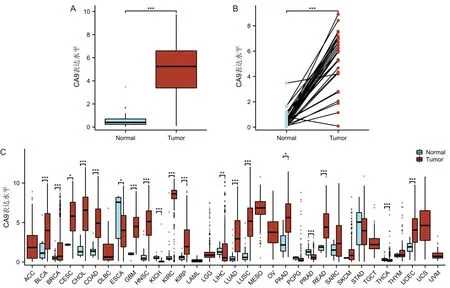
A为TCGA数据库中CA9 mRNA的表达;B为32例配对的OSCC组织和癌旁组织中CA9 mRNA的表达;C为CA9 mRNA在泛癌中的表达;CA9为碳酸酐酶9。图1 TCGA数据库中CA9 mRNA在OSCC和其他肿瘤组织中的表达
2.2 qRT-PCR检测CA9 mRNA在OSCC组织和癌旁组织中的表达
为了验证TCGA数据库的分析结果,通过qRT-PCR检测CA9mRNA的表达水平,结果表明CA9mRNA在5对OSCC组织中的表达高于配对癌旁组织(P<0.01),见图2。
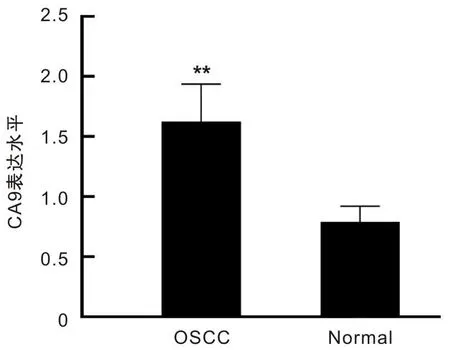
CA9为碳酸酐酶9;OSCC为口腔鳞状细胞癌;**表示P<0.01。图2 qRT-PCR检测CA9在5对OSCC组织和癌旁组织中的表达
2.3 免疫组化检测CA9在OSCC组织和癌旁组织中的表达
OSCC组织中CA9蛋白的表达高于癌旁组织(P<0.05),见图3。
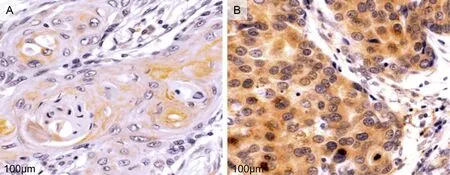
A为癌旁组织中CA9蛋白表达;B为OSCC组织中CA9蛋白的表达;CA9为碳酸酐酶9;OSCC为口腔鳞状细胞癌。图3 CA9蛋白在OSCC组织中高表达
2.4 CA9在OSCC组织中的表达与临床病理特征的相关性
根据免疫组化结果分为CA9低表达和高表达组,相关性分析结果表明,CA9的表达高低与淋巴结转移、临床分期相关(P<0.05),见表1。

表1 CA9在OSCC中的表达与患者临床病理特征的相关性
2.5 CA9高表达与OSCC预后不良有关
Kaplan-Meier生存分析表明,CA9高表达组OSCC患者的总生存率低于低表达组(P<0.05),见图4A。进一步分析CA9对OSCC预后的诊断价值,发现CA9高表达组中OSCC患者的总生存率、疾病特异性生存率均低于低表达组(P<0.05),见图4B、C,受试者工作特征曲线的曲线下面积为0.966(95% CI:0.945~0.986),见图4D,提示CA9高表达与OSCC预后不良有关,可能对OSCC有一定的诊断价值。淋巴结转移、组织分化程度、CA9表达水平与OSCC患者的总生存率有关,见表2,且淋巴结转移(HR=0.472,95% CI:0.294~0.756,P=0.012)、CA9表达水平(HR=5.269,95% CI:1.535~18.087,P=0.008)均是OSCC患者预后的独立预测因素(P<0.05)。
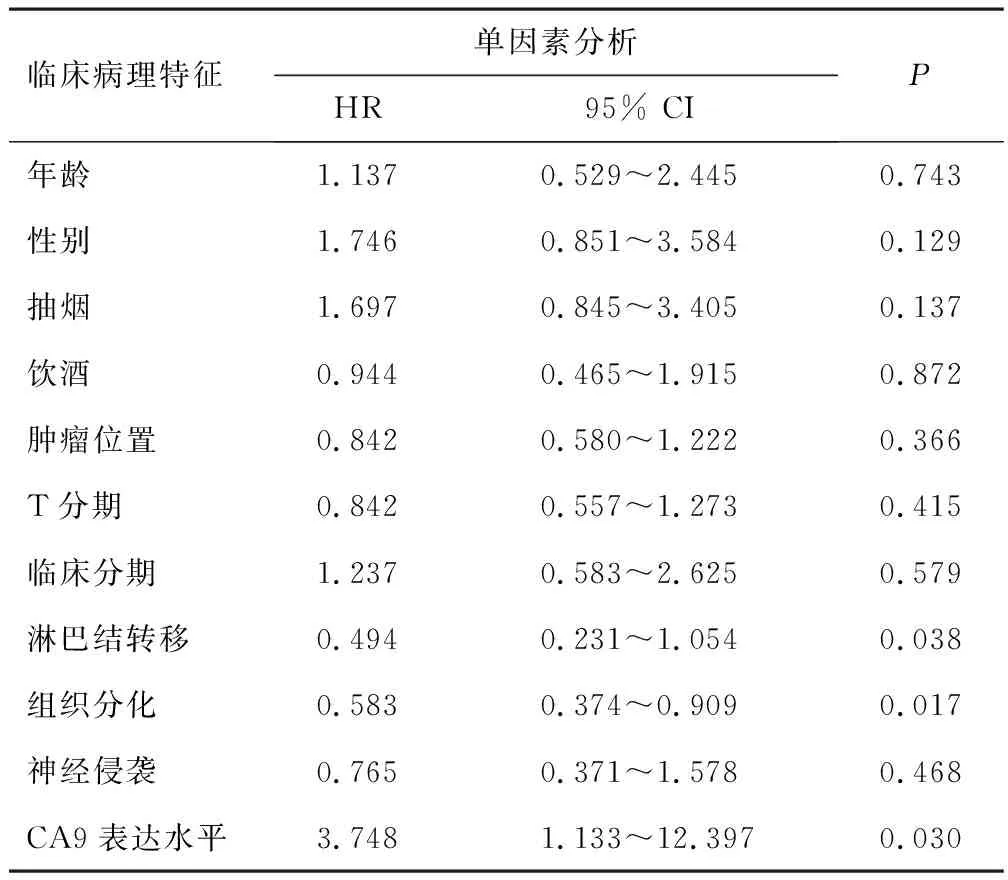
表2 OSCC患者预后影响因素的单因素和多因素分析

A为CA9高、低表达组中OSCC患者的总生存率;B为TCGA数据库中,CA9高、低表达组中OSCC患者的总生存率;C为TCGA数据库中,CA9高、低表达组OSCC患者的疾病特异性生存率;D为生存曲线。图4 CA9对OSCC的预后诊断价值
3 讨论
OSCC是一种发病率和病死率均较高的恶性肿瘤,早发现、早治疗对于提高OSCC患者的总生存率至关重要。近年来,靶向治疗在恶性肿瘤中逐渐广泛应用,在治疗乳腺癌、胃癌和结肠癌上均取得了较好的效果[13]。然而,针对OSCC的特异性生物标志物尚未发现,临床上针对OSCC的靶向治疗并不成熟。因此,寻找针对OSCC治疗、预后的生物标志物尤为重要。
检测恶性肿瘤与其配对癌旁正常组织中差异基因的表达对肿瘤标志物的发现具有重要意义。所以本课题组首先对TCGA数据库中OSCC的mRNA表达谱进行分析,发现CA9在OSCC组织中高表达。CA9作为碳酸酐酶家族成员之一,通常在肿瘤缺氧区域高表达,对细胞内pH值的调控发挥重要作用,使肿瘤细胞逃逸酸中毒,并可作为肿瘤细胞迁移、侵袭的驱动因子,促进恶性肿瘤的转移[14]。Alyaqubi等[15]研究表明CA9可作为急性白血病预后的潜在早期标志物。Mcdonald等[16]发现CA9可通过调节细胞pH值和糖酵解促进胰腺癌的生长。另一项研究表明,上调CA9可促进食管鳞状细胞癌的增殖和转移[17]。Hu等[18]研究发现CA9高表达与鼻窦鳞状细胞癌患者预后不良有关,可作为鼻窦鳞状细胞癌的独立预后标志物和治疗靶点。此外,CA9在膀胱癌[19]、结直肠癌[20]、肾癌[12]等恶性肿瘤中也表达失调。
然而,关于CA9在OSCC中的研究较少,本研究通过qRT-PCR、免疫组化检测了CA9在OSCC组织和癌旁组织中的表达,发现CA9在OSCC组织中的表达高于癌旁组织,证实了TCGA数据库的分析结果,这提示CA9可能促进OSCC的发生发展。进一步的相关性分析结果表明,CA9的表达水平与OSCC临床分期和淋巴结转移具有相关性。Kaplan-Meier生存分析显示,CA9高表达组OSCC患者的总生存期短于低表达组,表明CA9高表达与患者的不良预后相关。单因素分析结果表明OSCC预后与组织分化程度、淋巴结转移、CA9的表达有关,而多因素分析表明CA9的表达和淋巴结转移均是OSCC预后的独立预测因子。最后,利用TCGA数据库评估了CA9对OSCC的诊断价值,曲线下面积为0.966,表明CA9可能对OSCC具有一定的诊断意义。
4 结论
本研究结果表明CA9在OSCC中高表达,是OSCC的一个预后标志物,并且可能对OSCC具有一定的诊断意义。然而,本研究也有一定的局限性,并不清楚CA9是通过何种途径促进OSCC的,且纳入的研究对象较少,下一步可联合多中心大样本检测,开展更进一步的细胞生物学实验,探索CA9促进OSCC的相关分子机制。
