MEN1在消化系统肿瘤中的研究进展
2024-05-10凡浩然综述震审校
凡浩然综述 王 震审校
MEN1 基因为多发性内分泌腺肿瘤1型(multiple endocrine neoplasia type 1, MEN1)的易感基因,其在调节基因转录、维持基因稳定性、调控细胞分裂和增殖等方面起重要作用。人类MEN1基因定位于11q13染色体区域,跨越约9 kb,编码转录大小约为2.8 kb的mRNA,随后翻译为 Menin,其分子量为 67 ku。在细胞核中,Menin可以与染色质重塑因子(如组蛋白甲基转移酶、MLL1和MLL2或组蛋白去乙酰化酶结合来调节靶基因[1-2],也可与多种细胞因子(β-catenin、AP-1、JunD、NF-κB等)相互作用[3-6]。在以往的神经内分泌肿瘤研究中发现,Menin的表达水平降低可能导致基因表达过程异常或细胞增殖异常,从而诱使肿瘤的发生与发展。然而近来在非神经内分泌肿瘤中的研究发现,在不同的肿瘤类型中,MEN1发挥的作用不同,如在胰腺癌中MEN1基因为抑癌基因,而在肝癌中则为癌基因。现就近年来MEN1在消化系统肿瘤中的研究进展做一综述。
1 肝癌
1.1 MEN1在肝癌中的相关研究肝癌是指发生于肝脏或从肝脏开始的恶性肿瘤,原发性肝癌是全球癌症相关死亡的主要原因之一。关于MEN1基因在肝癌中的作用,诸多学者进行了探索。Xu et al[7]通过体内及体外实验发现,相较于癌旁组织,Menin在肝癌细胞中表达升高。在体外实验中,使用MEN1 shRNA转染肝癌细胞株,发现细胞的增殖和集落的形成均被抑制;在体内实验中,通过二乙基亚硝胺诱导小鼠肝癌发生,其中敲除了MEN1基因(MEN1+/-)的小鼠Menin表达减少,其肿瘤体积和质量显著下降,且肿瘤发生率较野生型低。同时发现Menin-MLL HMTase复合物在人类肝癌标本中被大量激活,并通过依赖H3K4me3的方式促进肝癌的发展。另有研究[8]显示,在肝癌细胞株中,Menin和增强子的齐式同源2(enhancer of zeste homolog 2, EZH2)共同占据潜在的肿瘤抑制子的启动子,两个转录活性有关的组蛋白修饰蛋白(H3K4me3和H3K79me3)在肝癌中同时被激活,Menin/MLL复合物催化了异常的H3K4me3甲基化,而H2K4的甲基化与肿瘤细胞的增殖有关。统计分析结果表明,EZH2和Menin过表达与肝细胞癌(hepatocellular carcinoma,HCC)患者的不良预后密切相关。
对于MEN1基因与肝癌的关系,有研究[7, 9-11]显示Menin与Yes关联蛋白1(Yes-associated protein 1,Yap1)基因的启动子位点上H3修饰的转录激活一致,即Menin与Yap1启动子结合从而上调Yap1的转录,而过度激活的Yap1可以与转录因子TEA域家族成员(TEAD)结合,启动下游基因的转录,使肿瘤细胞维持一种高度增殖的状态,从而促进肿瘤的发展。同样的,相关研究[7, 12]显示Menin在肝癌细胞中显著过表达,通过MI-503(一种Menin-MLL抑制剂)下调了父源性表达的10号基因(paternally expressed 10,PEG10)的表达,并取代PEG10基因启动子上的Menin-MLL复合物,导致H3K4甲基化减少和转录抑制,而这可能会通过Hippo信号通路抑制肝癌细胞的增殖、迁移和集落形成。
1.2 MEN1在肝癌中的生物信息学分析为了进一步探讨MEN1与肝癌的关系,笔者下载了癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库(https://www.cancer.gov/ccg/)的肝癌数据,通过R语言整理数据。使用R包(limma、ggplot2、ggpubr)进行分析,分析显示MEN1基因在肝癌组织中的表达量高于正常组织,且在同一样本中,癌组织的MEN1表达高于癌旁组织(P<0.05)(图1)。使用R包(limma、survival、survminer)进行生存分析,在肝癌人群中,MEN1高表达人群的总生存期和无进展生存期均低于低表达人群(P<0.05)(图2)。通过R包(survival、survminer、timeROC)绘制ROC曲线,得出通过MEN1基因的表达量预测患者1年、3年生存时间的AUC分别为0.698、0.625(图3),为中区分度。整理肝癌人群的MEN1表达水平、年龄、性别、肿瘤分级、肿瘤分期、T分期、N分期、M分期数据,使用R包(survival、regplot、rms)绘制列线图(图4),可以通过列线图预测患者的生存时间。列线图的校准曲线显示(图5),通过此列线图预测患者的1年生存期较为准确。使用R包(survival)进行独立预后分析,MEN1基因的表达量与患者的预后相关(P<0.05),且是高危险因素(HR>1)(图6)。
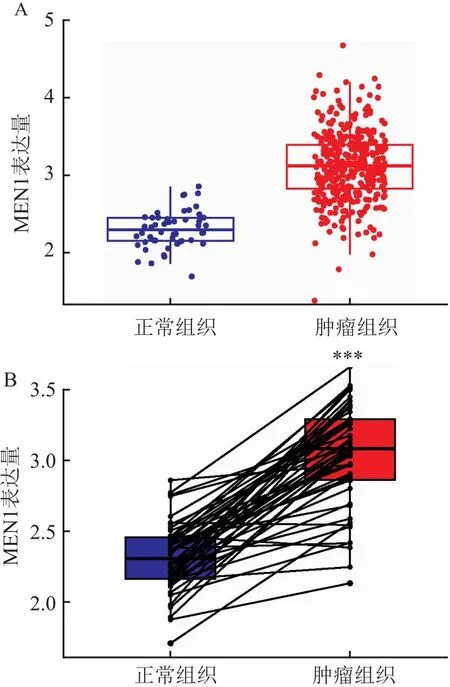
图1 MEN1基因表达差异分析

图2 总生存期及无进展生存期分析

图3 ROC曲线
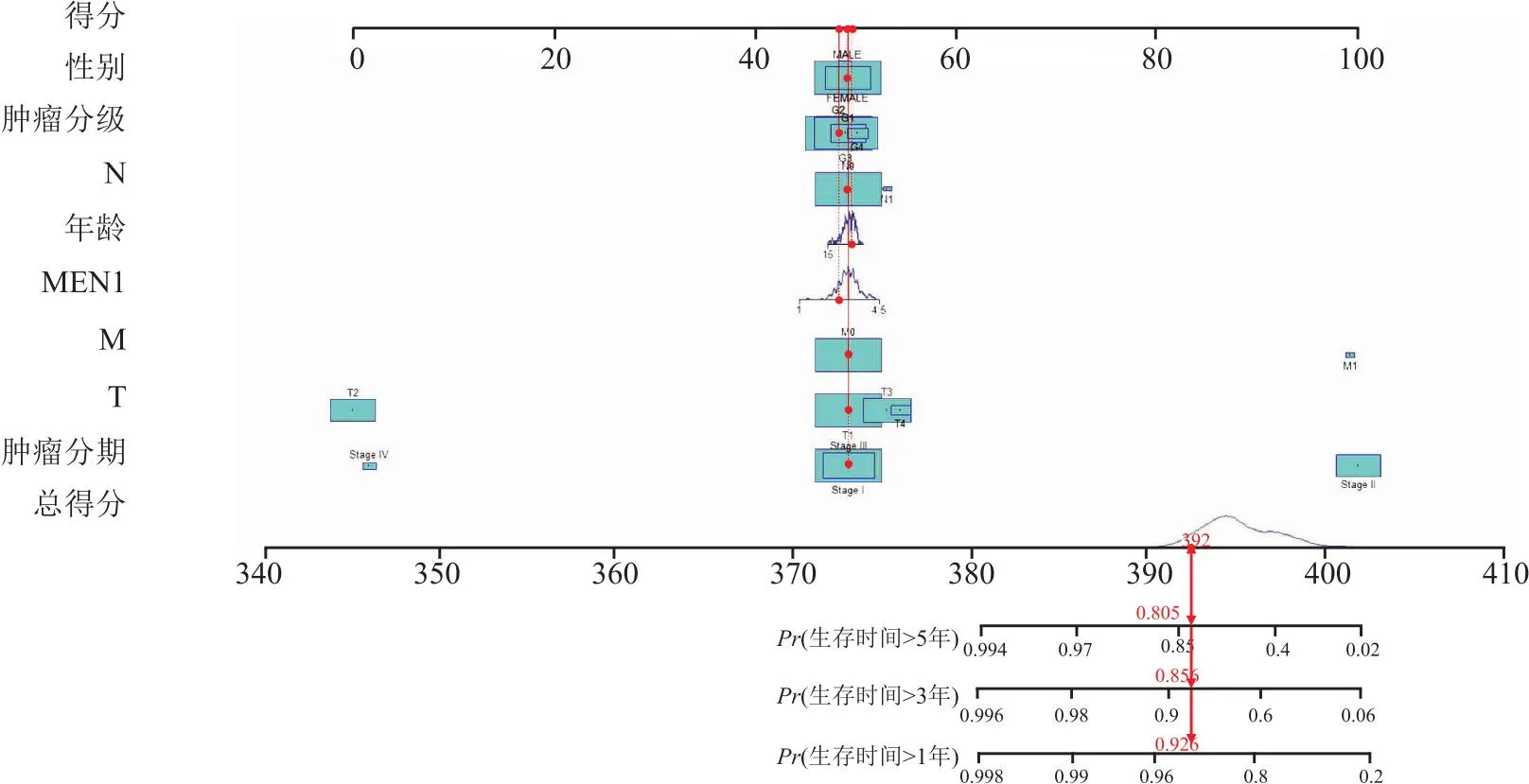
图4 列线图
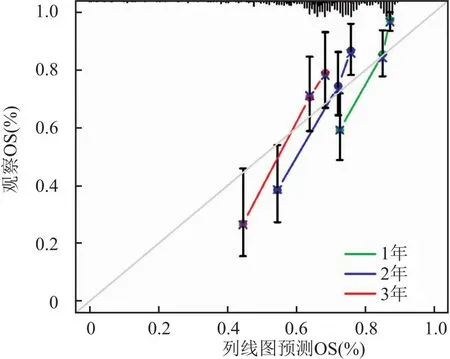
图5 列线图校准曲线

图6 独立预后分析
在肝癌的研究中,诸多研究结果显示MEN1起到促癌的作用,笔者通过生物信息学的方法,分析数据结果显示,MEN1在肝癌组织中高表达,且表达水平与肝癌患者的不良预后呈正相关。这进一步说明MEN1在肝癌中的癌基因属性。为更深入理解MEN1在肝癌中的具体作用,下一步应重点研究MEN1与其他肝癌相关的基因和蛋白质之间的相互作用,包括探究MEN1对细胞周期的影响、凋亡的调控作用以及血管新生等肿瘤生长的关键过程的影响。通过深入了解这些分子机制,有望揭示MEN1在肝癌发生和发展中的详细作用。并且MEN1基因的高表达可能成为肝癌患者不良预后的预测因子,为制定更精准的治疗策略提供重要线索。
2 胰腺癌
2.1 MEN1在胰腺癌中的相关研究胰腺癌是指胰腺细胞发生癌变而产生的肿瘤,胰腺的癌症可分为许多类型,最常见的是胰腺腺癌,占了85%,另外1%~2%的病例为来自神经内分泌细胞的神经内分泌肿瘤。MEN1基因在胰腺神经内分泌肿瘤中发挥重要作用,近来诸多学者又进一步探讨了MEN1在胰腺癌中的作用。DNA甲基转移酶1(Dnmt1)作为参与DNA甲基化表达的一种关键酶,参与了从癌前阶段到导管癌恶性进展的多阶段胰腺癌的发生[13],是胰腺癌中同Menin相互作用的一个重要蛋白,也是Hedgehog信号通路的下游分子,而Hedgehog信号通路激活可以促进胰腺癌细胞的增殖[14-15]。研究[16-18]表明,在细胞的体外及体内实验中,Menin过表达会显著抑制胰腺细胞的生长,而Menin低水平时会促进胰腺细胞的增殖。具体机制为过表达Menin会与Dnmt1相互竞争,降低Dnmt1对p18和p27启动子的富集量,降低p18和p27的DNA甲基化水平,从而上调了p18和p27的表达,而p18可以抑制CDK4和CDK6,p27可以抑制CDK2和CDK4,即Menin可以通过抑制细胞周期蛋白激酶(CDKs),从而抑制胰腺癌细胞的生长。在蛋白水平方面,Cheng et al[16]的研究结果显示Menin 在胰腺癌的癌组织中表达水平远低于癌旁组织。表明MEN1在胰腺癌中具有抑癌基因的潜在属性。
Wasylishen et al[19]的胰腺外分泌稳态实验结果显示,在构建胰腺炎模型后,MEN1缺失会导致胰腺组织的损伤增加和再生能力受损,并导致细胞角蛋白19(cytokeratin 19, CK19)阳性表达及增加免疫细胞的浸润。同时与突变型Kras基因协作[19],而突变型Kras蛋白可能会导致异常的细胞信号传导,促使细胞无节制地生长和分裂,从而促进胰腺肿瘤的发展[20-21]。
相关研究[22-24]结果显示Menin过表达通过组蛋白去乙酰化抑制CCAAT/增强子结合蛋白质β(CEBPB)和上皮特异性基因的表达,从而增强转化生长因子-β(TGF-β)诱导的上皮细胞-间充质转化(epithelial-mesenchymal transition, EMT)过程,最终促进胰腺癌的增殖与转移。然而,如果过表达CCAAT/增强子结合蛋白β(C/EBPβ,由CEBPB基因编码)则会使TGF-β诱导的EMT过程下调,同时增强Menin对癌细胞的生长抑制作用,即抑制癌细胞的生长。同时,将Menin及C/EBPβ共过表达则会对肿瘤细胞产生更强的抑制作用。即Menin在不同的环境下对癌细胞表现出不同的作用,其中的关键可能在于C/EBPβ在细胞中的含量[24],而验证这一现象则需要进一步研究探讨。
2.2 MEN1在胰腺癌中的生物信息学分析同样,笔者也下载了TCGA数据库(https://www.cancer.gov/ccg/)的胰腺癌数据,通过R语言整理数据。使用R包(limma、ggplot2、ggpubr)进行分析,分析显示MEN1基因在胰腺癌组织与正常组织中的表达量差异无统计学意义(P>0.05), 且在同一样本中癌组织与癌旁组织的MEN1表达量差异无统计学意义(P>0.05)(图7)。使用R包(limma、survival、survminer)进行生存分析,在胰腺癌人群中,MEN1高表达人群和低表达人群的总生存期和无进展生存期差异无统计学意义(P>0.05)(图8)。通过R包(survival、survminer、timeROC)绘制ROC曲线,得出通过MEN1基因的表达量预测患者1年、3年、5年生存时间的AUC分别为0.508、0.424、0.160(图9),均为低区分度,准确性低。整理胃癌人群的MEN1表达水平、年龄、性别、肿瘤分级、肿瘤分期、T分期、N分期数据,使用R包(survival、regplot、rms)绘制列线图(图10),可以通过列线图预测患者的生存时间。列线图的校准曲线显示(图11),通过此列线图预测患者的1年生存期较为准确。使用R包(survival)进行独立预后分析,MEN1基因的表达量与患者的预后并不相关(P>0.05)(图12)。
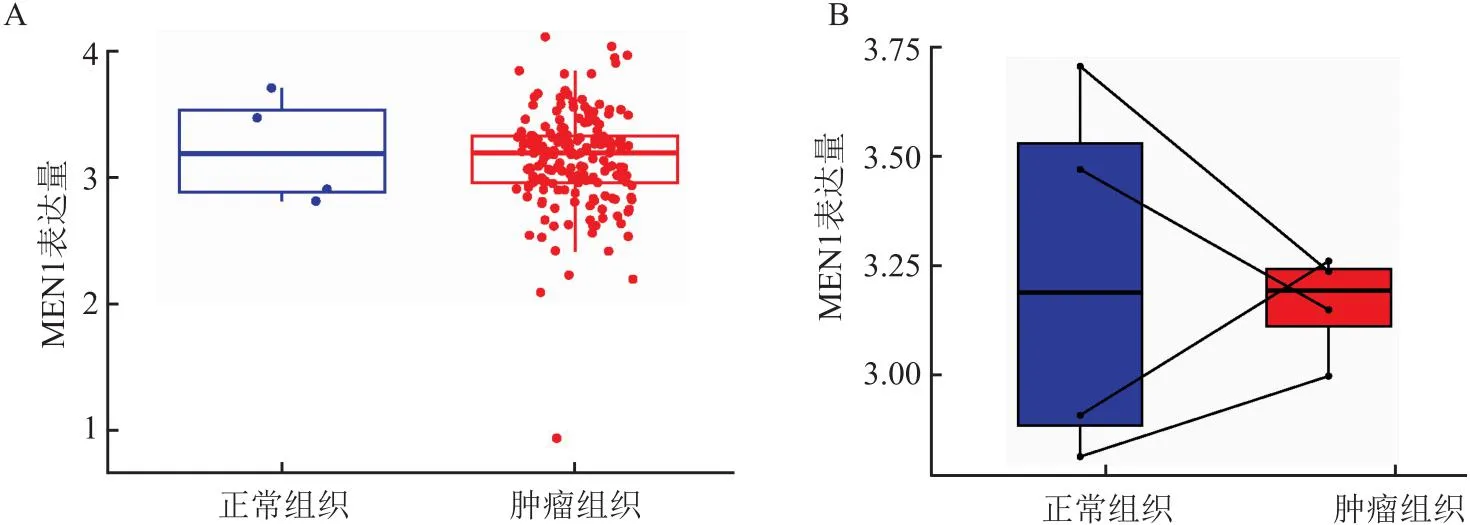
图7 MEN1基因表达差异分析

图8 总生存期及无进展生存期分析

图9 ROC曲线
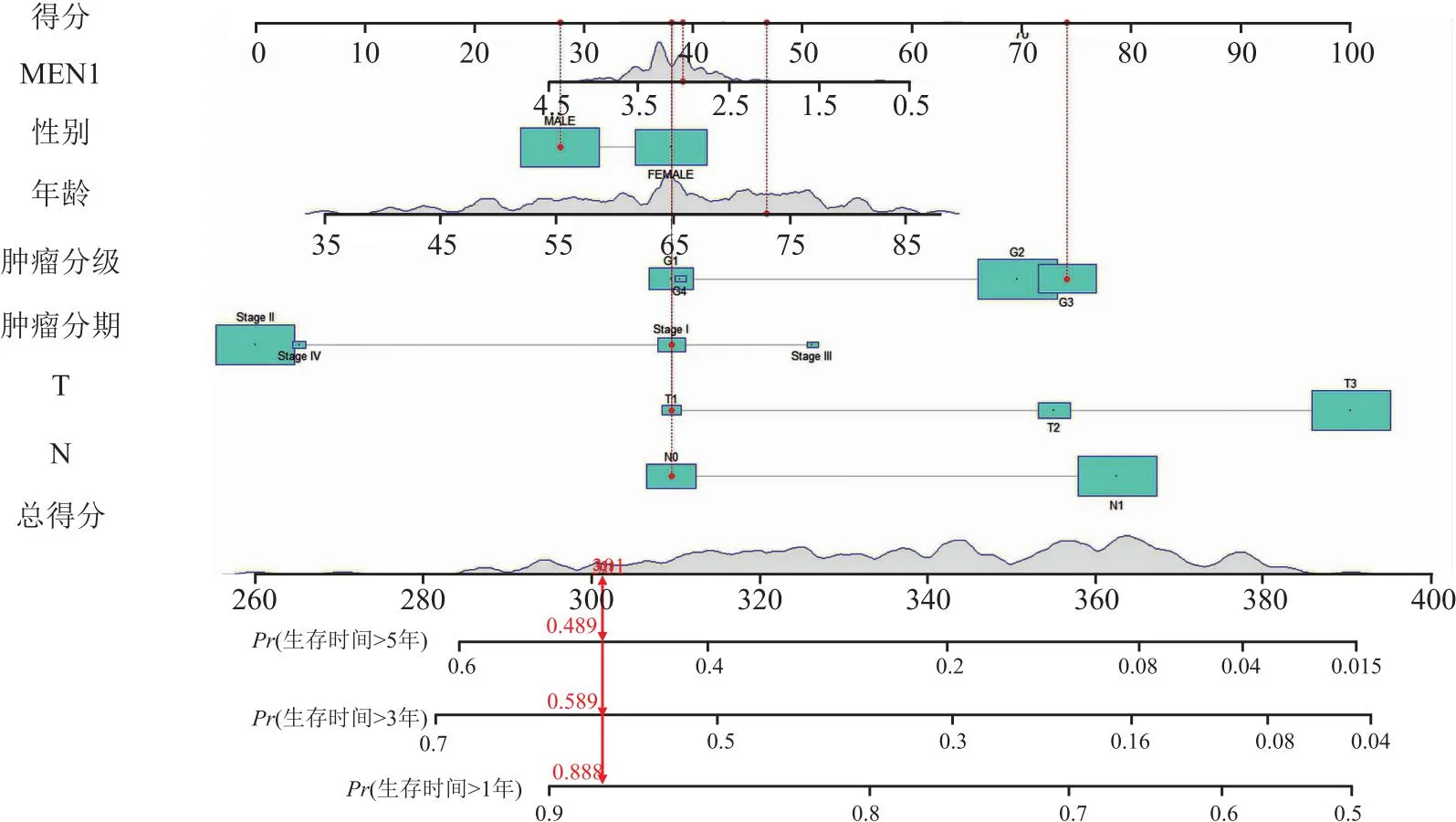
图10 列线图
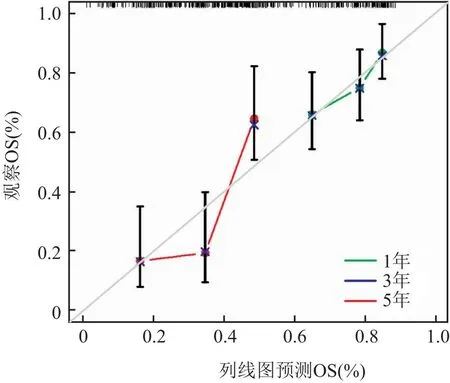
图11 列线图校准曲线
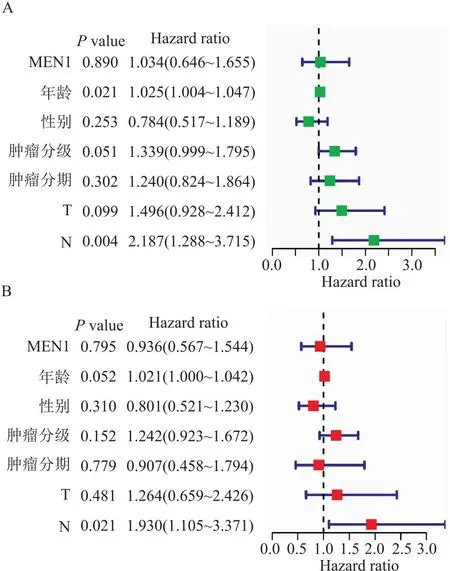
图12 独立预后分析
通过相关实验及数据分析提示,MEN1在胰腺癌组织与癌旁正常组织中的表达无明显差异,Cheng et al[24]的研究展示了MEN1基因在非神经内分泌肿瘤中作用机制的复杂性和不统一性,提示在进行相关研究时可以进行分阶段研究,在肿瘤的不同发展时期,MEN1基因的作用可能不同,因为其作用可能受到多种因素的影响。研究者应该探索MEN1基因在胰腺癌中的调控网络,包括可能的上下游调控因子和与其互作的蛋白质。这种分阶段的研究设计有助于更精细地理解MEN1基因的生物学功能,并为肿瘤发展的动态变化提供更准确的解释。
3 结直肠癌
3.1 MEN1在结直肠癌中的相关研究结直肠癌(colorectal cancer,CRC)为源自结肠或直肠(为大肠的一部分)的癌症,关于结直肠癌发病机制的研究已有了较大的进展,然而MEN1基因在结直肠癌中的作用仍是未知的。Zeng et al[25]偶然发现MEN1基因在结直肠癌中起抑制作用,实验显示在结直肠癌细胞处于低氧环境时,低氧诱导因子1α(hypoxia-inducible factor 1α,HIF1α)被激活,HIF1α与CUL1的启动子结合,从而促进CUL1在结直肠癌细胞中的表达。过表达的CUL1可以在结直肠癌细胞中与环盒蛋白1(RING-box protein 1, RBX1)、S期激酶相关蛋白1(S-phase kinase associated protein 1, Skp1)及F-box/LRR重复蛋白1(F-box/LRR-repeat protein 1, FBXL1)偶联形成SCFFBXL1E3连接酶,有44个候选蛋白可以通过FBXL1被共沉淀下来,而Menin就在其中,同时通过免疫印迹实验验证了Menin确实会被FBXL1下调。 在 Zeng et al[25]的实验标本中,三对原发结直肠癌细胞的MEN1蛋白显著下降,并且 Zeng et al[25]在HT29细胞(结直肠癌细胞的一种细胞株)中过表达MEN1蛋白会抑制肿瘤细胞的增殖。虽然MEN1在结直肠癌中的作用是偶然发现的,但这也提示MEN1或许可以成为结直肠癌治疗的潜在靶点。
不同于Zeng et al[25]的研究发现,有研究者对结直肠癌组织及正常组织进行免疫组化检测显示:相较于正常的结直肠上皮细胞,70%癌标本组织中的Menin表达升高,并且Menin可以结合Skp2的启动子并促进Skp2的表达,敲除MEN1则会导致Skp2的水平下降,而Skp2已被证明是结直肠癌的癌基因[26-27],即过表达的Menin可以促进结直肠癌细胞的增殖[28]。而后进一步对其机制进行研究发现,Menin可以通过一种与哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)无关的机制来抑制CRC细胞的糖酵解,即抑制Menin可以促进CRC细胞的糖酵解,并增强CRC细胞对表皮生长因子受体抑制剂(epidermal growth factor receptor inhibitor, iEGFR)的敏感性,进而增强iEGFR诱导的CRC自噬。即Menin抑制剂(MI)和iEGFR联合应用会导致CRC细胞的自噬诱导增加[29]。
3.2 MEN1在结直肠癌中的生物信息学分析笔者也下载了TCGA数据库(https://www.cancer.gov/ccg/)的结直肠癌数据,通过R语言整理数据。使用R包(limma、ggplot2、ggpubr)进行分析,分析显示MEN1基因在结直肠癌组织中的表达量高于正常组织中的表达量,且在同一样本的癌组织中MEN1表达高于癌旁组织(P<0.05)(图13)。使用R包(limma、survival、survminer)进行生存分析,在结直肠癌人群中MEN1高表达人群和低表达人群的总生存期和无进展生存期无明显差异(P>0.05)(图14)。通过R包(survival、survminer、timeROC)绘制ROC曲线,得出通过MEN1基因的表达量预测患者1年、3年、5年生存时间的AUC分别为0.565、0.553、0.521(图15),均为低区分度,准确性低。整理结直肠癌人群的MEN1表达水平、年龄、性别、肿瘤分级、T分期、N分期数据,使用R包(survival、regplot、rms)绘制列线图(图16),可以通过列线图去预测患者的生存时间。列线图的校准曲线显示(图17)可以通过此列线图去预测患者的1年、3年、5年的生存期。使用R包(survival)进行独立预后分析,MEN1基因的表达量与患者的预后相关(P<0.05),且是高危险因素(HR>1)(图18B)。
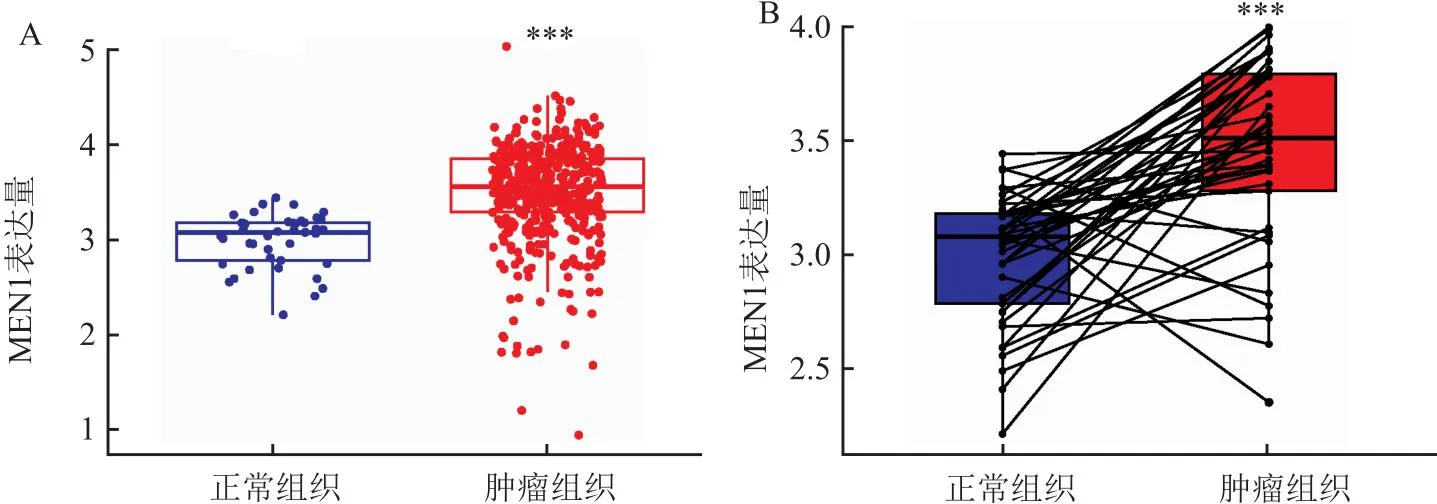
图13 MEN1基因表达差异分析

图14 总生存期及无进展生存期分析

图15 ROC曲线
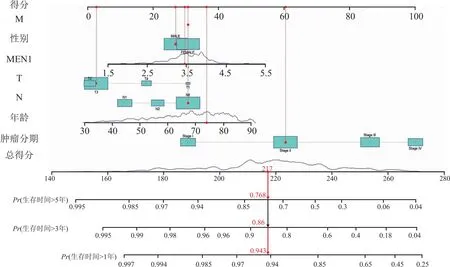
图16 列线图
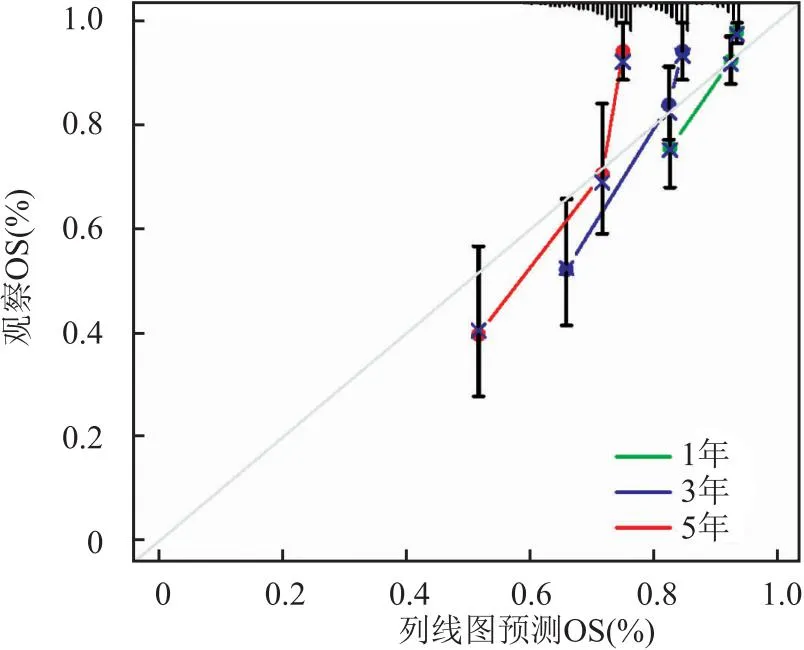
图17 列线图校准曲线
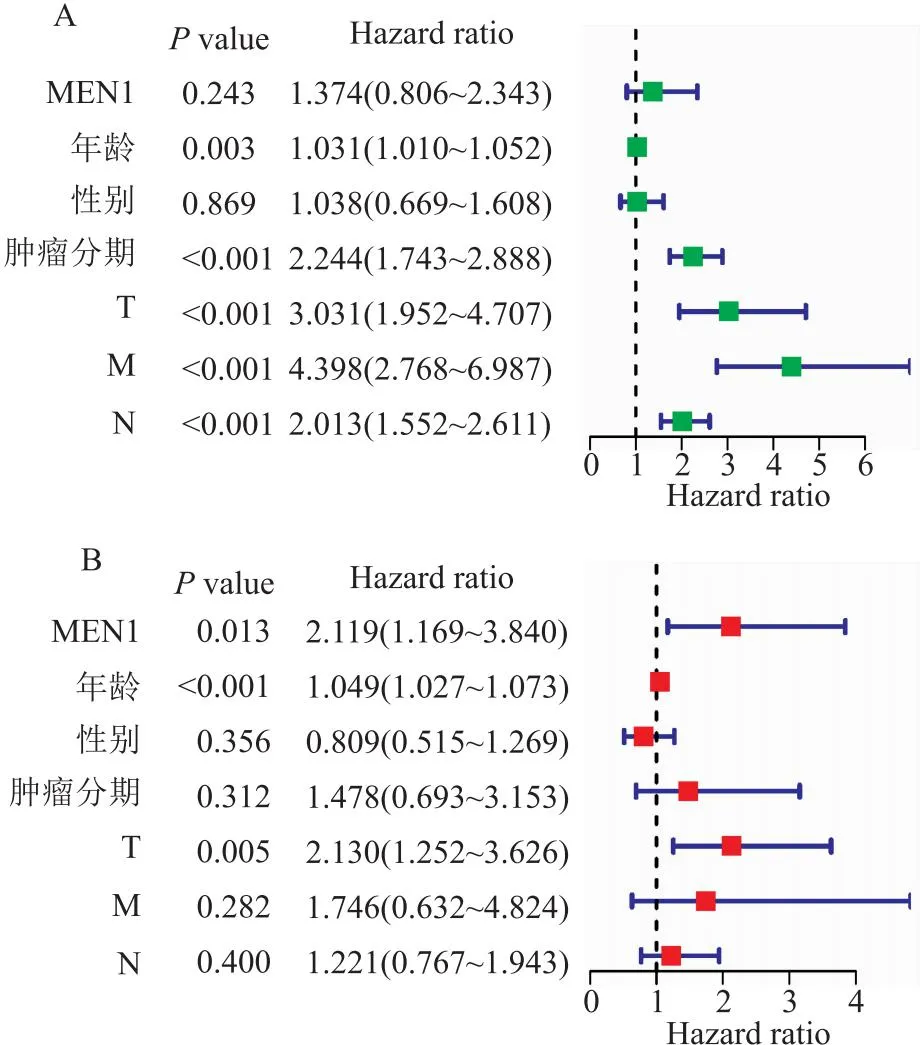
图18 独立预后分析
目前对于MEN1基因在结直肠癌中的作用仍存在一定的不明确性,但初步的研究结果说明MEN1与结直肠癌存在关联。相关研究表明Menin在癌组织中表达升高[28],而笔者通过数据分析也显示MEN1基因在结直肠癌组织中高表达,且与患者的预后相关,这与研究的初步结果相一致。这提示MEN1基因可能成为结直肠癌研究中的一个重要靶点,一些传统的肿瘤治疗药物(如吉非替尼)或许可以通过靶向MEN1在结直肠癌中发挥抗癌作用[25, 28-29],这为开发新的治疗策略提供了一个有前景的方向。进一步的研究可以探索MEN1在结直肠癌中的确切作用机制,包括其对细胞增殖、凋亡、侵袭和转移等生物学过程的影响。此外,通过深入了解MEN1在结直肠癌中的分子调控网络,可以寻找潜在的靶向治疗手段,以更精准地干预癌细胞的异常生长。
4 食管癌及胃癌
4.1 MEN1在食管癌中的相关研究食管癌是发生在食管上皮组织的恶性肿瘤,食管癌包括多种病理类型,其中鳞状细胞癌最为常见。Sun et al[30]基于癌症驱动基因的定制蛋白质芯片和ELISA实验,确定了10种与食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)诊断有关的自身抗体,其中就包含MEN1,MEN1在ESCC组的自身抗体表达水平高于对照组(正常人群),即在ESCC中MEN1水平上调,侧面反映MEN1基因在ESCC中表现为促癌基因。当MEN1作为单一自身抗体对ESCC检测的诊断时,其特异性达到了85.4%,但灵敏度仅有33.8%,遗憾的是,该研究并未用直接的方法检测MEN1在食管癌中的表达水平。
4.2 MEN1在胃癌中的相关研究胃癌(gastric cancer, GC)是发生在胃部黏膜的癌症,在世界范围内,胃癌是癌症致病原因第五名,并且在癌症致死率
排名中为第三名。目前对于MEN1基因在胃癌中的作用仅有初步研究。Machlowska et al[31]对收集的胃癌标本进行高通量测序,结果显示在35例早发型胃癌标本(指发病年龄≤45岁的个体)中,MEN1基因均有错义突变;在18例常规胃癌标本(指发病年龄>45岁的个体)中,有82.4%的标本中MEN1基因有错义突变。这些数据说明MEN1突变可能在胃癌中发挥重要作用,但仍需进一步的研究验证,并探讨其深入的机制。笔者的团队前期研究发现胃癌组织中MEN1突变率达3.1%,部分胃癌组织中Menin表达异常。不同突变型MEN1过表达质粒对胃癌细胞生物学行为及Menin表达水平的影响不一,碳苄-L亮氨酰-L亮氨酰-L亮氨酸(carbobenzoxy-L-leucyl-L-leucyl-L-leucinal, MG132)能逆转这一现象。据此推测MEN1突变通过促进Menin降解参与胃癌的发生发展进程。笔者的团队通过蛋白印迹实验对胃癌组织及癌旁组织比较发现,在大多数病例中,MEN1在癌旁组织中高表达。而后笔者的团队分别对胃癌细胞株进行沉默和过表达MEN1,结果发现沉默株的癌细胞迁移侵袭能力均有增强,过表达株的胃癌细胞迁移侵袭能力减弱,这说明MEN1在胃癌中可能为抑癌基因[32]。Ren et al[33]也得到了相似的实验结果,即胃癌组织中的Menin表达明显低于癌旁组织。此研究的另一研究对象,含IQ基元GTP酶激活蛋白1(IQ motif containing GTPase activating protein1,IQGAP1)则在胃癌组织中高表达。已有多项研究表明,IQGAP1通过多种转导通路在胰腺癌[34]、胃癌[35]、结肠癌[36]等多种肿瘤的发生及进展中发挥作用。而后Ren et al[33]对胃癌细胞株分别过表达及沉默Menin及IQGAP1,结果显示IQGAP1过表达会促进胃癌细胞的增殖,而IQGAP1表达沉默则会抑制胃癌细胞的增殖;而Menin过表达会抑制胃癌细胞增殖,且这种抑制是通过抑制IQGAP1的表达来实现的。然而笔者的团队进一步研究发现,Menin可以通过HSPA6/JNK通路促进胃癌转移;Menin抑制剂MI-503在转录后水平下调Menin的表达,并抑制胃癌进展。上述的实验结果并不统一,对于MEN1基因影响胃癌进展的具体机制仍需进一步探索。
通过生物信息数据分析,笔者观察到在食管癌和胃癌组织中MEN1基因均高表达。目前,对于MEN1在胃泌素瘤中的研究表明其具有抑癌作用,相关机制研究也相对成熟[37-40],这为探究MEN1在胃癌中的作用机制提供了有益的参考。从相关文献[31]的胃癌标本分析显示,大多数标本中的MEN1基因存在错义突变,后续研究可以通过分析MEN1基因位点的突变类型和突变量来深入了解MEN1在食管癌和胃癌中的作用。此外,利用小鼠等动物模型进行实验,模拟MEN1基因缺陷的情况,将有助于进一步验证MEN1基因与食管癌和胃癌的关系,并深入研究MEN1基因对这两种癌症的调节机制。这样的综合研究策略将为揭示MEN1在食管癌和胃癌中的作用提供更深入的了解。
5 展望
MEN1基因在调控细胞生长、分化以及维持基因稳定性等方面发挥着重要作用。早期的研究主要关注其在神经内分泌肿瘤中的功能,但近年的研究表明,MEN1基因在消化系统肿瘤中同样具有重要作用。尽管目前对于MEN1基因在这些肿瘤中的作用机制还存在许多未知,但越来越多的研究表明,MEN1基因在消化系统肿瘤的发生和发展中起到不可忽视的作用。例如,MEN1基因的突变可能导致肿瘤的发生和发展,而MEN1基因的调控与多种信号通路有关。因此,深入研究MEN1基因在消化系统肿瘤中的作用机制对于肿瘤的诊断和治疗具有重要意义。
此外,MEN1基因在消化系统肿瘤中的深入研究还可能揭示不同亚型或分子亚群之间的差异,有助于制定个体化治疗策略。对MEN1基因的具体调控机制的理解将为开发针对其作用点的靶向治疗提供理论基础,为患者提供更为精准和有效的治疗选择。研究MEN1基因在消化系统肿瘤中的重要性也为未来临床实践提供了新的方向。通过检测患者是否存在MEN1基因的突变或异常表达,可以更好地评估患者患病的风险,并为个性化的治疗方案提供依据。这样的方法有望提高治疗的针对性和患者的整体预后。
总体而言,深入研究MEN1基因在消化系统肿瘤中的作用机制具有重要的科学和临床意义。这一研究方向不仅丰富了对肿瘤生物学的认识,也为未来的肿瘤治疗和预防策略提供了有益的启示。通过整合基础科学研究和临床实践,有望取得更多关于MEN1基因在消化系统肿瘤中的精细化调控机制和治疗应用的重要突破。
