王不留行黄酮苷通过抑制铁死亡减轻阿米卡星导致的肾小管上皮细胞损伤
2024-05-10储超群黄申卓凡温家根
郑 松,储超群,岳 琳,黄申卓凡,温家根
阿米卡星(amikacin,AKN)是第三代氨基糖苷类抗生素,可用于敏感细菌感染的治疗,其对革兰阴性菌效果较好。此外,AKN对耐药结核杆菌具有较好的杀伤作用,但是其在临床应用时会导致明显的肾毒性和耳毒性。有研究[1]显示AKN可以通过氧化应激和炎症反应引起肾脏损伤。AKN在肾组织中积累显著,并可以与线粒体发生作用,促使线粒体发生功能障碍,同时增加肾脏组织中氧自由基的产生,使得细胞内出现氧化性损伤[1],并最终导致细胞凋亡及炎症性死亡[2]。因此,抗氧化药物的应用可以减轻AKN等氨基糖苷类药物的肾毒性,如鞣花酸、西洛他唑、β-石竹烯[2-3]等。本课题组前期研究[4-5]建立了庆大霉素的肾小管上皮细胞损伤模型,研究了绿茶多酚对庆大霉素肾毒性的保护作用,发现绿茶多酚可以通过激动Keap1-Nrf2信号发挥抗氧化作用,减轻庆大霉素肾毒性导致的肾小管上皮细胞的凋亡和铁死亡。然而,关于AKN的体外肾损伤模型研究较少,故本研究建立了AKN体外肾小管细胞损伤模型,探讨黄酮苷类化合物王不留行黄酮苷(vaccarin,VA)对肾小管细胞损伤的作用。
1 材料与方法
1.1 主要试剂和仪器HK-2细胞购自中国科学院细胞库。VA购自美国MedChemExpress有限公司;AKN购自河南辅仁怀庆堂制药有限公司;庆大霉素购自瑞阳制药有限公司;抗溶质载体蛋白家族47成员11(solute carrier family 7 member 11, SLC7A11)抗体、抗谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)抗体和抗β-actin抗体均购自武汉三鹰生物技术有限公司;DMEM/F-12细胞培养基购自美国GE医疗科技有限公司Hyclone实验室;TRIzol和2×SYBR Green Pro Taq HS Premix试剂购自湖南艾科瑞生物科技有限公司;HiScript III 1st Strand cDNA Synthesis试剂盒购自南京诺唯赞生物科技股份有限公司;丙二醛(malondialdehyde,MDA)和谷胱甘肽(glutathione,GSH)检测试剂盒购自南京建成生物工程研究所;二氢乙锭(dihydroethidium, DHE)探针购自上海碧云天生物技术有限公司。SpectraMaxi 3x多功能酶标仪购自美国美谷分子仪器公司;CFX Connect实时荧光定量PCR仪和ChemiDoc MP化学发光成像仪购自美国伯乐公司;DMi8倒置荧光显微镜购自德国徕卡公司。Nanodrop 2000超微量分光光度计购自美国赛默飞世尔科技公司
1.2 细胞培养HK-2细胞用含有10%胎牛血清的DMEM/F-12 培养,在37 ℃、5%CO2的恒温培养箱中培养。待细胞长满,胰酶消化制成细胞悬液,接种于96孔板或6孔板,过夜培养,当细胞汇合率达到80%,加入含药物的培养基进行孵育。MTT实验使用96孔板进行,在药物孵育达到预定时间进行,每孔中加入MMT试剂(与培养基的比例1 ∶10),继续在培养箱中孵育4 h,最后弃去培养基,每孔加入100 μmol/L DMSO,37 ℃摇床中孵育30 min,酶标仪检测490 nm吸光度值。
1.3 细胞内MDA和GSH水平检测HK-2细胞接种于6孔板,加药刺激结束后,PBS洗涤2次,使用细胞刮刀刮取各组细胞,超声破碎仪制备细胞裂解液。按试剂盒说明分别检测细胞内GSH和MDA含量。
1.4 RT-qPCR检测KIM-1和NGAL的mRNA水平采用TRIzol提取HK2细胞的总RNA,测定RNA浓度,使用HiScript Ⅲ 1st Strand cDNA Synthesis Kit试剂盒将1 μg的总RNA逆转录成cDNA。在反应体系中分别加入:1 μl上、下游引物(表1),5 μl 2×SYBR Green Pro Taq HS Premix和3 μl cDNA模板。采用实时荧光定量PCR仪对KIM-1、NGAL和β-actin的mRNA水平进行定量。热循环(40个循环)条件为:95 °C变性20 s, 58 ℃退火20 s, 72 ℃延伸20 s。β-actin用于KIM-1、NGAL的mRNA相对比值的归一化。

表1 引物序列
1.5 Western blot检测HK-2细胞蛋白的表达水平使用含有PMSF(1 ∶100)的RIPA缓冲液从细胞中提取蛋白质样品,用10%或12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,然后转印到PVDF膜上。随后,将转印后的膜与5%的脱脂牛奶(TBS配制)孵育1 h,孵育结束后分别与抗SLC7A11抗体(1 ∶1 000)、抗GPX4抗体(1 ∶1 000)、抗β-actin抗体(1 ∶5 000)4 ℃过夜孵育。次日弃去一抗,使用TBST洗涤,再加入HRP标记的山羊抗兔或抗小鼠二抗(1∶5 000)室温孵育1 h。最后,在膜上滴加ECL化学发光试剂使用化学发光成像仪进行显影,Image J软件分析各条带灰度值。
1.6 DHE荧光探针分析HK-2细胞接种于6孔板,加药处理后,PBS洗涤2次,使用含有2 μmol/L的DHE探针的培养基和细胞37 ℃孵育30 min进行荧光探针装载,随后PBS洗涤2次后加入不含药物的培养基,荧光倒置显微镜检测各视野中细胞红色荧光的强度,Image J软件分析荧光强度。
1.7 统计学处理采用GraphPad Prism 5软件(GraphPad, La Jolla, CA, USA)进行绘图。所有计量资料以平均值±SEM表示。多组数据的比较采用单因素方差分析(ANOVA)及两两比较的Tukey检验,P<0.05认为差异有统计学意义。
2 结果
2.1 建立HK-2细胞体外损伤模型采用不同浓度的AKN(1、2、4、8、16、32 mmol/L)体外刺激HK-2细胞24 h,MTT检测结果见图1A,各组间差异有统计学意义(F=127.5),AKN对HK-2细胞的半数抑制浓度(half maximal inhibitory concentration, IC50)为(5.74 ± 0.47) mmol/L,低于1 mmol/L的浓度对细胞活力影响较小(图1A),后续选择4 mmol/L AKN进行药物刺激。此外,与对照组相比,100 μmol/L及以下浓度的VA使得HK-2的细胞活力显著降低(P<0.001,F=38.75),见图1B。当VA与AKN(4 mmol/L)同时处理时,25~100 μmol/L的VA和AKN共处理组细胞活力显著高于AKN组(P<0.05,F=22.07),见图1C;且25~100 μmol/L的VA与AKN(3 mmol/L)同时处理后,HK-2的细胞活力也显著高于AKN(3 mmol/L)单独处理组(P<0.01,F=31.94),见图1D。AKN(4 mmol/L)处理后KIM-1的mRNA表达水平显著高于NC组,差异有统计学意义(P<0.001,F=30.95),VA(50 μmol/L)与AKN共处理组(VA+AKN)的KIM-1显著低于AKN组(P<0.01,F=30.95),见图1E。AKN(4 mmol/L)处理后NGAL的mRNA表达水平显著高于NC组,差异有统计学意义(P<0.001,F=21.43),VA+AKN组的NGAL显著低于AKN组(P<0.05,F=21.43),见图1F。

图1 VA减轻氨基糖苷类抗生素导致的肾小管上皮细胞的损伤
此外,以4 mmol/L的AKN分别处理0、3、6、12、24 h,检查细胞氧化应激水平,3 h DHE染色强度开始升高但差异无统计学意义,6 h DHE染色强度显著大于0 h组(P<0.01,F=25.83),12 h染色强度达到最大(P<0.001,F=25.83),见图2A。此外,与0 h组相比,3、6、12、24 h组MDA水平显著上升(P<0.05,F=61.14),见图2B;与0 h组相比,3、6、12、24 h组GSH水平显著下降(P<0.001,F=72.49),见图2C。
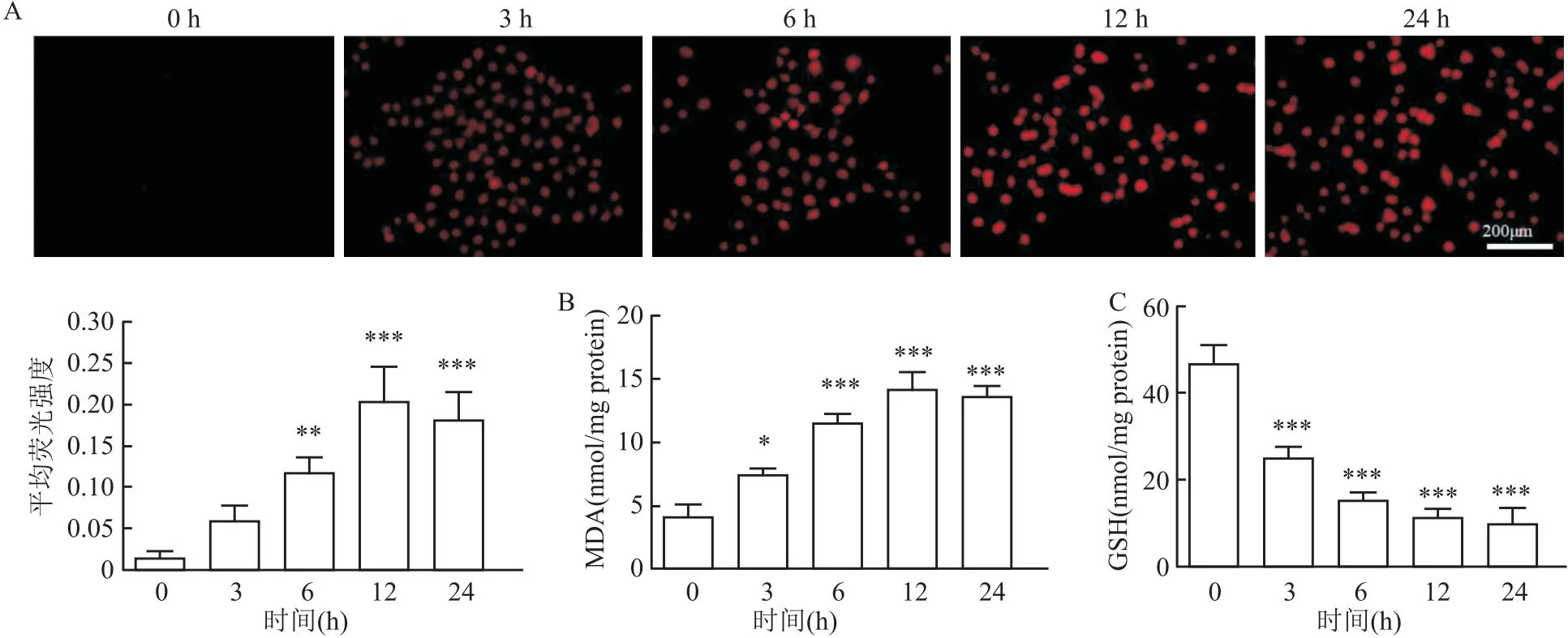
图2 AKN导致细胞氧化应激水平的变化
2.2 AKN导致HK-2细胞发生铁死亡采用4 mmol/L AKN刺激HK-2细胞,与0 h组相比,6、12、24 h组铁死亡相关蛋白SLC7A11(F=125.35)和GPX4(F=92.71)均明显下降(P<0.001),3 h组与0 h组差异无统计学意义,12 h组与24 h组差异也无统计学意义。见图3。
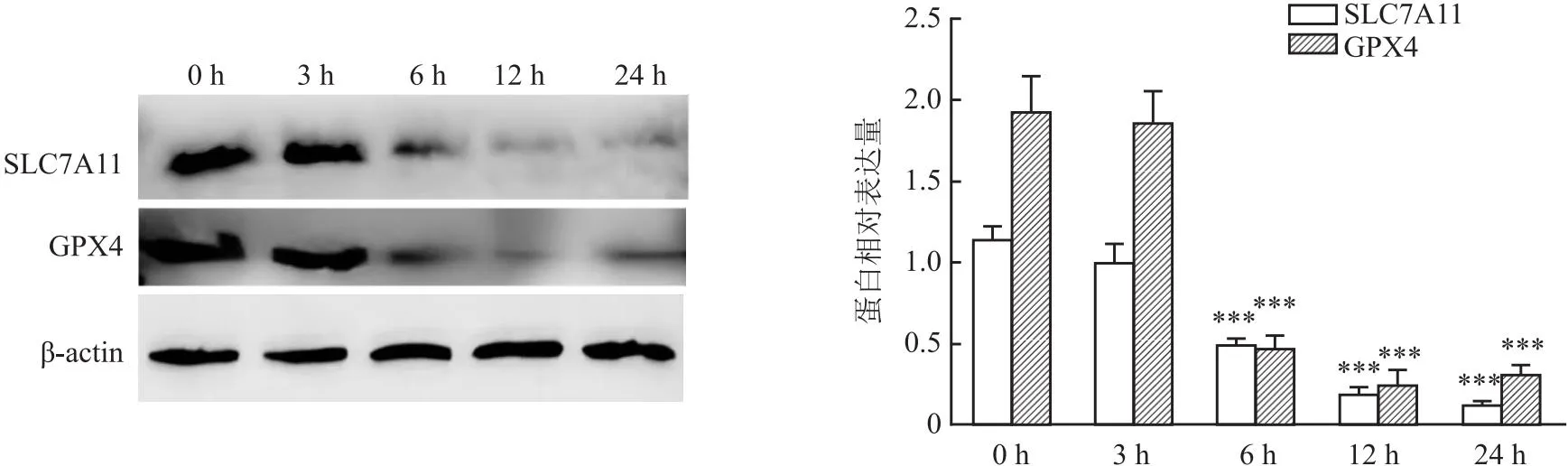
图3 AKN导致SLC7A11和GPX4蛋白水平的变化
2.3 VA改善HK-2细胞的死亡及氧化应激根据细胞活力检测结果,选择50 μmol/L浓度VA进行后续实验。通过显微镜观察,VA处理可以提高视野中细胞的数量及细胞的完整性,见图4A。AKN处理可以使得细胞DHE染色荧光升高,见图4B;MDA水平从(3.57±0.36) nmol/mg protein(NC组)升高至(13.37±0.63) nmol/mg protein(AKN组),见图4C;GSH水平从(42.27±1.76) nmol/mg protein(NC组)下降至(15.30±1.31) nmol/mg protein(AKN组),见图4D。VA+AKN组DHE荧光强度显著低于AKN组(P<0.001,F=150.0);VA+AKN组MDA[(6.40±0.67) nmol/mg protein]显著低于AKN组(P<0.001,F=72.343);VA+AKN组GSH[(33.76±2.53) nmol/mg protein]显著高于AKN组(P<0.01,F=32.925)。
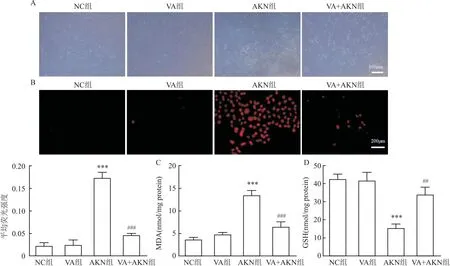
图4 VA对HK-2的保护作用
2.4 VA可以改善AKN导致的铁死亡VA作用24 h后,通过检测SLC7A11和GPX4的蛋白水平,发现其可以恢复AKN导致的SLC7A11和GPX4降低,SLC7A11(F=63.41)和GPX4(F=65.73)蛋白水平在AKN与VA+AKN组之间的差异均有统计学意义(P<0.001),见图5。
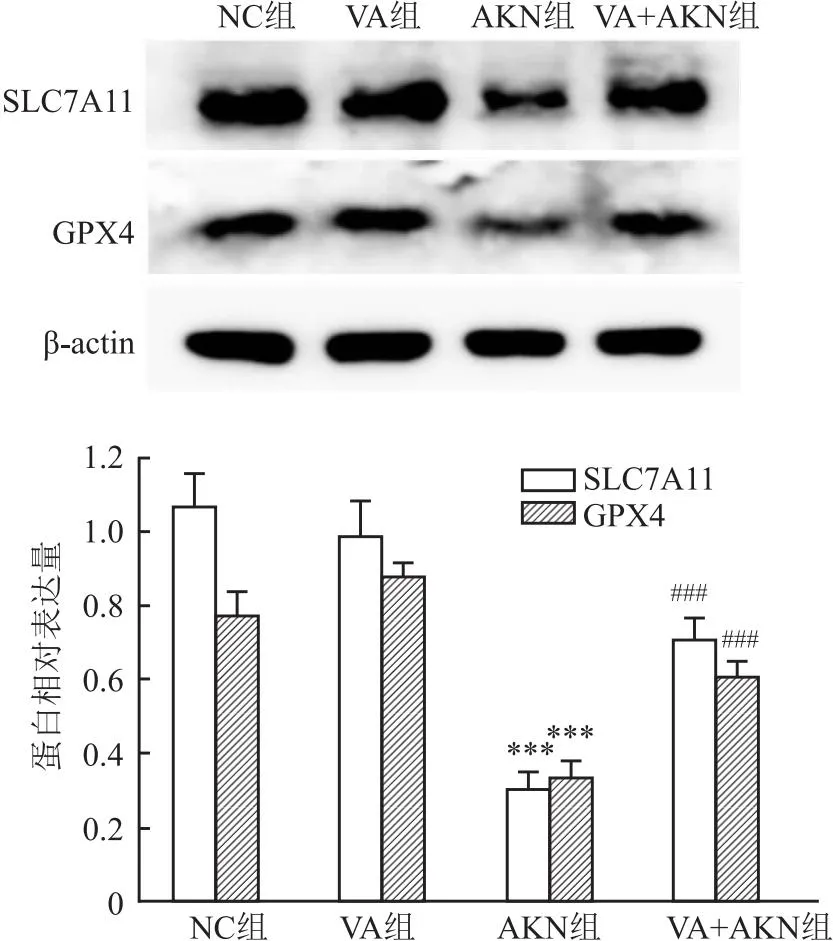
图5 Western blot检测VA对HK-2的SLC7A11和GPX4的蛋白表达水平的影响
3 讨论
氨基糖苷类抗生素是一类临床常用的抗菌药物。近年来,由于结核杆菌耐药性的发展,AKN也已用于结核复治及耐药结核的治疗。与链霉素相比,AKN毒性较低,然而其肾毒性仍然明显。据统计,在儿童人群中,有20%~33%接受氨基糖苷类药物治疗的患者会发生肾损伤[6]。
AKN等氨基糖苷类抗生素引起的肾损伤以近端肾小管为主。在AKN肾损伤大鼠模型中,Rajab et al[2]采用AKN 500 mg/(kg·d)的剂量给雄性的Wistar大鼠连续腹腔注射14 d,可以导致明显的肾小管的损伤及血清肌酐的升高,Dogan et al[7]采用AKN 1.2 mg/kg单次腹腔注射Wistar大鼠,同样14 d后观察到肾小管区域出现明显损伤。本课题组前期研究[5]已发现庆大霉素对HK-2和NRK-52E两种细胞的IC50达到3 mmol/L左右,在本研究中,AKN对HK-2细胞的IC50为5.74 mmol/L。由于药物极性较大,AKN等氨基糖苷类抗生素体外造模所需浓度较大。在体内,氨基糖苷类药物在肾小管管腔侧megalin等蛋白的作用下,重吸收进入肾小管细胞内[8-10]。所以,AKN等氨基糖苷类药物在体内外模型中存在较大的动力学特征差异。早期研究[11]发现凋亡是该类药物导致肾小管细胞损伤或死亡的主要形式,本课题组在庆大霉素肾损伤过程发现细胞出现了程序性坏死及铁死亡[4-5],最近Ding et al[12]也证实炎症性死亡(焦亡)是庆大霉素肾损伤的病理机制。此外,肾脏细胞的损伤还会引起炎症效应,导致血管内皮功能障碍及炎症细胞的浸润和激活,进一步加剧肾小管细胞的损伤[13]。然而,关于AKN肾损伤的病理机制仍不明确,本研究在建立的体外细胞模型上首次证实了铁死亡相关标志蛋白的变化。
近年来,相关研究[14]还发现氨基糖苷类抗生素影响线粒体氧化呼吸链,导致多种活性氧(reactive oxygen species, ROS)的产生,并消耗影响抗氧化系统,导致肾脏细胞产生明显的氧化应激。肾小管细胞线粒体非常丰富,更容易引起氧化应激。本课题组前期研究[4]发现,庆大霉素处理1.5 h后即可以明显导致氧化应激的出现。本研究同样发现,AKN处理早期便使得细胞出现氧化应激。过载ROS可以进一步攻击膜磷脂,导致脂质过氧化,引发铁死亡。脂质过氧化物的大量积累是铁死亡的关键特征,GPX4具有强抗氧化作用,其以GSH为辅因子可催化去除过氧化脂质。而SLC7A11是胱氨酸/谷氨酸反向转运蛋白系统的重要组成部分,负责谷胱甘肽合成前体胱氨酸的胞内转运。在本研究中,相关蛋白指标GPX4和SLC7A11在AKN刺激6 h即显著降低,而脂质过氧化产物MDA在AKN刺激3 h升高,GSH在3 h便开始下降,提示铁死亡在AKN刺激的早期即开始出现。GPX4在发挥抗脂质氧化的同时本身会被消耗,故在刺激之后蛋白水平会显著下降。另外,ROS可导致DNA损伤从而激活P53,通过转录信号调节抑制SLC7A11的表达[15-16],细胞内GSH合成的水平会因此而降低,再加上胞内GSH的大量消耗,GPX4的蛋白水平降低更加明显。
VA是中药王不留行的有效物质,属于类黄酮苷类化合物。近年来,研究显示VA可以通过促进血管生成来加速伤口愈合[17],VA还可通过激活细胞外调节蛋白激酶和肌球蛋白轻链激酶促进了2型糖尿病小鼠肠道屏障的完整性[18]。此外,VA通过减少ROS保护内皮细胞免受氧化低密度脂蛋白诱导的内皮-间质转化、炎症和凋亡。其他类黄酮苷类物质如橙皮苷、柚皮苷、黄芩苷等化合物均具有较好的抗氧化作用。本研究结果也显示VA具有较好的抗氧化作用,可以对抗AKN引起的肾小管细胞的氧化应激。因VA化学结构上具有多个羟基、酚羟基及酮基,所以该化合物具有还原性,可以发挥抗氧化作用。此外,本课题组还发现VA可能靶向还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(NOX4),从而降低氧自由基的形成[19]。所以,在VA作用下,损伤细胞氧化应激指标均显著降低。VA对细胞铁死亡的抵抗效果可能依赖于其抗氧化的作用。此外,在正常培养的细胞中,治疗浓度下的VA并不能显著影响细胞MDA、GSH和ROS的水平,也不改变SLC7A11和GPX4的蛋白水平,故对细胞正常的氧化还原稳态不会产生影响。VA的抗氧化作用机制未进行深入探索,其抑制AKN导致的肾小管细胞的铁死亡是否完全依赖于抗氧化的作用仍需要明确。
本研究成功建立了AKN肾小管上皮细胞体外损伤模型,并发现氧化应激和铁死亡均是导致细胞损伤的重要原因。VA可能通过抑制过氧化应激相关的铁死亡途径减轻AKN肾小管上皮细胞的损伤。
