脂多糖通过TREK-1参与妊娠子宫收缩调控的机制研究
2024-05-10汪星星俞慧慧尹宗智
汪星星,俞慧慧,李 璇,尹宗智
早产是指妊娠28周后、37周之前发生的分娩,早产发生危害巨大[1]。要实现早产的提前干预,需要从源头明确早产的病因。以往的研究[2-3]表明,炎症感染与早产发生密切相关。但感染如何触发孕期子宫平滑肌细胞收缩增强引起早产的机制尚不明确。子宫平滑肌细胞由舒张状态转变为收缩状态的过程,是分娩发动的关键节点。子宫平滑肌细胞受到特定信号的刺激,引起细胞膜去极化,产生动作电位,导致细胞收缩。双孔钾离子通道(TWIK-related K+channel 1, TREK-1)是一种双孔钾离子通道蛋白,在哺乳动物妊娠子宫中高表达,受多种理化因素调控,在开放钾离子外流及维持平滑肌细胞静息状态中发挥重要作用[4]。然而TREK-1在炎症性早产中发挥的作用尚未可知。脂多糖(lipopolysaccharide, LPS)处理妊娠小鼠及细胞被广泛用于早产研究[5]。该研究使用C57BL/6J小鼠和原代妊娠小鼠子宫平滑肌细胞分别建立LPS炎症模型,检测LPS处理组织的收缩变化,以及妊娠子宫平滑肌细胞上高表达的TREK-1蛋白的收缩调控作用,从组织和细胞水平探讨LPS对妊娠子宫平滑肌收缩调控的分子机制。
1 材料与方法
1.1 主要试剂与仪器LPS(货号:0111:B4)、TREK-1抗体、花生四烯酸、Ⅱ型胶原酶、脱氧核糖核酸酶I、牛血清白蛋白购自美国Sigma公司;GAPDH购自北京中杉金桥公司;缩宫素购自美国MedChemExpress公司;KCl购自Biosharp生物技术有限公司;RIPA裂解液购自上海碧云天生物技术有限公司;DAPI染色液及防荧光淬灭封片液购自北京索莱宝生物公司;多通道生理信号采集系统(型号:RM6240E)购自中国成都仪器厂;超高分辨率激光共聚焦显微镜(型号:LSM880)购自德国蔡司公司。
1.2 实验动物C57BL/6J小鼠,SPF级,8周龄,体质量为 22~25 g,购自合肥青源生物科技有限公司,饲养于无特定病原体(SPF)环境,12 h的光/暗周期(07:00—19:00),自由获取食物和水。适应性饲养1周后,按雌雄2 ∶1进行合笼,次日清晨观察有无阴道栓,若观察到阴栓记为妊娠第0天。受孕小鼠随机分为对照组、LPS组,LPS组小鼠在妊娠第16天时腹腔注射20 μg的LPS。对照组小鼠腹腔注射等量生理盐水。注射8 h后以二氧化碳窒息法处死小鼠。所有动物实验均经过安徽医科大学机构动物保护与使用委员会审查和批准(伦理编号:20211044)。
1.3 原代细胞培养及处理分离原代妊娠小鼠子宫平滑肌细胞。取孕晚期小鼠子宫,用无菌刀片将子宫内膜和上皮轻轻刮离子宫肌层表面,然后用组织剪刀将子宫肌层尽量剪碎,向剪碎的子宫组织加入含Ⅱ型胶原酶、脱氧核糖核酸酶、牛血清白蛋白的细胞消化液消化,然后置于摇床上37 ℃孵育1 h。消化后的溶液经100 μm过滤器过滤,去除组织碎片后将滤液转移到无菌离心管中,以1 000 r/min离心5 min,丢弃上层。将细胞沉淀物重悬于10%完全培养基中,细胞悬液置于25 cm2的细胞培养瓶中,置于含5%CO2、37 ℃恒温培养箱中培养。培养24 h待细胞贴壁进行第1次换液,以后每2~3 d换液1次,待细胞融合达80%时用胰蛋白酶-EDTA混合液消化传代。将小鼠子宫平滑肌细胞用不同浓度的LPS处理,其中LPS(0 μg/ml)组仅用完全培养基培养24 h,LPS(10 μg/ml)组和LPS(20 μg/ml)组分别用含有10 μg/ml和20 μg/ml LPS的完全培养基处理24 h。
1.4 等长收缩实验取离体的小鼠子宫,显微镜下清除结缔组织。立即将子宫浸泡在Krebs液(120 NaCl,5.9 KCl,25 NaHCO3,1.2 NaH2PO4,11.5葡萄糖,2.5 CaCl2,1.2 MgCl2,单位:mmol/L) 中备用。将子宫组织沿肌肉纵轴切成7 mm×3 mm大小的肌条用于收缩实验,肌条垂直悬挂在含有5 ml Krebs溶液的37 ℃恒温水浴槽中,含95% O2和5% CO2的混合气体持续泵入Krebs溶液。每个子宫条的一端固定在恒温水浴槽底部,另一端连接在张力传感器上。课题组前期研究[6]证实,子宫肌条在2 g拉伸时的收缩性能最优。记录等长收缩的变化,在产生稳定和规则的收缩曲线后,用96 mmol/L KCl和不同浓度的缩宫素(10-11~10-6mol/L)刺激对照组和LPS组小鼠的子宫肌条,并记录收缩反应。为了确定TREK-1是否参与LPS引起的子宫收缩变化,在TREK-1激活剂花生四烯酸(arachidonic acid, AA) (10-5mol/L)存在的情况下进行收缩实验,最后对子宫肌条进行称重校准。采用多通道生理信号采集系统(RM6240E,中国成都仪器厂)计算收缩曲线的曲线下面积(area of the contraction curve, AUC),然后将该值除以肌肉条的质量,得到AUC/g,定量分析子宫肌条的收缩力。
1.5 Western blot检测蛋白表达水平使用含有磷酸酶抑制剂的RIPA裂解液分别提取各组妊娠小鼠子宫平滑肌细胞与妊娠小鼠子宫平滑肌组织的总蛋白,BCA 法检测并调整蛋白浓度,通过SDS-PAGE凝胶电泳分离总蛋白,然后将蛋白质从凝胶转移到PVDF膜上。将膜在用TBST缓冲液配置的5%脱脂牛奶中封闭2 h,然后在TREK-1(1 ∶200)兔多克隆抗体中4 ℃下孵育过夜,以GAPDH(1 ∶2 000)作为内参。TBST缓冲液洗去一抗,室温孵育辣根过氧化物酶标记的二抗 (1 ∶10 000) 2 h;TBST缓冲液洗去二抗,加入ECL发光液,曝光显影,使用Image J软件分析显影条带的灰度值,并对蛋白表达定量。
1.6 免疫荧光
1.6.1组织免疫荧光 取小鼠子宫,石蜡包埋组织后切片,切片脱蜡水化后分别以0.5% TritonX-100通透、改进型柠檬酸钠抗原修复,PBS清洗后以10%驴血清封闭2 h,一抗(TREK-1:1 ∶100)4 ℃过夜孵育。次日回收一抗,复温40 min后PBS洗涤,滴加荧光二抗室温避光孵育2 h后,PBS洗涤。DAPI孵育10 min,PBS洗涤后滴加防荧光淬灭剂,封片,固定,激光共聚焦成像显微镜下观察、拍照。使用Image J软件进行分析,并对荧光强度定量。
1.6.2细胞免疫荧光 将细胞接种于6孔板内的圆形盖玻片上,按照上述分组及处理后,各组去除培养液,加入PBS 洗涤3次,然后加入适量4%多聚甲醛固定30 min后弃去,PBS洗涤后加入0.5% TritonX-100通透30 min,加入5% BSA封闭1 h,随后一抗(TREK-1:1 ∶100)4 ℃孵育过夜;次日,回收一抗,PBS洗涤后用荧光标记二抗避光孵育1 h,期间注意避光操作。PBS洗涤,DAPI孵育10 min,再次用PBS洗涤;取适量抗荧光淬灭剂滴加在载玻片上,封片,固定,用激光共聚焦显微镜观察、拍照。使用Image J软件进行分析,并对荧光强度定量。
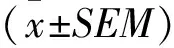
2 结果
2.1 LPS组小鼠子宫收缩力增强为了研究LPS对子宫收缩的影响,用96 mmol/L KCl和浓度递增的缩宫素刺激子宫肌条。LPS组小鼠子宫肌条对KCl刺激反应迅速,收缩力迅速达到峰值,此后一直保持在较高水平。对照组小鼠的子宫肌条对KCl反应也迅速,但收缩力峰值低于LPS组水平。LPS组KCl刺激子宫肌条5 min时产生的收缩力总和显著高于对照组(P<0.000 1),见图1A。对照组和LPS组子宫肌条收缩力对缩宫素的响应呈浓度依赖性,缩宫素诱导的子宫肌条收缩曲线呈周期性振荡,收缩频率随缩宫素浓度的增加而增加,收缩力峰值随缩宫素浓度的增加而增加。缩宫素处理下,LPS组诱导的子宫肌条收缩力较对照组强(F=9.242,P<0.05),各浓度亚组缩宫素诱导的收缩均显示LPS组较对照组强(P<0.05),见图1B。

图1 妊娠小鼠子宫组织的收缩力(n=3)
2.2 LPS组小鼠子宫组织TREK-1蛋白表达降低对妊娠小鼠子宫组织中提取的总蛋白进行Western blot分析,在47 ku位置检测到TREK-1对应的条带。LPS组小鼠子宫平滑肌组织中TREK-1 蛋白水平明显低于对照组(P<0.000 1),见图2A。同时采用免疫荧光法观察子宫平滑肌组织中的TREK-1表达情况,结果表明LPS显著降低组织中TREK-1的表达(P<0.000 1),见图2B。
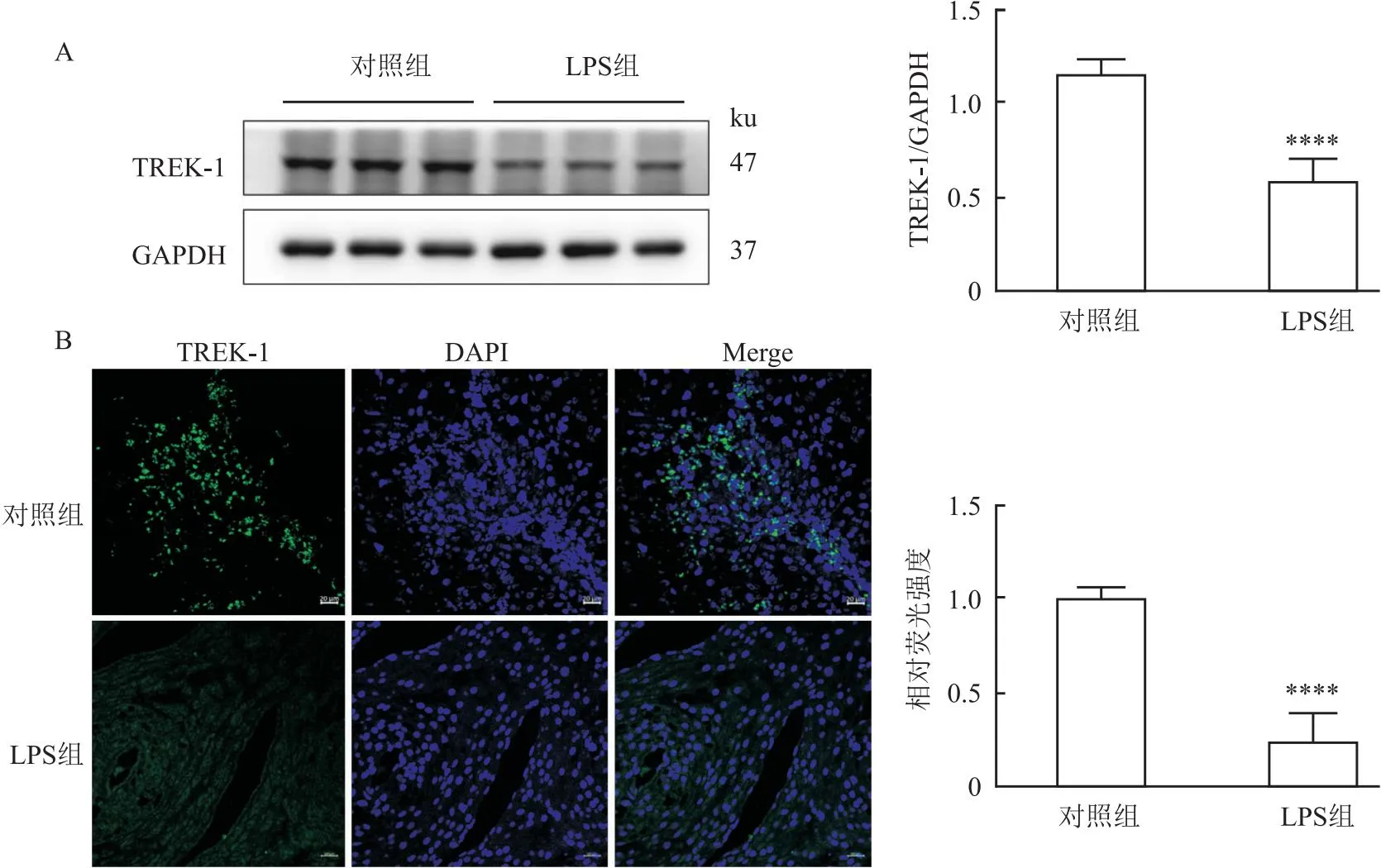
图2 TREK-1在小鼠子宫组织中的表达 (n=3)
2.3 激活TREK-1可降低LPS激发的小鼠子宫收缩为了确定子宫条之间的收缩差异是否与TREK-1有关,使用TREK-1激动剂AA(10-5mol/L)预处理LPS组小鼠子宫条1 h,与未经AA预处理的LPS组小鼠子宫肌条相比,发现AA可显著降低LPS组小鼠KCl(图3A,P<0.01)和缩宫素(图3B,F=18.48,P<0.05)诱导的子宫收缩。各浓度亚组缩宫素诱导的收缩均显示加AA处理后子宫组织收缩减弱(P<0.05),见图3B。
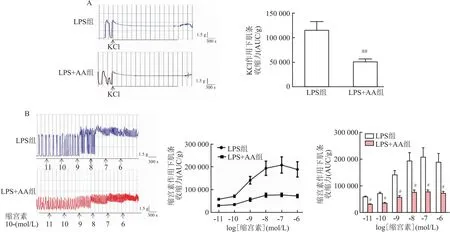
图3 TREK-1参与的妊娠子宫收缩调控(n=3)
2.4 LPS对原代妊娠小鼠子宫平滑肌细胞的TREK-1蛋白表达没有影响对提取的原代妊娠小鼠子宫平滑肌细胞给予不同浓度的LPS刺激, Western blot分析结果显示在47 ku位置检测到TREK-1对应的条带,但是LPS刺激并不能降低小鼠子宫平滑肌细胞TREK-1蛋白表达(F=1.67,P>0.05)。采用细胞免疫荧光观察子宫平滑肌细胞TREK-1蛋白的表达和位置,结果显示LPS未对子宫平滑肌细胞TREK-1蛋白的表达及定位产生影响(F=2.443,P>0.05)。见图4。
图4 TREK-1在小鼠子宫平滑肌细胞中的表达(n=3)
3 讨论
TREK-1是在子宫平滑肌组织中表达的双孔钾离子通道蛋白,既往研究[6-7]表明,TREK-1激活剂AA可显著降低人子宫肌条的收缩力,而在使用TREK-1 通道特异性抑制剂L-甲硫氨酸抑制通道功能后,大鼠子宫组织的收缩力显著增强,证实了TREK-1在调节子宫收缩力中的重要性。TREK-1受温度、pH、拉伸、AA、L-甲硫氨酸、黄体酮等因素调节,有研究[4]也证实TREK-1蛋白表达升高在妊娠期糖尿病患者子宫收缩减弱中起重要作用,高糖通过TREK-1参与了妊娠期子宫平滑肌收缩的调节。而本研究首次将TREK-1与炎症性早产关联,TREK-1可能是未来调节子宫收缩力和治疗炎症性早产的潜在靶点。然而直接使用LPS刺激妊娠小鼠子宫平滑肌细胞发现,TREK-1蛋白并没有出现与组织上相同的表现,这提示LPS通过TREK-1实现的收缩调控可能需要细胞间信号的作用。
细胞间相互作用是指在生物体内不同细胞之间通过信号传导、物质交换等方式进行的相互影响和调控。细胞之间可以通过配体、受体、代谢物等信号分子进行信号传递,并构成复杂的相互作用网络,从而与细胞内调控网络一并实现对细胞形态与功能的动态调控。细胞间相互作用在多细胞生物的发育和功能中起着至关重要的作用[8-9]。Boros-Rausch et al[10]在关于LPS诱导人子宫肌细胞炎症进而影响收缩的研究中发现,广谱趋化因子抑制剂通过抑制子宫肌细胞促炎细胞因子分泌、收缩相关蛋白表达和破坏肌细胞与组织巨噬细胞的相互作用来阻止感染诱导的子宫平滑肌细胞收缩。Zhang et al[11]的另一项研究指出,在LPS诱导的小鼠早产模型中,LPS不仅显著和特异性地诱导肌层中细胞因子CXCL12的表达,还可增强免疫细胞的浸润,体外研究中LPS处理的原代平滑肌细胞条件培养基有诱导巨噬细胞迁移、M1极化和上调炎症相关细胞因子的作用。这些研究结果提示,LPS对子宫平滑肌收缩的影响是通过多种细胞与细胞间相互作用实现的。大量证据表明,早产发生时子宫内胎盘、羊膜、蜕膜和子宫肌层均有炎症发生[10,12]。在LPS诱导的小鼠早产模型中,可能存在子宫平滑肌与子宫内不同组织以及其内的免疫细胞、细胞因子间相互作用。通过多种细胞间相互作用,实现妊娠子宫平滑肌细胞收缩与收缩关键信号TREK-1蛋白的调控变化,而非LPS直接作用于子宫平滑肌细胞。这进一步提示,在炎症性早产研究中不能完全以离体细胞实验代替整体动物及组织学实验。离体细胞实验无法模拟复杂器官中存在的所有分子和细胞与细胞间相互作用。
综上所述,LPS通过降低妊娠小鼠子宫组织中的TREK-1表达及功能,使得子宫组织的收缩能力增强,但在细胞层面上却没有发现相同的作用,这可能与细胞间相互作用有关。然而本研究仅从组织和细胞层面对LPS以及相关的TREK-1蛋白及功能方面进行了初步的探讨,截止目前尚未发现LPS影响平滑肌细胞膜上TREK-1存在的具体细胞间信号传递通路,需要进一步研究完善。目前已知炎症感染会伴随内环境酸碱度的变化[13],而TREK-1的表达受酸碱度调控[4]。因此酸碱度是否参与炎症感染对TREK-1的调控是未来的重要研究方向。
