葛根素靶向线粒体抑制乳腺癌细胞增殖和侵袭的机制
2024-05-10余才翰
余才翰,李 岱,谢 敏
世界卫生组织国际癌症研究机构统计数据显示,2020年全球新发癌症病例1 929万例,其中乳腺癌新增人数达226万,成为全球第一大癌症[1]。癌症不仅是一种遗传疾病,更是一种代谢疾病[2],线粒体作为能量代谢的主要细胞器,在肿瘤发生、增殖和凋亡中发挥重要作用[3]。线粒体功能受损可显著降低肿瘤细胞增殖和致瘤能力[4]。研究[5]表明,线粒体DNA缺失的小鼠无法形成肿瘤。
葛根素是从葛根属豆科植物中提取的一种黄酮类分子,具有抗肿瘤活性。葛根素可阻断核因子-κB p65 (NF-κB p65)和细胞外调节蛋白激酶(Erk)抑制乳腺癌细胞迁移、侵袭和黏附[6],还可通过降低葡萄糖代谢诱导胰腺癌细胞线粒体依赖性凋亡[7]。然而,葛根素在乳腺癌中的机制尚未明确,有待进一步探索。该研究基于网络药理学和分子对接预测葛根素的潜在靶点和分子途径,通过体内外实验进行验证,为乳腺癌的防治提供理论依据。
1 材料与方法
1.1 材料
1.1.1细胞株 人乳腺癌细胞HCC1806和人正常乳腺上皮细胞MCF10A均购自广州吉尼欧生物科技有限公司。HCC1806细胞培养在RPMI-1640培养基中,MCF10A细胞培养在DMEM培养基中。两种培养基均含有10%胎牛血清、50 U/ml青霉素和50 μg/ml链霉素,并置于5%CO2、37 ℃的培养箱中培养。
1.1.2实验动物 20只雄性BALB/c裸鼠,SPF级,8周龄,体质量20~25 g,购自湖北贝恩特生物科技有限公司[生产许可证号:SCXK(鄂)2021-0027]。
1.1.3药物、试剂与仪器 葛根素购于上海源叶生物科技有限公司(批号:B20446)。RPMI-1640培养基(批号:8121368)、DMEM培养基(批号:8123037)购自美国Gibco公司,DMSO(批号:ST038)购自上海碧云天生物技术股份有限公司。CO2培养箱(新加坡艺思高科技有限公司),超净工作台(苏州净化设备有限公司),酶标仪(美国伯腾仪器有限公司),显微镜(日本奥林巴斯有限公司)。
1.2 方法
1.2.1数据收集 通过GEO数据库(https://www.ncbi.nlm.nih.gov/geo)收集乳腺癌和正常乳腺组织数据,数据集编号为GSE42568;收集线粒体疾病与对照组数据,数据集编号为GSE42986。在线GEO2R分析差异性表达基因。使用韦恩图分析乳腺癌与线粒体数据集之间的重叠基因。对重叠基因进行GO和KEGG功能富集分析,使用STRING数据库分析重叠基因的相互作用网络,使用Cytoscape可视化重叠基因相互作用网络,并通过介数中心筛选核心基因。GEPIA(http://gepia.cancer-pku.cn)在线分析枢纽基因在乳腺癌患者中的差异性表达。Human Protein Atlas数据库(https://www.proteinatlas.org/)下载对相关蛋白的乳腺癌和正常乳腺组织的免疫组化染色图像。
1.2.2CCK-8细胞增殖实验 取对数生长期乳腺癌细胞,以每孔5×103个细胞接种于96孔板(Corning,USA)中。然后,用不同浓度的葛根素(0、3、10和30 mol/L)处理细胞。处理24 h后,向每个孔中加入10 μl CCK-8试剂,然后培养2 h,利用酶标仪检测450 nm处的吸光度。
1.2.3细胞划痕实验 取对数生长期乳腺癌细胞,以每孔5×105个细胞接种于6孔板,培养箱中孵育24 h,融合率达到90%左右,用 20 μl无菌枪头在孔内垂直横线划痕,用 PBS洗除脱落细胞后,加入葛根素含1%胎牛血清培养基继续培养,并在0、24 h显微镜下观察各孔并拍照,每组实验重复3次及以上。用 Image J 软件测量划痕面积,用 Graphpad Prism8软件分析实验结果。
1.2.4Transwell细胞迁移侵袭实验 将含5×104个细胞的无血清RPMI-1640培养基200 μl加入上室,在下室中加入含10%胎牛血清的培养基,在37 ℃条件下细胞浸润24 h。4%多聚甲醛固定15 min,PBS洗涤3次,再用结晶紫染色15 min,PBS洗涤3次,用棉签去除上室细胞,显微镜下观察拍照。
1.2.5EdU细胞增殖实验 取对数生长期乳腺癌细胞,以每孔5×103个细胞接种于24孔板,培养约24 h后葛根素干预。配制EdU工作液,等体积混合孵育2 h,去除培养液,PBS洗涤2次。免疫染色固定液室温固定15 min,去除固定液,PBS洗涤2次,免疫染色强力通透液室温孵育15 min,去除通透液,PBS洗涤2次。加入配制好的Click反应液,室温避光孵育30 min,吸除反应液,PBS洗涤2次。加入预热的细胞培养液,用含DAPI抗淬灭剂封片,荧光显微镜下观察拍照。
1.2.6TUNEL细胞凋亡实验 葛根素诱导细胞凋亡,免疫染色固定液固定30 min。PBS清洗2次,含0.3% Triton X-100的PBS重悬细胞,室温孵育5 min。PBS洗涤2次,用50 μl TUNEL检测液,37 ℃避光孵育60 min。PBS洗涤3次,加入预热的细胞培养液,用含DAPI抗淬灭剂封片,荧光显微镜下观察拍照。
1.2.7线粒体膜电位水平检测 Mito-Tracker Red CMXRos是一种红色线粒体特异性探针,用于检测线粒体膜电位。取对数生长期乳腺癌细胞,以每孔5×103个细胞接种于24孔板,培养约24 h后葛根素干预。去除细胞培养液,PBS洗涤2次,加入配制好的工作液,37 ℃避光孵育30 min。去除工作液,PBS洗涤2次,加入预热的细胞培养液,用含DAPI抗淬灭剂封片,荧光显微镜下观察拍照。
1.2.8乳腺癌裸鼠移植瘤模型的构建及处理 本研究中所有动物实验均经湖北科技学院实验动物伦理委员会批准(批准号:2022-03-042),并按照当地和国际的动物护理和使用指南进行。雄性裸鼠在SPF级无菌动物室适应性饲养5 d。取对数期生长乳腺癌细胞消化离心后重悬,最终细胞浓度为4×106个/μl。裸鼠深度麻醉后,于裸鼠背部皮下注射接种,建立人乳腺癌裸鼠移植瘤模型。当肿瘤平均体积约为50 mm3时,将裸鼠随机分为对照组、葛根素给药组。给药组每日腹腔注射葛根素(按20 mg/kg给药),对照组每日腹腔注射等量生理盐水。14 d后处死小鼠,剥离瘤体计算体积,计算公式如下:体积=a×b2/2 (a=长,b=宽,单位为mm)。
1.2.9免疫组化实验 瘤体组织进行常规脱水、包埋,制作石蜡切片(4 μm),脱蜡,抗原修复 20 min,PBS 漂洗 3 次,每次 10 min,过氧化氢孵化 10 min,PBS 漂洗 3 次, 每次 10 min,封闭液封闭 1 h,Ⅰ 抗(1 ∶100)孵育过夜,PBS 清洗3次,每次10 min,Ⅱ抗(1 ∶1 000)孵育 1 h,PBS 清洗3次, 每次10 min,DAB染色5 min,PBS清洗,苏木精染色5 min,PBS 清洗,脱水、透明,中性树脂封片,荧光显微镜下观察拍片。
1.2.10分子对接 分子对接PDB数据库(https://www.rcsb.org/)下载DST(ID为5YNV)结构;Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载葛根素二维(2D)结构;ChemBio3D优化葛根素;Autodock_vina将葛根素分别与DST对接;OpenBabel(v2.3.1)39分离文件,添加氢键并分配可旋转键和电荷;PDBQT进一步对接;PyMOL可视化对接结果。
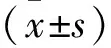
2 结果
2.1 乳腺癌及线粒体相关基因差异性表达分析乳腺癌数据集GSE42568包含9 667个差异性表达基因(图1A),线粒体疾病数据集GSE42986包含256个差异性表达基因(图1B),两个数据集的重叠基因共132个(图1C)。使用GO和KEGG富集分析对132个重叠基因分析。GO功能富集分析得到生物过程、细胞组分和分子功能三方面的注释和分类,将排名前8的条目绘制柱状图,结果见图1D。KEGG通路富集筛选出3条信号通路,结果见图1E。
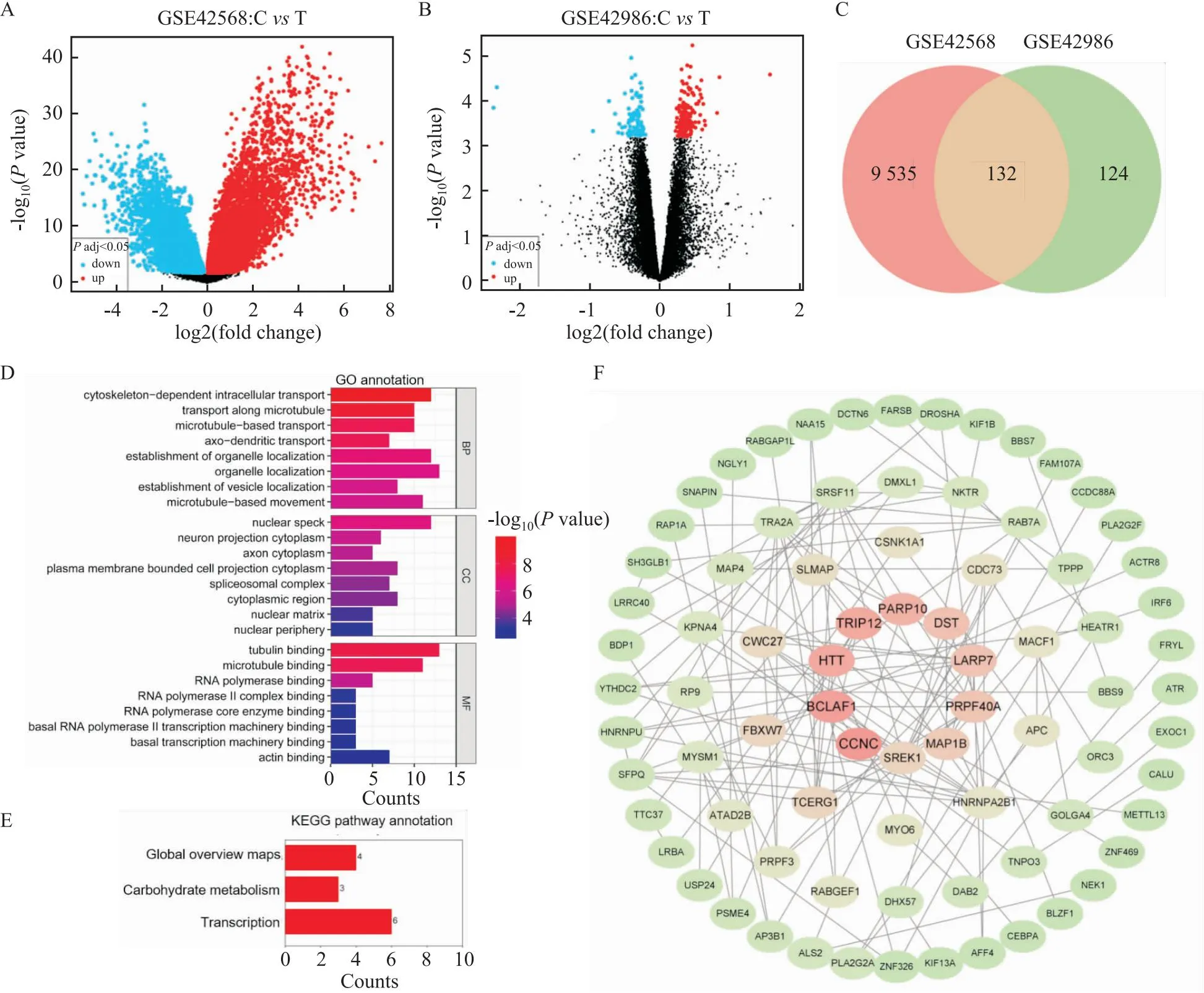
图1 乳腺癌和线粒体疾病相关基因分析
2.2 乳腺癌线粒体差异性表达基因相互作用网络及核心基因分析将乳腺癌线粒体差异性表达基因相互作用在线分析并可视化,筛选出10个核心基因,结果见图1F。GEPIA分析10个核心基因在乳腺癌及正常乳腺组织中的表达水平。结果发现在1 085 例乳腺癌患者中,DST在乳腺癌组织中蛋白水平呈低表达,见图2A。同时,HPA数据库查询到DST在免疫组化染色图像中乳腺癌组织呈现更低的阳性率,见图2B。分子对接结果显示,葛根素可与DST蛋白的60位精氨酸、207位谷氨酸和277位天冬氨酸结合,结合能量为-9.2 kcal/mol,见图2C。同时,免疫印迹结果显示,DST蛋白的相对表达量给药组(1.55±0.13)显著高于对照组(1.00±0.05)(t=-6.74,P<0.05,n=3),见图2D。

图2 DST与乳腺癌的相关性分析
2.3 葛根素抑制乳腺癌细胞增殖CCK-8法检测结果显示,在3~30 μmol/L时葛根素对正常乳腺上皮细胞存活没有显著影响,但明显抑制乳腺癌细胞存活,并随着葛根素的浓度增大乳腺癌细胞存活率逐渐降低(P<0.05),IC50=14.51 μmol/L,后续给药浓度选择10 μmol/L,见图3A。EdU细胞增殖实验结果显示,EdU阳性细胞给药组(0.30±0.07)显著少于对照组(0.73±0.07)(t=10.05,P<0.05,n=3),见图3B。
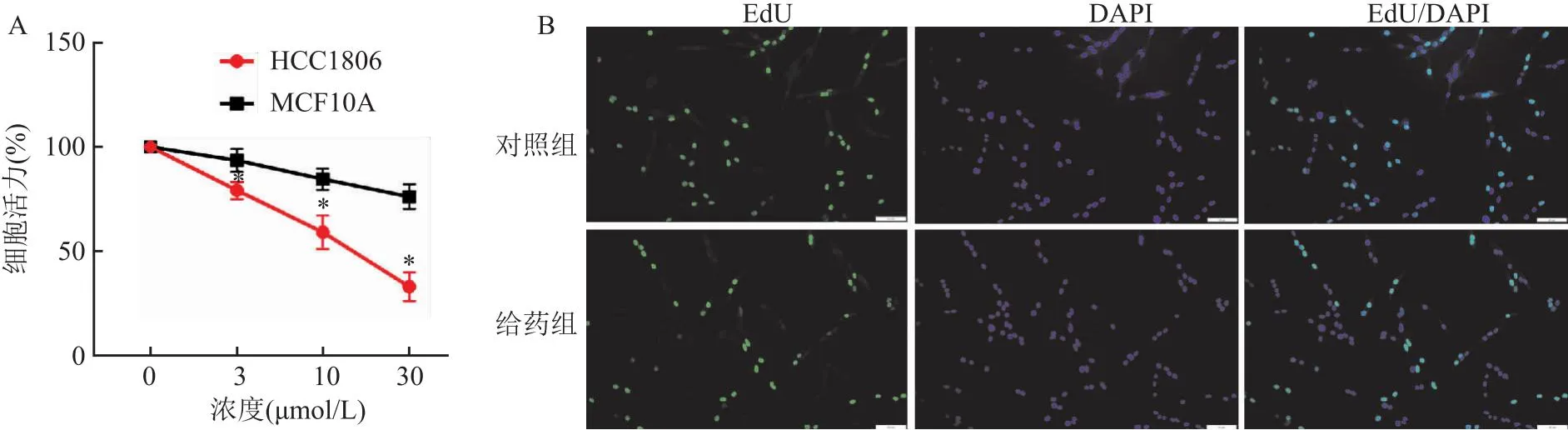
图3 葛根素对乳腺癌细胞存活率和增殖的影响
2.4 葛根素抑制乳腺癌细胞侵袭Transwell实验结果显示,与对照组相比,给药组细胞迁移穿过Transwell小室的细胞数明显减少(P<0.05),见表1和图4A。划痕实验结果显示,与对照组相比,给药组24 h后划痕距离显著增宽(P<0.05),见表1和图4B。
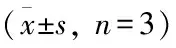
表1 葛根素对乳腺癌细胞迁移的影响
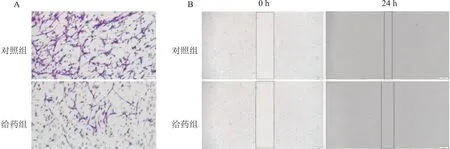
图4 Transwell和细胞划痕实验分析葛根素对乳腺癌细胞迁移和侵袭的影响
2.5 葛根素诱导乳腺癌细胞凋亡TUNEL实验结果显示,乳腺癌细胞经葛根素处理48 h后,凋亡率明显增加(P<0.05),见表2、图5A。同时免疫印迹实验结果显示,与对照组相比,给药组显著增加凋亡因子Cleaved-Caspase3和Bax的表达水平,并下调抗凋亡因子Bcl-2的表达(P<0.05),见表2、图5B。
表2 葛根素对乳腺癌细胞凋亡水平的影响
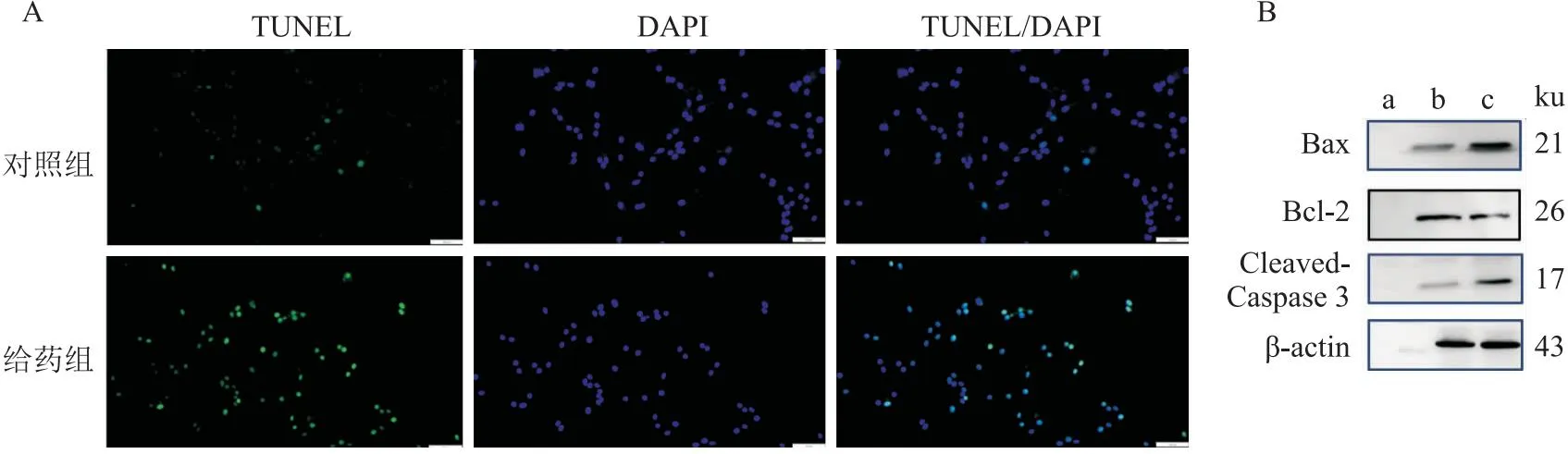
图5 TUNEL和免疫印迹分析葛根素对细胞凋亡的影响
2.6 葛根素降低线粒体功能Mito-Tracker Red 法检测线粒体膜电位,结果显示,葛根素处理后,与对照组(1.00±0.06)相比,给药组(0.53±0.70)的相对荧光强度明显减弱(t=9.16,P<0.05,n=3),见图6。
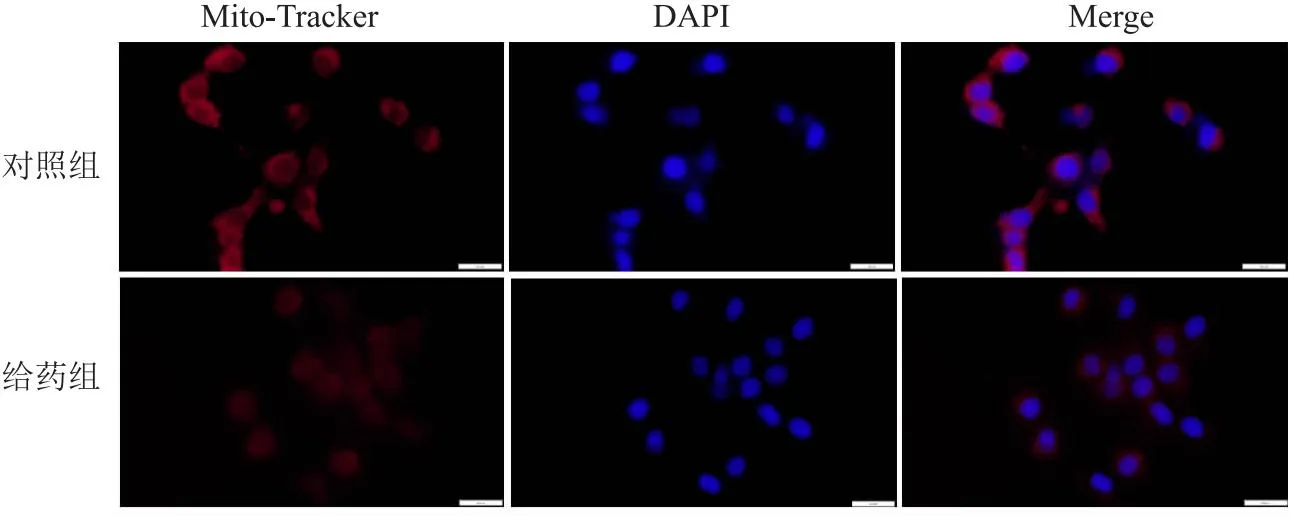
图6 葛根素对线粒体膜电位的影响 ×60
2.7 葛根素对乳腺癌移植瘤的影响HCC1806 细胞皮下异种移植瘤,连续给药 14 d,与对照组相比,给药组显著减慢肿瘤的生长(P<0.05) ,见表3和图7A。免疫组化显示葛根素连续给药14 d后,给药组瘤体组织中DST阳性细胞明显增加(P<0.05),见表3和图7B。
表3 葛根素对乳腺癌皮下异种移植瘤体积以及瘤体组织DST表达的影响

图7 葛根素对乳腺癌皮下异种移植瘤生长及对瘤体组织中DST表达的影响
3 讨论
本研究显示葛根素可能通过结合DST抑制乳腺癌细胞的增殖和侵袭,同时诱导其凋亡。DST是一种独特的具有磷酸化酪氨酸、丝氨酸和苏氨酸残基的蛋白质,是多种癌症发生发展的关键蛋白质,并与不良临床结果相关。DST的表达与肝癌、非小细胞癌、腺癌、结直肠癌、膀胱癌以及乳腺癌患者的生存相关[8]。6.4%的肺癌患者据报告存在DST基因改变,DST基因组扩增的患者表现出较差的生存率[9]。DST可通过调节上皮-间质细胞转移促进结直肠癌转移并增加随后的化疗耐药性[10]。DST低表达也可增加细胞周期蛋白依赖性激酶14表达,并促进乳腺癌细胞的增殖和侵袭,并增加体内的致瘤性[11]。DST基因突变通过激活ERK1/2和 MMP2/9信号通路,促进单发纤维性肿瘤/血管外皮细胞瘤细胞转移[12]。在慢性化疗药物治疗存活的三阴性乳腺癌患者的细胞中发现DST的表达量明显高于未治疗组[13]。因此,DST可作为癌症治疗的一个有效靶标。
DST的稳定与线粒体的完整性密切相关,从而维持有效的线粒体形态和生理功能。DST过表达可在应激条件下抑制线粒体磷酸化解偶联,减少ATP形成,引发线粒体功能障碍及线粒体适用性降低,从而抑制肺癌的进展[9]。DST可激活线粒体动力相关蛋白1介导的线粒体分裂,降低氧化磷酸化和糖酵解,从而促进多形性胶质母细胞瘤的侵袭性[14]。本研究表明葛根素可降低线粒体功能。因此,推测葛根素通过激活DST表达降低线粒体功能从而抑制肿瘤的进程。
本研究创新点在于通过网络药理学和分子对接技术筛选出核心基因DST,然后进行体内和体外实验验证DST在乳腺癌中的作用及可能机制,为后期研究乳腺癌治疗方法提供了新思路和新靶点。然而,本研究未深入探讨DST蛋白在乳腺癌中的作用机制,在后续研究中可将DST作为靶点采用药理学方法激活或抑制其活性、病毒学方法过表达或敲降该基因,分析其下游信号的改变,从而阐明其在乳腺癌中的作用机制。
(致谢:感谢湖北科技学院基础医学院胡美纯博士在乳腺癌移植瘤实验中提供的支持和帮助。)
