α-倒捻子素通过NF-κB途径抑制LPS/ATP诱导的小胶质细胞中NLRP3炎症小体的激活
2024-05-10朱慧艳
陈 敏,陶 静,朱慧艳
脊髓损伤是一种可致残疾的严重外伤。研究表明在脊髓损伤发生后,损伤灶中的小胶质细胞被迅速激活,诱导炎症的发生,并加剧神经功能障碍和损伤[1-3],而通过抑制小胶质细胞介导的神经炎症的治疗策略则有助于脊髓损伤的恢复。由NOD样受体蛋白3(NOD-like receptor pyrin domain containing 3,NLRP3)介导的经典炎症小体途径可通过激活下游信号通路转导,引起炎症介质的表达和释放,从而引起严重的炎症反应[4-6]。有研究[5]报道,在脊髓损伤组织,NLRP3炎性小体的活化水平和其诱导的炎症因子表达均异常升高。这提示NLRP3炎性小体可能参与脊髓损伤中小胶质细胞介导的炎症反应[5]。α-倒捻子素(α-mangostin)是从山竹果皮和树皮中提取的多酚类酮,研究显示,α-mangostin可通过抑制NLRP3炎性小体的活化来治疗多种炎症性疾病[7-9]。然而,在脊髓损伤中,α-mangostin是否同样能够下调NLRP3炎性小体来介导小胶质细胞的炎症反应尚不清楚。因此,该研究通过建立小胶质细胞体外炎症模型来探讨α-mangostin作用及相关机制。
1 材料与方法
1.1 细胞系和主要试剂小鼠小胶质细胞系BV-2购自武汉普诺赛生命科技有限公司。DMEM培养基、胎牛血清和青霉素链霉素混合液(美国Hyclone公司);α-mangostin(浙江博迈科生物医药研发有限公司);脂多糖(lipopolysaccharide, LPS)和三磷酸腺苷(adenosine triphosphate, ATP)(美国Sigma公司);检测肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)和IL-6和IL-18的ELISA试剂盒(杭州联科生物技术股份有限公司);CCK-8细胞增殖实验检测试剂盒(北京索莱宝科技有限公司);兔抗NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein, ASC)、抗裂解型caspase-1(cleaved caspase-3)、抗p65、抗磷酸化p65(phosphorylated p65, p-p65)、抗核p65(nuclear p65)、抗LaminB抗体(美国CST公司);兔抗GAPDH抗体、辣根过氧化物酶偶联的山羊抗兔二抗(美国Abcam公司)。ECL试剂、NE-PERTM细胞核蛋白提取试剂盒(美国Thermo公司)。
1.2 细胞培养和处理采用含10%胎牛血清和1%青链霉素的DMEM培养基在37 ℃、5%CO2的培养箱中培养BV-2细胞。按处理方式的不同将BV-2细胞分为6组:正常培养的Ctrl组、LPS与ATP处理的LPS/ATP组、单独40 μmol/L α-mangostin处理组(40 μmol/L α-mangostin组)和不同浓度(10、20、40 μmol/L)的α-mangostin干预组,分别记为LPS/ATP+10 μmol/L α-mangostin、LPS/ATP+20 μmol/L α-mangostin与LPS/ATP+40 μmol/L α-mangostin。BV-2细胞分组处理前,按5×104个/孔接种至96孔板中,37 ℃、5%CO2的培养箱中培养过夜后,加入不同浓度α-mangostin(10、20、40 μmol/L)处理4 h后,再参考文献[10]方法依次采用1 μg/ml的LPS处理5.5 h和5 mmol/L的ATP处理0.5 h以建立BV-2细胞炎症模型。
1.3 CCK-8法检测细胞增殖活力取生长状态良好的BV-2细胞,5×104个/孔接种至96孔板中,首先单独采用不同浓度α-mangostin(10、20、40、80 μmol/L)处理细胞4 h后,每孔加入10 μl的CCK-8试剂继续在细胞培养箱中孵育2 h,然后根据试剂盒说明书方法在微板测量仪上测量每孔在450 nm处的吸光度值。然后再根据1.2项中的方法对BV-2细胞进行分组处理后,按前述方法测量每组细胞在450 nm处的吸光度值。每组细胞的吸光度值为细胞的增殖活力。
1.4 ELISA实验取各组BV-2细胞的培养上清液,4 ℃下2 240 r/min离心10 min后,去除底层沉淀,采用ELISA试剂盒并参考说明书方法测量上清液中的IL-6、IL-1β、IL-18和TNF-α含量。
1.5 Western blot实验分别采用含有蛋白酶抑制剂混合物的RIPA裂解缓和NE-PERTM试剂盒提取各组BV-2细胞胞质和胞核中的蛋白质。BCA法测定蛋白浓度,取30 μg等量的蛋白样品通过10%SDS-PAGE凝胶进行分离,湿转法转移至聚偏二氟乙烯膜上后,5%的脱脂奶粉进行封闭。加入稀释后的一抗置于4 ℃下孵育过夜,一抗分别为:NLRP3(1 ∶500)、ASC(1 ∶1 000)、IL-1β(1 ∶500)、cleaved caspase-1(1 ∶800)、p65(1 ∶1 000)、p-p65(1 ∶1 000)、LaminB(1 ∶2 000)和GAPDH(1 ∶2 000)。次日加入辣根过氧化物酶偶联的山羊抗兔二抗(1 ∶5 000),并在室温下孵育1 h。最后加入ECL试剂在凝胶成像系统中对膜进行可视化,并分别以GAPDH和LaminB作为胞质和胞核蛋白的内参,利用ImageJ软件分析蛋白条带灰度值。
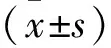
2 结果
2.1 α-mangostin保护LPS/ATP诱导的小胶质细胞损伤CCK-8法检测结果表明各组间的细胞增殖活力差异均有统计学意义(F=112.615、327.196,P<0.05)。与Ctrl组相比,低浓度(10、20、40 μmol/L)的α-mangostin对小胶质细胞增殖活力无明显影响(P>0.05),而高浓度(80 μmol/L)的α-mangostin可显著降低细胞的增殖活力(P<0.05);与Ctrl组相比,LPS/ATP组细胞增殖活力明显降低(P<0.05),但低浓度(10、20、40 μmol/L)的α-mangostin可显著改善LPS/ATP对小胶质细胞增殖活力的抑制作用(P<0.05),高浓度(80 μmol/L)α-mangostin可促进LPS/ATP对小胶质细胞的损伤(P<0.05)。见图1。基于此,40 μmol/L的α-mangostin对细胞无毒性,但对LPS/ATP诱导的损伤的保护作用最强,因此单独α-mangostin处理组中使用40 μmol/L。
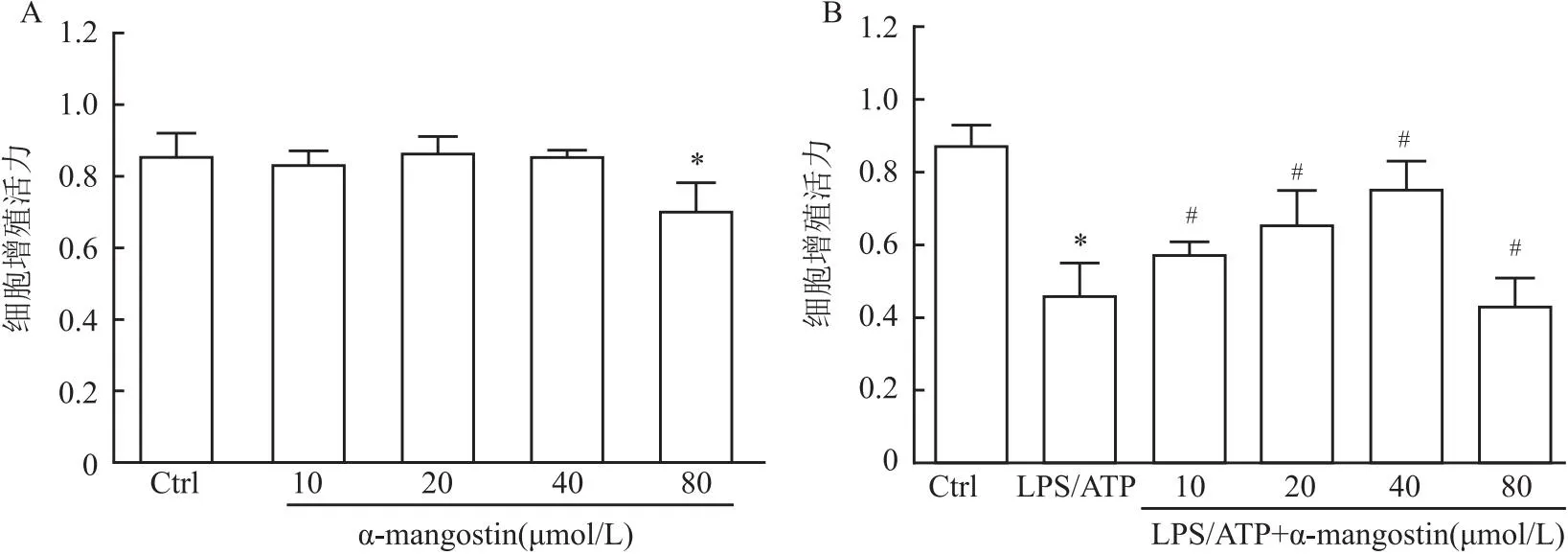
图1 CCK-8检测各组小胶质细胞的增殖活力
2.2 各组小胶质细胞中炎症因子的表达ELISA检测结果显示,各组间IL-6、IL-1β、IL-18和TNF-α的含量差异均有统计学意义(F=426.184、268.545、414.872、321.368,P<0.05)。与Ctrl组相比,40 μmol/L α-mangostin组小胶质细胞上清液中炎症因子IL-6、IL-1β、IL-18和TNF-α含量均无明显改变(P>0.05),而LPS/ATP组的上清液中均显著增加(P<0.05);与LPS/ATP组相比,不同浓度α-mangostin干预组上清液中炎症因子IL-6、IL-1β、IL-18和TNF-α含量随α-mangostin浓度的增加而依次降低,其中以LPS/ATP+40 μmol/L α-mangostin组降低程度最为明显(P<0.01)。见表1。
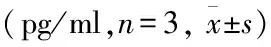
表1 各组小胶质细胞中炎症因子IL-6、IL-1β、IL-18和TNF-α含量的比较
2.3 各组小胶质细胞中NLRP3炎症小体的表达Western blot检测结果显示,各组间NLRP3、ASC、cleaved caspase-1和IL-1β的表达水平差异均有统计学意义(F=594.310、392.621、511.531、416.508,P<0.05)。与Ctrl组相比,40 μmol/L α-mangostin组小胶质细胞中NLRP3炎症小体相关蛋白NLRP3、ASC、cleaved caspase-1和IL-1β表达均无明显差异(P>0.05),LPS/ATP组小胶质细胞中NLRP3、ASC、cleaved caspase-1和IL-1β的蛋白表达均显著升高(P<0.01);与LPS/ATP组相比,不同浓度α-mangostin干预组中NLRP3、ASC、cleaved caspase-1和IL-1β的蛋白表达呈α-mangostin浓度依赖性而显著降低(P<0.05),并以LPS/ATP+40 μmol/L α-mangostin组的降低最为明显(P<0.01),见图2。
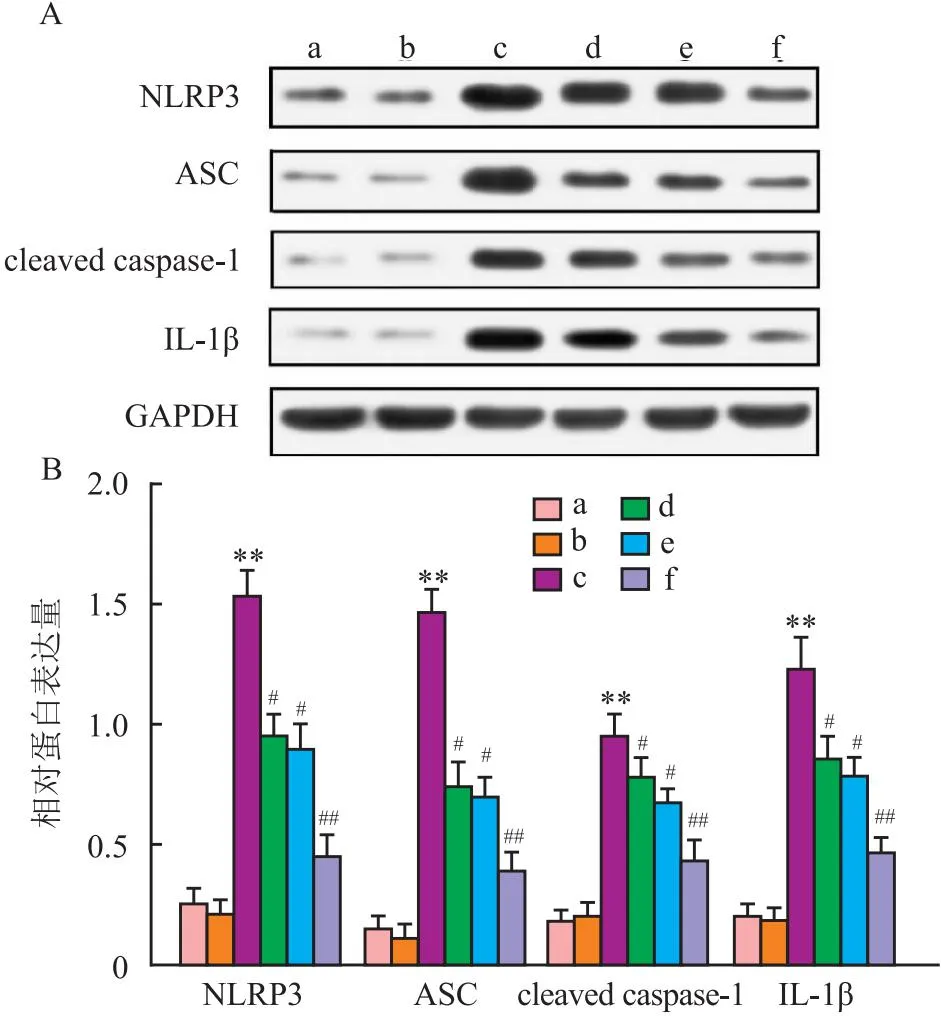
图2 各组小胶质细胞中NLRP3小体相关蛋白NLRP3、ASC、cleaved caspase-1和IL-1β的表达
2.4 各组小胶质细胞中NF-κB途径的表达Western blot检测结果显示,各组间p-p65/p65比值以及细胞核中p65的表达水平差异均有统计学意义(F=501.839、514.842,P<0.05)。与Ctrl组相比,40 μmol/L α-mangostin组小胶质细胞中p-p65/p65比值无明显变化(P>0.05),LPS/ATP组小胶质细胞中p-p65/p65比值显著升高(P<0.05);与LPS/ATP组相比,不同浓度α-mangostin干预组中p-p65/p65比值随α-mangostin浓度升高而显著降低(P<0.05),其中以LPS/ATP+40 μmol/L α-mangostin组的降低趋势最为明显(P<0.01),见图3A、3B。随后,再次应用Western blot检测小胶质细胞核中p65改变,结果显示,与Ctrl组相比,40 μmol/L α-mangostin组小胶质细胞核中p65无明显改变(P>0.05),LPS/ATP组小胶质细胞核中p65表达显著升高(P<0.01);与LPS/ATP组相比,不同浓度α-mangostin组中p65均显著降低(P<0.05),其中以LPS/ATP+40 μmol/L α-mangostin组的降低最为明显(P<0.01),见图4A、4B。
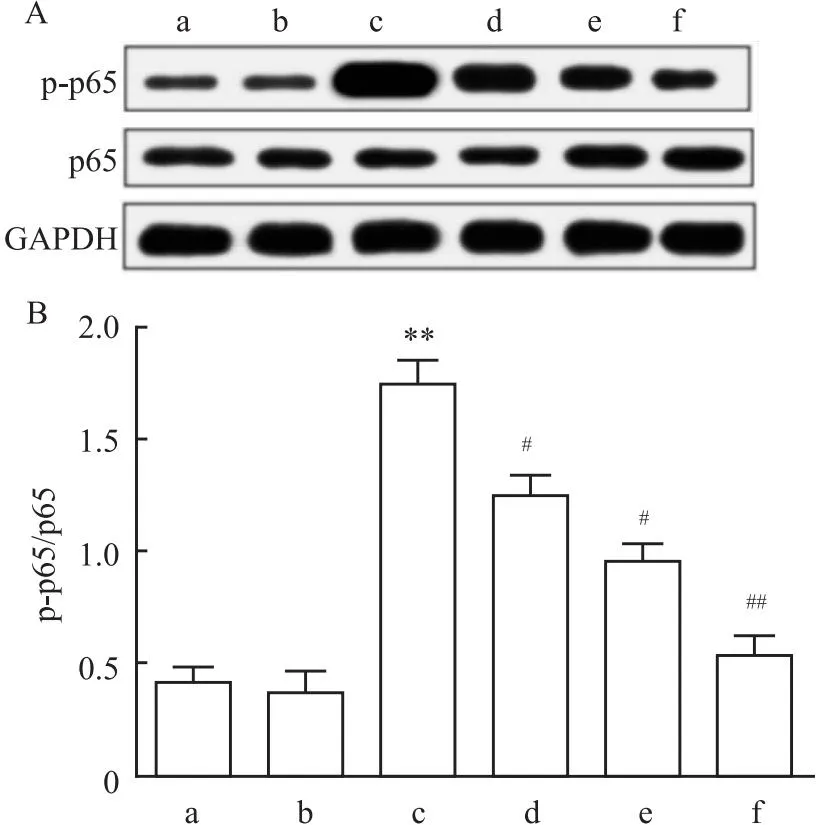
图3 各组小胶质细胞中p-p65/p65比值变化
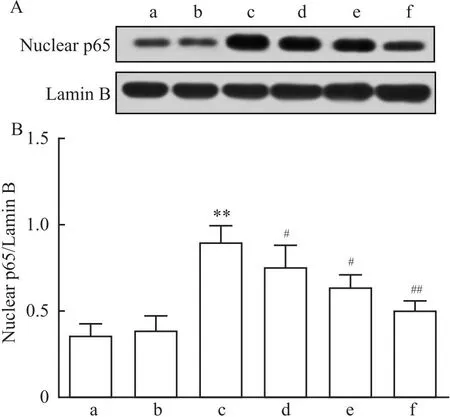
图4 各组小胶质细胞核中p65表达
3 讨论
α-mangostin具有多种生物活性和药理作用,包括可以调节NLRP3炎症小体的活性[5-6,11-12]。本研究显示,α-mangostin可通过下调小胶质细胞中NF-κB信号通路来降低NLRP3炎症小体的激活水平,从而改善LPS/ATP诱导小胶质细胞炎症反应。这表明α-mangostin可能具有改善神经炎症损伤的效果。
NLRP3炎症小体在多种炎症性疾病中起关键作用,包括神经病变和其他神经系统相关疾病。神经炎症损伤导致NLRP3的异常激活,可能与过度积聚的炎性细胞因子刺激小胶质细胞活化与增殖有关[5,13-14],然后通过引起胶质屏障形成和胶质瘢痕转化,导致神经元结构与功能的不可逆损伤[13]。本研究结果显示,通过降低NLRP3、ASC和cleaved caspase-1的表达水平,并抑制促炎细胞因子的产生,α-mangostin抑制了LPS和ATP联合诱导小胶质细胞中NLRP3炎症小体的激活。之前的研究也支持了α-mangostin调节小胶质细胞和NLRP3炎症小体的活性和功能[9,15]。因此,本研究证明了α-mangostin通过抑制小胶质细胞中的NLRP3炎症小体的激活,改善了神经炎症损伤的作用。这使得α-mangostin成为潜在的治疗神经炎症性疾病的药物选择。
NF-κB的活化是NLRP3炎症小体激活的关键[16],同时,NF-κB在小胶质细胞介导的神经炎症中也发挥着重要作用[17-19]。本研究显示α-mangostin可以显著抑制LPS/ATP作用下小胶质细胞中NF-κB信号通路的激活,并且这种抑制作用与α-mangostin的浓度相关,随着浓度的增加,对NF-κB的抑制效果越明显。这与以前关于α-mangostin抗炎作用的研究一致。例如,Guan et al[20]报道α-mangostin通过抑制LPS诱导的Toll样受体4的表达和NF-κB的激活来减轻小胶质细胞介导的神经炎症。Zuo et al[21]在佐剂关节炎大鼠模型中发现,α-mangostin可以显著降低NF-κB通路中关键蛋白的表达和磷酸化,抑制p65的核易位,从而发挥抗炎功能,改善关节病变[21]。以上研究均表明,α-mangostin可以显著抑制NF-κB的激活,从而抑制小胶质细胞中NLRP3炎症小体的活化。
综上所述,α-mangostin通过抑制NF-κB的激活抑制了小胶质细胞中NLRP3炎症小体的活化。因此,α-mangostin可改善神经炎症和小胶质细胞的炎症性损伤。α-mangostin有可能成为防治继发性脊髓损伤过程中的潜在临床药物。
