非诺多泮抑制小鼠胸主动脉瘤的实验研究
2024-05-10武栗妃杜文静曹济民
周 莹,武栗妃,3,杜文静,曹济民
胸主动脉瘤(thoracic aortic aneurysm, TAA)为胸主动脉直径是正常动脉直径的1.5倍以上,与基质降解、弹力板断裂、平滑肌表型转换、炎症浸润等密切相关[1]。TAA易并发破裂,死亡率极高,目前无有效药物[2],因此寻找治疗TAA的药物迫在眉睫。
多巴胺受体根据其生物活性和药理学性质可以分为一型受体和二型受体,一型受体包括多巴胺受体1(dopamine receptor D1, D1DR)和多巴胺受体5(dopamine receptor D5, D5DR);二型受体包括多巴胺受体2(dopamine receptor D2, D2DR)、多巴胺受体3(dopamine receptor D3, D3DR)和多巴胺受体4(dopamine receptor D4, D4DR)[3]。有研究显示激活多巴胺一型受体可通过其下游的环磷酸腺苷(cyclic adenosine monophosphate,cAMP)抑制NOD样受体热蛋白结构域相关蛋白3(NOD-, LRR- and pyrin domain-containing protein 3, NLRP3)炎症小体的活化,从而抑制炎症反应[3-4];直接抑制NLRP3也可减轻主动脉瘤[5-6]。此外,激动多巴胺一型受体也可以抑制平滑肌细胞的增殖[7]。因此,激活多巴胺一型受体可能在TAA中具有保护作用。该研究采用多巴胺一型受体激动剂非诺多泮(fenoldopam, FNDP)探究其在TAA中的作用。
1 材料与方法
1.1 实验动物雄性3周龄C57BL/6J小鼠25只,体质量9~10 g,购自山西医科大学实验动物中心[SCXK(晋)2019-0004]。小鼠购买后常规饲养3 d后开始正式实验(饲养环境为SPF级)。在实验过程中,遵循3R原则的指导,给予实验动物以人道主义关怀,伦理批准编号为SYDL2023020。
1.2 主要试剂FNDP(SML0198)和β-氨基丙腈(β-aminopropionitrile,BAPN)(A3134)购自美国Sigma公司;抗白细胞分化抗原68(cluster of differentiation 68,CD68)单克隆抗体(ab283654)、抗基质金属酶2(matrix metallopeptidase 2, MMP2)单克隆抗体(ab86607)和抗基质金属酶9(matrix metallopeptidase 9,MMP9)单克隆抗体(ab228402)购自美国Abcam公司;兔超敏二步法试剂盒(PV9001)及DAB显色试剂盒(ZLI-9019)购自北京中杉金桥生物技术有限公司; 弹力蛋白(Elastin)染色试剂盒购自福州迈新生物技术开发有限公司;明胶酶谱电泳试剂盒购自南京信帆生物技术有限公司;TRIzol 购自美国Ambion公司;RNA反转录试剂盒购自日本Takara公司;荧光定量试剂盒购自中国聚合美生物科技有限公司;RNA引物购自上海生工生物工程技术服务有限公司;PCR仪购自美国Thermo Fisher Scientific公司。
1.3 小鼠分组及TAA模型的建立将25只小鼠分为三组:对照组(n=5),饮用无菌水;BAPN组(n=10),饮用含有BAPN[1.0 g/(kg·d)]的无菌水;BAPN + FNDP组(n=10),在饮用含有BAPN[1.0 g/(kg·d)]的无菌水基础上,第14天开始每隔1 d腹腔注射FNDP(10 mg/ kg),共注射7次;对照组和BAPN组注射等体积的生理盐水。
1.4 胸主动脉组织取材及处理28 d造模结束后,用3%异氟烷对小鼠进行麻醉,打开胸腔,从心尖部灌注生理盐水将心腔及主动脉内血液冲洗掉,将心脏及主动脉及连通的肾脏取下进行拍照;然后将胸主动脉用4%多聚甲醛固定,逐级乙醇脱水,二甲苯透明,石蜡包埋,切片,并将切片贴敷于载玻片上。
1.5 Elastin染色对制备好的石蜡切片进行烤片(65 ℃,2 h)、二甲苯脱蜡、梯度乙醇复水、PBS清洗,再用碘液孵育切片5 min,PBS清洗;将硫代硫酸钠溶液滴于切片上,5 min后用流水冲洗;用醛品红染色2 min后再用水洗;用碘橙黄G染液滴染后,水洗,二甲苯透明,中性树脂封片,拍照。
1.6 免疫组化染色烘烤组织切片(65 ℃,2 h),然后脱蜡、复水、蒸馏水清洗;将切片置于100 ℃的1×柠檬酸钠溶液中20 min进行抗原修复;用无菌水清洗切片,再用内源性过氧化酶抑制剂室温孵育切片20 min,无菌水清洗,用血清室温封闭切片20 min,甩干,滴加一抗抗体,4 ℃湿盒过夜;次日将切片在室温下平衡30 min,PBS清洗;滴加辣根过氧化酶标记二抗抗体,室温孵育30 min,PBS清洗;DAB显色;之后进行苏木精染色,盐酸分化、脱水、透明、封片。
1.7 明胶酶谱用明胶酶谱法测定血清中的MMP2和MMP9的活性。收集小鼠血液,离心(1 000 r/min,10 min),获得上层血清。采用非还原上样缓冲液对血清进行制样,在含有0.2%明胶的分离胶和浓缩胶中进行电泳;胶体用A液室温摇床孵育48 h;B液37 ℃孵育5 h;考马斯亮蓝染色,脱色液脱色直到条带清晰,之后采图。
1.8 RT-PCR将获取的小鼠胸主动脉组织用TRIzol方法提取总RNA,按照反转录试剂盒方法将mRNA反转录为cDNA,之后用荧光定量PCR试剂盒进行cDNA扩增。所用引物序列见表1。

表1 引物序列
1.9 统计学处理应用GraphPad Prism 9.0统计软件对数据进行统计分析。符合正态分布的数据以均数±标准差表示,两组间比较采用两独立样本t检验,多组间比较采用方差分析;P<0.05表示差异有统计学意义。
2 结果
2.1 TAA中多巴胺受体转录水平的变化与对照组相比,给予BAPN 28 d后,小鼠胸主动脉形成瘤体,Elastin染色可见胸主动脉弹力纤维出现紊乱,见图1A、1B,提示造模成功。与对照组相比,BAPN组的D1DR、D5DR及D3DR的mRNA表达水平显著降低(D1DR:P<0.05; D5DR:P<0.01; D3DR:P<0.01);但D2DR的mRNA表达水平显著升高 (P<0.01),见图1C-1F。
2.2 FNDP对小鼠TAA进展的抑制作用与对照组相比,BAPN组小鼠胸主动脉肉眼可见膨大,见图2A箭头所示,而BAPN+ FNDP组小鼠的胸主动脉膨大程度较BAPN组小鼠明显减轻,见图2A。BAPN组10只小鼠有7只形成动脉瘤,TAA发生率为70%,7只发生死亡,其中3只因动脉瘤破裂而死亡,破裂率为30%;而在BAPN+FNDP组,10只小鼠仅有3只形成动脉瘤,TAA发生率为30%,且仅有2只死亡,其中1只因动脉瘤破裂发生死亡,破裂率为10%。对照组5只小鼠全部存活,且血管形态无异常,见图2B、2C。与BAPN组相比,BAPN+FNDP组小鼠生存率显著增高(P<0.01),见图2C。提示FNDP具有抑制TAA进展、降低TAA发生率和提高TAA生存率的作用。

图2 FNDP对小鼠TAA进展的抑制作用
2.3 FNDP对弹力纤维断裂和基质降解的改善作用弹力纤维染色结果显示,与BAPN组小鼠相比,BAPN+FNDP组小鼠的胸主动脉弹力纤维紊乱情况明显减轻,见图3A。免疫组化结果显示,各组小鼠胸主动脉组织内的MMP2(图3B、3D)和MMP9(图3C、3D)的阳性信号差异有统计学意义(MMP2:F=26.958 0,P<0.01;MMP9:F=21.041 4,P<0.01)。与对照组相比,BAPN组MMP2和MMP9表达增加(MMP2:P<0.01;MMP9:P<0.01);而相对于BAPN组,BAPN+FNDP组的MMP2和MMP9表达减少(MMP2:P<0.01;MMP9:P<0.01)。小鼠血清中的MMP2的活性检测结果显示,BAPN+FNDP组血清MMP2的活性显著低于BAPN组(P<0.05),但血清MMP9(图3E、3F)活性无显著差异(P=0.147 5)。
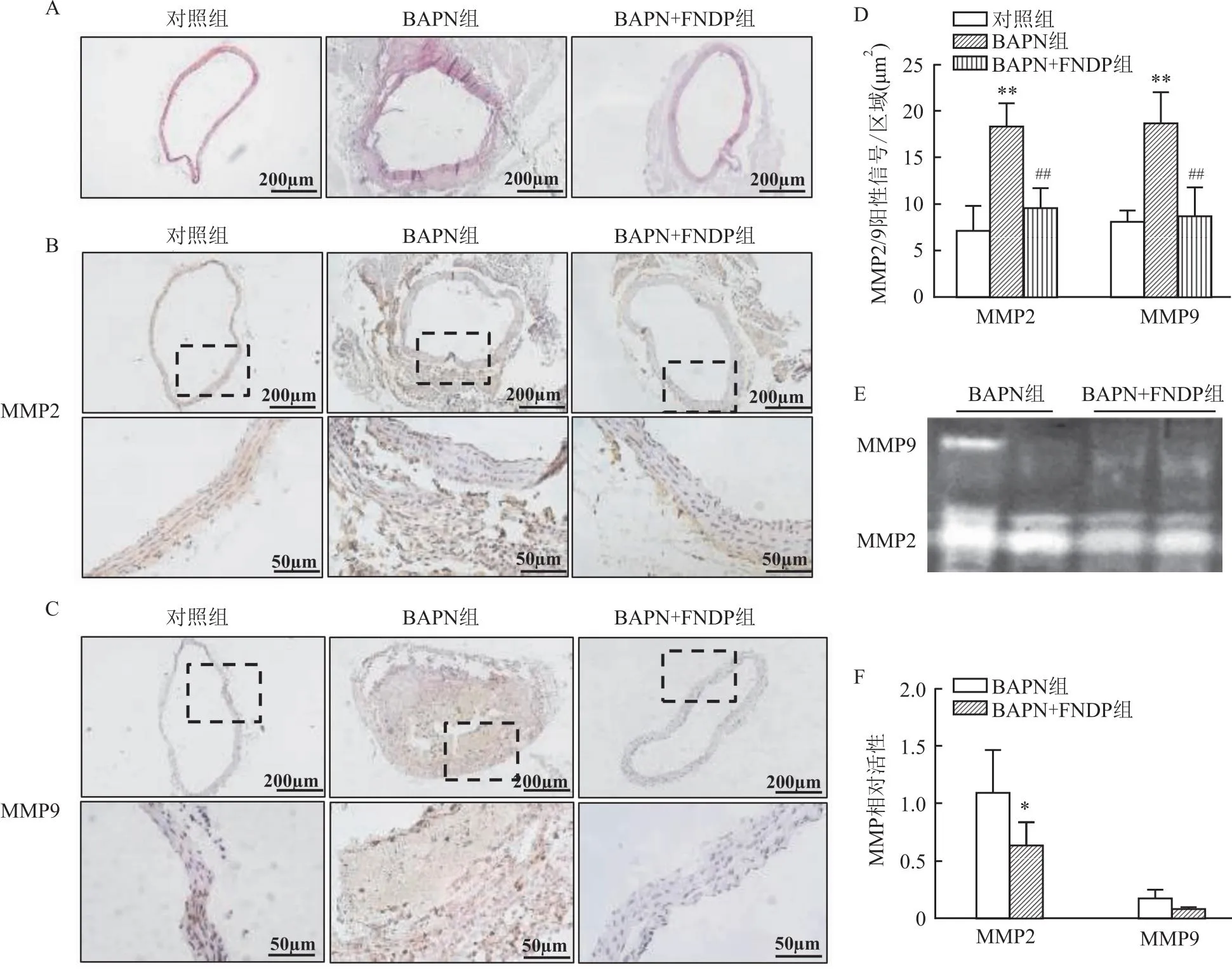
图3 FNDP对弹力纤维断裂和基质降解的改善作用
2.4 FNDP对巨噬细胞浸润和炎症因子表达的抑制作用免疫组化结果显示,各组小鼠动脉组织中巨噬细胞标志物CD68的表达(图4A、4B)差异有统计学意义(F=43.3171,P<0.01)。相比于对照组,BAPN组CD68表达增加(P<0.01);而相较于BAPN组,BAPN+FNDP组CD68表达明显降低(P<0.01)。
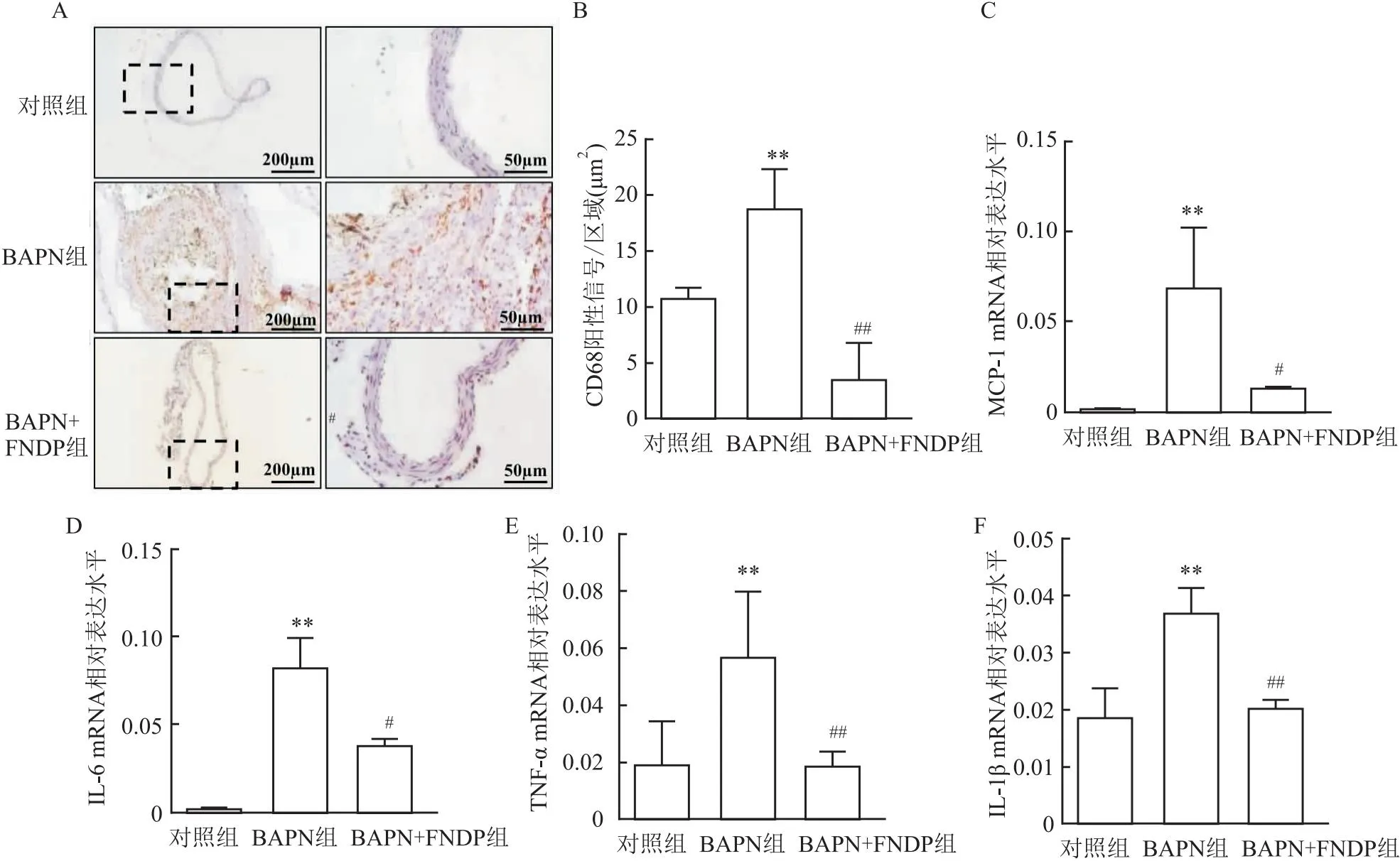
图4 FNDP对巨噬细胞浸润和炎症因子表达的抑制作用
RT-PCR结果显示,各组小鼠动脉组织中炎症因子的表达(图4C-4F)差异有统计学意义(MCP-1:F=17.757 5,P<0.01;IL-6:F=102.046 0,P<0.01;TNF-α:F=13.632 3,P<0.01;IL-1β:F=30.139 4,P<0.01)。与对照组相比,BAPN组小鼠动脉炎症因子MCP-1、IL-6、TNF-α、IL-1β水平明显增加(MCP-1:P<0.01; IL-6:P<0.01;TNF-α:P<0.01; IL-1β:P<0.01);而与BAPN组相比,BAPN+FNDP组小鼠动脉炎症因子MCP-1、IL-6、TNF-α、IL-1β的水平下降 (MCP-1:P<0.05; IL-6:P<0.05;TNF-α:P<0.01; IL-1β:P<0.01)。
2.5 FNDP对TAA平滑肌细胞收缩表型的影响动脉平滑肌细胞在正常功能状态下表达收缩蛋白,如α-SMA和SM22α。RT-PCR结果显示(图5),各组小鼠动脉组织中α-SMA的表达差异有统计学意义(F=10.756 4,P<0.01),然而SM22α表达差异无统计学意义(F=3.352 3,P=0.087 6)。相比于对照组,BAPN组α-SMA和SM22α的表达显著下降(α-SMA:P<0.01;SM22α:P<0.05);然而,相较于BAPN组,FNDP + BAPN组中α-SMA和SM22α的表达无显著差异(α-SMA:P=0.128 5;SM22α:P=0.094 3)。

图5 α-SMA和SM22α 的mRNA相对表达水平
3 讨论
FNDP在不同的疾病中均表现出抗炎作用。Joseph et al[8]发现腹腔注射FNDP可减轻糖尿病内毒素小鼠的高血糖和全身炎症反应;Amatya et al[9]发现FNDP可降低肾脏细胞内的氧化应激和炎症反应;之前的研究[10]也显示FNDP可激动巨噬细胞膜上的多巴胺一型受体,使胞内cAMP生成增多,继而抑制巨噬细胞的炎症因子表达,缓解心衰小鼠心肌早期炎症。在本研究中,FNDP抑制了TAA管壁巨噬细胞的浸润,降低了炎症因子的产生,而炎症反应是TAA的一个重要病理特征,这提示FNDP可能通过减轻炎症反应从而减缓TAA的进展,但对于减缓TAA是否通过cAMP及其下游信号分子仍待进一步研究。
细胞外基质成分包括蛋白聚糖、糖蛋白、层粘连蛋白、胶原蛋白和弹性板等,这些蛋白共同维持着血管壁的弹性[11]。MMP2和MMP9可以降解细胞外基质,炎症细胞释放的炎性因子会刺激动脉壁使得MMP9的表达量增加[1]。此外,有研究[12]显示可通过D5DR调节多巴胺信号转导通路使得脑肿瘤中MMP9表达降低。在本研究中,小鼠腹腔注射FNDP后,细胞外基质降解减缓可能与炎症反应的减轻有关,也可能与FNDP激活多巴胺一型受体信号通路密切相关,这可能是FNDP在TAA中具有保护作用的机制。
平滑肌细胞可以在收缩表型和合成表型之间转换。收缩型平滑肌细胞会表达高水平的收缩蛋白,包括α-SMA和SM22α等;平滑肌细胞在受到刺激的情况下会转换为合成表型。在TAA中,平滑肌细胞会由收缩表型转化为合成表型,这意味着平滑肌细胞收缩蛋白的表达减少,对于主动脉壁强度和正常收缩功能的维持不利[1, 13]。本研究在BAPN诱导的TAA中,主动脉平滑肌细胞收缩蛋白α-SMA和SM22α显著降低,与文献[14]报道一致。过往研究[7, 15]显示激动多巴胺一型受体可以通过硫化氢影响小鼠平滑肌细胞的增殖,本研究表明FNDP对平滑肌收缩蛋白α-SMA和SM22α无显著影响。这提示FNDP对TAA进展的减缓可能与平滑肌细胞向收缩表型转化无关。
