负载单宁酸的双层壳聚糖屏障膜的制备及其生物相容性的研究
2024-05-10杨肖念邹多宏
杨肖念,邹多宏,2
糖尿病、牙周炎和骨质疏松症等疾病患者,其骨缺损常伴随着高活性氧(reactive oxygen species,ROS)水平环境,会损害口腔种植体植入后的骨整合,不利于口腔种植术后获得良好预后[1]。引导骨再生(guided bone regeneration,GBR)技术在临床实践中已被广泛用于治疗口腔颌面部骨缺损,是实现成骨最有效、最可靠的方法之一。 GBR 膜充当机械屏障,阻止快速生长的非成骨细胞(如上皮细胞和成纤维细胞)进入骨缺损,并为缓慢生长的成骨细胞的增殖和分化提供空间,从而促进骨再生[2]。在高 ROS 水平的环境中,过量的 ROS 激活破骨细胞的形成,并阻碍骨髓间充质干细胞向成骨细胞的分化,从而不利于骨愈合[3]。该研究使用壳聚糖(chitosan,CS),通过蒸发干燥和取向冷冻制备出具有光滑致密、粗糙疏松多孔的双层屏障膜,同时负载单宁酸(tannic acid,TA),使其兼备可降解性、生物相容性、抗菌性和 ROS 清除作用,探究其作为 GBR 膜使用的可行性。
1 材料与方法
1.1 合成材料中粘度壳聚糖(200~400 mPa.s,上海阿拉丁生化科技股份有限公司),冰醋酸(上海国药集团化学试剂有限公司),单宁酸(上海麦克林生化科技股份有限公司)。
1.2 主要试剂和仪器氨水(上海国药集团化学试剂有限公司),吗啉乙磺酸一水合物(MES)、4-羧基苯硼酸(上海麦克林生化科技股份有限公司), 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)、 N-羟基琥珀酰亚胺(NSH)(上海阿拉丁生化科技股份有限公司), 1, 1-二苯基- 2 苦基肼(DPPH)(北京索莱宝科技有限公司), α-MEM、胰酶消化液、青霉素-链霉素溶液(上海碧云天生物技术有限公司);活死细胞染色试剂盒(美国 Proteintech 公司);胎牛血清(美国 Gibco 公司); CCK-8 试剂(日本同仁公司)。酶标仪、二氧化碳孵育箱(美国 Thermo 公司);扫描电子显微镜(Supra 40,德国蔡司公司);高温高压灭菌锅[致微(厦门)仪器有限公司];傅里叶红外光谱仪(Nicolet 8700, 美国热电尼高力仪器公司);冷冻干燥机(宁波新芝生物科技有限公司)。
1.3 方法
1.3.1CS双层膜制备 称取2 g壳聚糖放入100 ml 0.2 mol/L冰醋酸水溶液中,磁子搅拌至溶解,离心除泡,倒入方形培养皿中,放在 40 ℃ 加热台上24 h后自蒸发成膜,取出后放入氨水中浸泡除酸,去离子水冲洗几遍后置于 40 ℃加热台上,干燥后备用。将干燥后的 CS 膜平铺在铜板上,滴加2%的CS溶液,刮刀刮平,放入液氮中, 10 s后取出,放入冷冻干燥机中冷冻干燥48 h以获得CS双层膜。
1.3.2CS@TA双层膜的制备 CS双层膜接枝TA前预处理:配制 0.1 mol/L 的 MES 溶液 100 ml,pH=6,分别加入1 g 4-羧基苯硼酸、 100 mg NSH和200 mg EDC后调节pH至 7.5, 30 min 后加入 1 g CS 双层膜,磁子搅拌6 h,结束后用去离子水冲洗薄膜以去除表面未反应的4-羧基苯硼酸。
CS 双层膜接枝TA:取出分别放入浓度为0.02%、0.04%、0.08%、0.16% 50 ml 水溶液中,放入37 ℃摇床6 h,结束后用去离子水冲洗薄膜以去除表面未反应的TA,最终以获得负载不同含量TA的双层壳聚糖屏障膜,根据负载TA含量分别记为CS@TA1、CS@TA2、CS@TA3、 CS@TA4, CS双层膜接枝TA前预处理、未接枝TA的CS双层膜记为 CS@TA0),结束后将各组双层膜临界点干燥后真空储存以备后续使用。其中,根据各组实验结果,挑选出CS双层膜上最佳TA负载量组的双层膜记为CS@TA。
1.3.3结构表征 低真空下喷金后使用扫描电镜在15.0 kV的加速电压下拍摄样品的光滑面、粗糙面与截面,取 CS、 TA 粉末和 CS@TA0、 CS@TA1、 CS@TA2、CS@TA3、 CS@TA4各组双层膜采用傅立叶变换红外光谱仪分析各成分。
1.3.4DPPH·自由基清除实验 按照试剂盒使用说明配制DPPH工作液,将 CS@TA0、CS@TA1、CS@TA2、CS@TA3、CS@TA4双层膜制备成直径5 mm的圆形样品,分别放置于48孔板中,每孔加入200 μl DPPH工作液,Blank组只加200 μl DPPH工作液,37 ℃避光孵育30 min后取出,将48孔板内的液体转移至96孔板中,使用酶标仪读取在517 nm处的吸光度值。吸光度值记为A,根据公式DPPH清除率=[A空白-A(CS@TA0、CS@TA1、CS@TA2、CS@TA3、CS@TA4)]/A空白×100计算各组双层膜的 DPPH·自由基清除效率。
1.3.5细胞生物相容性实验 将CS@TA0、CS@TA3、CS@TA4双层膜制备成直径5 mm的圆形样品,经高温高压消毒灭菌。
CCK-8 细胞毒性检测:在48孔板内接种细胞,每组每个时间点3个复孔,每孔接种5×103个 MC3T3-E1细胞。接种24 h后加入各组双层膜,Blank组不加双层膜材料仅使用培养基培养,此后每 3 d 换液1次。在1、4、7 d 时分别取出各组双层膜,弃去培养基,使用 PBS 清洗2次,每孔加入 CCK-8 溶液(CCK-8 ∶α-MEM=1 ∶9) 200 μl , 37 ℃孵2 h后将48孔板内孵育后的液体转移至96孔板,每孔100 μl,使用酶标仪读取每孔在450 nm处的吸光度值。
细胞活力检测:在48孔板内每孔接种1×104个MC3T3-E1细胞,每组3个复孔,接种24 h后加入各组双层膜,Blank组不加双层膜材料仅使用培养基培养,此后每3 d换液1次。在1、4、7 d时分别取出各组双层膜,弃去培养基,PBS 清洗2次,后按照活死细胞染色试剂盒使用说明进行染色操作,使用荧光显微镜进行观察。
细胞黏附实验:将CS@TA3双层膜制备成直径10 mm的圆形样品。在每个样品的粗糙面上接种2×104个MC3T3-E1,24 h后,PBS清洗3次,用4%多聚甲醛固定样品30 min后 PBS 清洗3次,使用扫描电镜拍摄样品。
1.3.6抗菌实验 分别将CS@TA0、CS@TA3、CS@TA4双层膜制备成直径10 mm的圆形样品,经高温高压消毒灭菌。金黄色葡萄球菌(S.aureus)菌液浓度为1.777×108CFU/ml,大肠埃希菌(E.coli)菌液浓度为2.55×108CFU/ml,分别将菌液稀释1 000倍后取10 μl加入放有双层膜的24孔板中,每组3个复孔,Blank组直接加入孔板内,每组加入500 μl肉汤吹打均匀后,取出后孔加入500 μl PBS,超声3 min,每孔取出100 μl分别涂抹均于琼脂板上,放入37 ℃细菌培养箱24 h后观察和计数每个琼脂板中的菌落数。
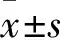
2 结果
2.1 样品表征扫描电镜可见CS双层膜光滑面表面致密光滑(图1A、1B),粗糙面疏松多孔(图1C、1D),截面可见粗糙面呈纵向有序多孔(图1E、1F);从FTIR光谱中, CS@TA0 是未负载单宁酸的纯壳聚糖双层膜,其酰胺I基团位于1 650 cm-1处,酰胺 II基团位于1 590 cm-1处,TA 中的羧基吸收峰位于1 707 cm-1,苯环中的C=C吸收峰位于 1 613 cm-1,当 TA 通过4-羧基苯硼酸接枝到CS双层膜后, TA中的羧基由原来的1 707 cm-1向左偏移至 1 725 cm-1,峰强度减弱。苯环中C=C由原来的 1 613 cm-1向右偏移至1 555 cm-1,且形成的峰强度与CS酰胺II基团处的峰相延续,形成较宽且弱的峰形,CS中的酰胺 I 基团由原来的 1 650 cm-1位移至1 654 cm-1,酰胺II基团特征峰被TA中苯环中C=C拉伸振动掩盖,由此证明TA成功负载到CS上(图1G、1H,其中1H为1G图中部分放大图)。

图1 扫描电镜下CS@TA双层膜的微观结构
2.2 DPPH·自由基清除率未负载TA 的CS@TA0组, DPPH·自由基清除率仅为13.93,其中负载TA的各组CS@TA1、CS@TA2、CS@TA3、CS@TA4各组清除率分别可达到84.80%、87.44%、91.31%、91.30%,与CS@TA0 组相比差异有统计学意义(F=832.6,P<0.000 1)(图2A); DPPH 溶液在浸泡各组双层膜30 min后,颜色由紫色变为淡黄色,表明DPPH溶液中的电子与TA的氢原子完全配对,并形成还原的DPPH(图2B)。根据DPPH·自由基清除率结果,选取清除效率较高的CS@TA3、CS@TA4两组负载TA的双层膜继续后续实验。

图2 不同TA负载量的CS@TA双层膜的DPPH自由基清除率
2.3 CS@TA双层膜体外生物相容性CCK-8法检测结果显示,双层膜与细胞共培养1、4、7 d后CS@TA0、CS@TA3与Blank组吸光度值无明显差异,CS@TA4 组1、4、7 d时与Blank 组相比吸光度值差异有统计学意义(F=16.84,P=0.001 9;F=589.8,P<0.000 1;F=839.3,P<0.000 1),但在 4、7 d时的细胞存活率明显低于80%,不具有良好的生物相容性,不适宜作为双层膜的备选材料(图3A);MC3T3-E1 细胞接种到CS@TA3双层膜的粗糙面上24 h,扫描电镜结果表明细胞可以较好地黏附在CS@TA3双层膜的粗糙面上(图3B、3C);活死细胞染色结果如图3显示,活细胞为绿色荧光,死细胞为红色荧光,CS@TA0、CS@TA3组与Blank组的活死细胞比例无明显差异,CS@TA4组显示与Blank组相比有较多的死细胞存在,且活细胞数量明显较少(图3D)。

图3 CS@TA 双层膜的生物相容性
2.4 CS@TA双层膜体外抗菌性能与 Blank、CS@TA0组相比,CS@TA3组的E.coli和S.aureus细菌稀释涂板结果显示细菌菌落数明显减少(图4A),菌落计数统计结果显示与Blank组菌落数相比,CS@TA0(E.coli:F=166.3,P=0.000 2;S.aureus:F=61.82,P=0.001 8)和CS@TA3组(E.coli:F=166.3,P<0.000 1;S.aureus:F=61.82,P<0.000 1)的菌落数显著减少,差异有统计学意义(图4B、4C)。

图4 CS@TA双层膜对E.coli和S.aureus的抗菌性能
3 讨论
GBR技术已在临床广泛使用,它是利用在骨缺损部位植入屏障膜,阻碍上皮细胞及结缔组织长入缺损区,达到屏障作用,以促进缺损部位骨组织的修复与再生。目前临床上使用的屏障膜分为可吸收和不可吸收两种,不可吸收性屏障膜需要二次手术取出,给患者带来二次创伤,同时术后增加了感染风险;而可吸收性屏障膜术后无需取出,术后可在体内缓慢吸收降解,但其机械强度低,缺乏抗菌能力,使其使用仍受到限制[4-6]。此外临床使用的商用 GBR 屏障膜缺乏一定的抗菌和ROS清除能力[6]。
葡萄氨聚糖是胞外基质的重要成分,具有维持细胞结构稳定、调节细胞活性的功能。壳聚糖作为胞外基质成分葡萄氨聚糖的结构类似物,不仅具有良好的生物活性、生物可降解性和亲水性,还具有一定的抗菌性能,可以抑制某些细菌的生长,这种特性使得壳聚糖可以应用于制备抗菌材料、药物缓释系统等领域。据报道壳聚糖可增强细胞黏附、增殖、成骨细胞分化和矿化,这些特性使得壳聚糖在组织工程、再生医学等领域具有广泛的应用前景[7]。骨缺损常伴有ROS水平升高的问题,这意味着在受损骨组织中存在过多的ROS物质,如超氧阴离子、过氧化氢和羟自由基等,这些ROS物质会引发氧化应激反应,导致细胞内氧化还原平衡失调,诱导成骨细胞和骨细胞凋亡和坏死。这些损伤会导致骨细胞数量减少和功能下降,抑制间充质细胞的成骨分化,从而延迟骨重建。间充质细胞是一种具有多重分化潜能的干细胞,可以分化为骨细胞、软骨细胞或脂肪细胞等[8-9]。TA是一种具有丰富酚羟基的植物衍生多酚,由于存在多个具有还原性的酚羟基被广泛认为是一种抗炎、抗菌和抗氧化剂[10]。
本实验通过蒸发干燥、取向冷冻及冷冻干燥技术制备出具有光滑致密层和疏松多孔的双层CS屏障膜。光滑致密层朝向软组织方向,可有效阻止上皮和结缔组织长入骨缺损区,为骨再生和修复提供空间;疏松多孔层朝向骨缺损方向,为成骨相关细胞提供黏附位点。在此基础,在CS双层膜上先接枝4-羧基苯硼酸后使其具有硼酯键,通过硼酯键与TA结合得到CS@TA双层膜并形成ROS响应性药物桥接连接体。在遇到高水平ROS时,硼脂键发生断裂,TA从CS双层膜中解离缓慢释放TA清除过多ROS。 DPPH·自由基清除率结果表明CS@TA双层膜具有较高的ROS清除效率。体外细胞实验结果表明,具有一定TA负载量的CS@TA双层膜具有良好的生物相容性;抗菌实验结果表明,CS@TA双层膜对E.coli和S.aureus均有一定的抑制效果。以上实验结果表明,CS双层膜通过双层结构设计兼具了屏障和促细胞黏附迁移功能,具有良好的生物安全性,同时通过修饰 TA 不仅赋予了 CS@TA双层膜的良好ROS清除功能,还增强了其抗菌作用。
