鸡新城疫商业化疫苗研究进展
2024-05-09王蒙蒙
王蒙蒙,金 鑫
(延边大学农学院,吉林延吉 133002)
新城疫(Newcastle disease,ND)于1926年首次发现于印度尼西亚,同年在英国新城发现病例[1]。该病是由新城疫病毒(Newcastle disease virus,NDV)感染禽类动物的一种高度接触性传染病,以感染鸡、火鸡为主,也可感染人。其典型特征是病程短、常呈急性败血症经过、发病率和病死率高,对呼吸道、消化道损伤明显,有时伴随神经症状出现。ND的流行不仅对养鸡业造成毁灭性打击,也会对国家经济发展带来严重的威胁[2]。1946年我国首次分离出ND毒株并证实此前ND就已经在国内流行[3]。在经过国内外科研人员不断努力下,ND疫苗研发已经取得了一些科研成果,本综述将对ND商业化疫苗的研究进展分别介绍,以期为商业化ND疫苗的研究提供参考。

表1 全球新城疫流行历史
1 鸡新城疫病毒分子流行病学
新城疫病毒(NDV)是一种有囊膜的非片段线性单股负链RNA病毒,属于副黏病毒科(Paramyxoviridae)副黏病毒亚科(Paramyxovirinae)禽腮腺炎病毒1型(Avianorthoavulavirus1)。目前NDV基因组有3种长度的碱基数,分别是15 186 nt、15 192 nt、15 198 nt[4],编码6种类型的特异性结构蛋白见图1,2种非结构蛋白分别是V蛋白与W蛋白,基因组结构为3′-NP-P-M-F-HN-L-5′[5]。依据鸡胚(embryonated chicken eggs,ECEs)平均死亡时间和脑内致病性指数,NDV的致病性可以分为缓发型、中发型、速发型。根据基因组的大小以及对F基因序列的演变进化分析,已知目前分离的NDV毒株分为Class Ⅰ和Class Ⅱ两大类,其中基因型多达21种[6]。中国、韩国等亚洲国家流行的强毒株主要是ClassⅡ中的基因Ⅶ型,基因Ⅸ型为我国特有的毒株基因型,非洲主要流行基因Ⅱ型、Ⅵ型和Ⅶ型[7]。

图1 新城疫病毒的分子结构
NDV具有多嗜性,主要存在于组织器官中。NDV感染宿主细胞的过程大致如以下几个步骤:吸附、膜融合或内吞、转录翻译、修饰释放(图2)。病毒的囊膜表面的HN蛋白具有生物活性,可与宿主细胞表面的唾液酸受体吸附识别[4,8-9]。NDV致病机制复杂,感染宿主细胞的同时也会引起其他疾病继发感染,这种混合感染模式较为复杂,对疫苗的研究带来了巨大挑战。
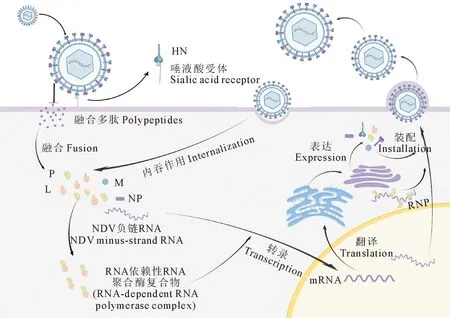
图2 NDV感染宿主细胞的机制
2 鸡新城疫的临床特征
鸡在感染NDV后,由于毒株毒力、日龄等因素,在临床上会呈现出发病速度、病死率等差别。典型的ND症状分为最急性型、急性型、亚急性或慢性型,其中最急性型常发生于流行早期,主要症状为突然性死亡,无明显症状;急性型较为常见,主要症状为高温、精神萎靡、鸡冠发绀等,个别病鸡会出现内脏、呼吸道、消化道等方面的疾病特征;亚急性或慢性常见于流行后期,主要特征为产蛋下降、腹泻等。非典型ND的临床症状主要为病死率低;雏鸡症状明显,多数出现神经、呼吸道疾病以及产蛋量下降;症状不明显,故很难做到及时医治。ND的流行不受季节影响;传播能力强,传播速度快;混合感染与非典型临床症状等特点都会为疫情监测、防控和清除工作带来巨大挑战。在严峻复杂的防控形势下,除了制定严格的预防措施外还需要进一步重视免疫疫苗的研制,接种ND疫苗仍是控制疫情流行的有效措施之一。近年来,随着分子免疫学和疫苗学的发展,ND疫苗在给药途径、佐剂等方面取得一定的成果,我国的ND流行也得到了一定的控制,但免疫失败的现象依然发生,因此研发安全有效的商业化疫苗至关重要。
3 商业化疫苗
3.1 灭活疫苗
目前对商业化ND疫苗已经取得一定的进展,ND载体疫苗、灭活疫苗以及减毒活疫苗是目前市场上应用广泛的ND疫苗。灭活疫苗(inactivated vaccine)通常是指为诱导高水平的体液免疫,将ECEs内接种毒株的尿囊液利用福尔马林或β异内醇反复多次灭活,使其能够保持免疫原性,再与佐剂结合而制成的疫苗[10]。ND灭活疫苗是目前应用较为广泛的一类疫苗,具有安全性高,免疫持续时间长,储存方便等优点。目前ND灭活疫苗的研究主要集中在Ⅰ系Mukteswar等中等毒株、Ⅳ系La Sota等弱毒株,基因Ⅶ型A-Ⅶ株,Queensland V4和Ulster 2C等毒株上(表2)。在我国,接种疫苗后,机体内病毒脱落显著减少是测试ND疫苗有效性的重要指标。我国高校团队研发出基因Ⅶ型ND灭活疫苗(A-Ⅶ株),接种后21 d机体内HI抗体效价标准提高显著,保护率相较于普通ND疫苗株明显提高,同时机体脱毒减少,免疫次数减少,免疫应激减轻,有效解决了基因匹配问题同时生产性能和经济效益得到保证[11]。由韩国团队开发的灭活疫苗KBNP-C4152R2L株(基因型Ⅶ型)接种后,诱导机体产生的保护作用优于La Sota株[12]。灭活毒株生产的疫苗需要在佐剂的配合下使用,因为佐剂形成的贮库效应可以延缓免疫原在机体内的释放速度,持续刺激机体,增强抗原特异性免疫应答,最终达到免疫效果[13-14]。近些年,应用较为广泛的佐剂主要是白油佐剂、蜂胶和铝盐佐剂等。白油佐剂是一种油包水型淡黄色乳液,在机体内留存时间长,但会引起机体炎症症状或表面溃疡,其代谢速率慢,能够对鸡肉品质造成影响,此外为了减小这些不利影响,在原佐剂的基础上配比2~10 mg/mL左旋咪唑,接种后的免疫效果会明显提高[13,15]。常见的铝盐佐剂带来的副作用严重,黏度大,机体不易吸收疫苗,故新型无铝油性佐剂的研发更适合应用于ND疫情防控。佐剂的应用增加了灭活疫苗的生产成本,同时佐剂的选择也会直接影响疫苗的免疫效力。

表2 新城疫的灭活疫苗
由于养鸡场的集约化饲养,流行毒株与常见的疫苗毒株之间基因型匹配程度低,抗原性差异显著,接种疫苗后仍有大量病毒被释放,增加了非典型ND流行的风险,同时提高了继发感染或混合感染的机率[16]。在通常情况下,ND与禽流感(Avian influenza,AI)、传染性支气管炎、禽腺病毒感染、传染性法氏囊病、减蛋综合征等中的一个或多个传染病同时感染,不仅会降低养殖效益,还会对经济造成巨大损失。研发“一针防多病”的多价苗或多联苗可降低人工成本[17]。灭活疫苗需要在减毒活疫苗初次免疫后进行应用[18]。目前选择适宜的灭活疫苗佐剂以及免疫调节剂是ND灭活疫苗下一步研发的重点。
3.2 减毒活疫苗
减毒活疫苗是指将无特定病原体(specific pathogen free,SPF)ECEs内的尿囊液接种毒株进行增殖培养,再加入稳定剂冻干制成的疫苗[10]。目前减毒活疫苗主要分为传统减毒活疫苗和基因工程减毒活疫苗,其中传统减毒活疫苗分为自然弱毒株和人工传代弱毒株,ND减毒活疫苗株包括Ⅰ系、Ⅱ系、Ⅲ系、Ⅳ系及克隆株(表3)。其中Ⅰ系疫苗(主要为Mukteswar株)毒力较强,且免疫期长,可导致产蛋鸡的产蛋量下降,蛋壳变软,雏鸡死亡等症状,理论上只能用于成年鸡群的紧急接种或加强免疫,然而由于存在生物安全隐患问题,2017年Ⅰ系疫苗被包括我国的多个国家相继禁用[19]。
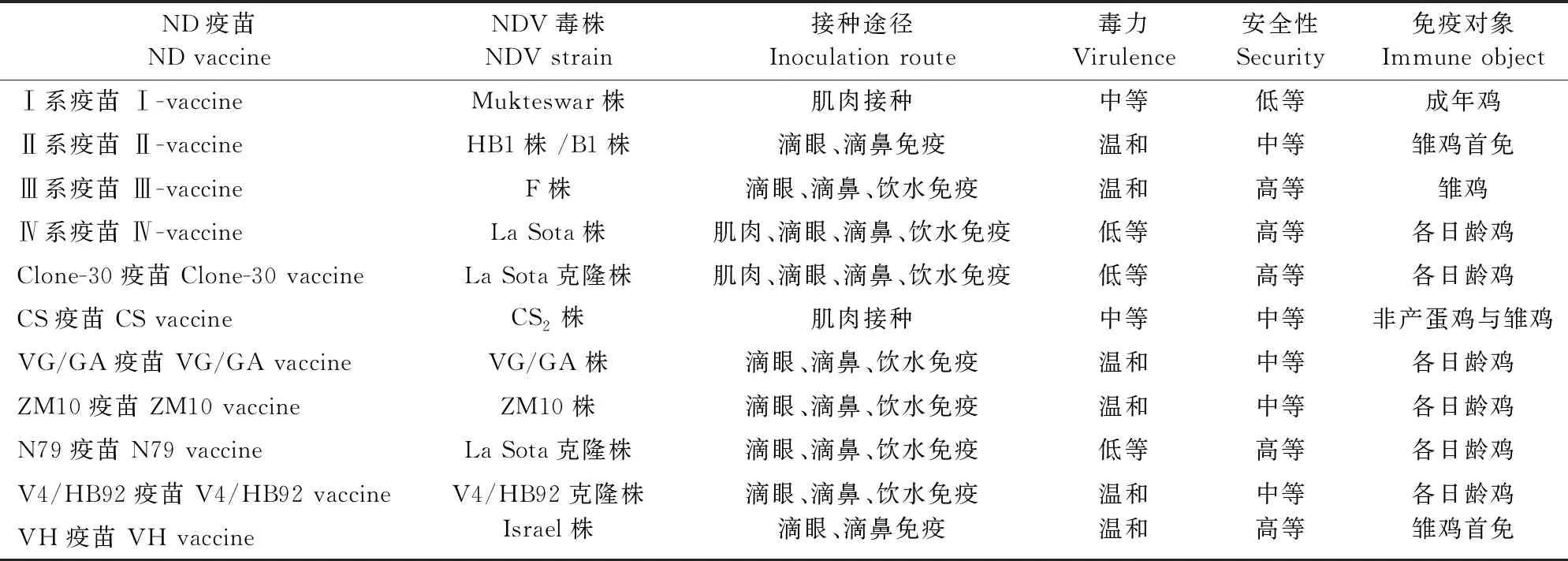
表3 新城疫减毒活疫苗
减毒活疫苗需要冷链运输及处理,V4 株、I-2株和La Sota株等热稳定型疫苗在特定温度下都具备最低滴度和最长保质期[20]。此外,50%胚胎感染剂量(50% embryo infection dose,EID50)是评估减毒活疫苗的抗体滴度和效力的关键指标,保护效力与疫苗接种剂量密切相关,106EID50是能够完全保护机体和减少病毒脱落的最低剂量[10]。与灭活疫苗相似,减毒活疫苗La Sota株与流行毒株基因型Ⅶ型之间F和HN蛋白氨基酸同源性分别为89%和 87%左右,存在抗原差异性与遗传变异性质[21]。目前存在两种可行性方案,第一种是通过反向遗传学技术定点诱变基因Ⅶ型G7毒株内的L蛋白基因特异性突变,替换F切割位点序列,使强毒致弱,获得的候选疫苗G7M诱导鸡产生同源抗体抵御基因Ⅶ型强毒攻击,保护率可达100%[22]。第二种方案是利用PCR扩增技术增加HN蛋白长度,在F切割位点序列定点突变并修饰来减弱毒力,插入特殊密码子保证其遗传稳定性,最终获得的疫苗株可以完全保护鸡体免受相应强毒株的攻击[23]。
3.3 载体疫苗
载体疫苗是指利用基因工程技术将目的基因重组到特定载体病毒的基因组上,从而获得能够表达出外源基因的重组活载体病毒疫苗。载体疫苗相较于灭活疫苗、减毒活疫苗而言优势在于能够表达多个目的基因,同时预防多个疾病,能以半复制的形式递呈给宿主,同时诱导产生体液免疫、细胞免疫以及黏膜免疫,提供的保护作用时间长,安全性高,稳定性显著[10]。通过选用鸡痘病毒(Fowlpox virus,FPV)、火鸡疱疹病毒(Turkey herpesvirus,HVT)、新城疫病毒(NDV)等载体表达F基因、HN基因等保护性目的基因构建ND活载体疫苗,诱导机体产生特异性免疫应答[19]。
FPV是目前已知的最大的动物病毒,基因容量大,利于操作,能高效表达出多种外源基因,并且具有较高的安全性,已经广泛用于各类表达载体。在FPV载体中分别插入NDV-F基因和鸡传染性喉气管炎病毒(Infectious laryngotracheitis virus,ILTV)gB基因来表达rFPV-gB-F重组抗原,免疫28日龄 SPF鸡30 d后,分别用NDV强毒株和ILTV强毒攻击,保护率均达到80%以上,对NDV免疫保护期为2个月,对ILTV免疫保护期为5个月[24]。一般情况下,以FPV为载体的ND重组活载体疫苗接种方式是以皮下接种和刺种为主,FPV载体疫苗对肉鸡体重有轻微影响,这就意味着此类疫苗的接种范围会受到限制。
作为一种在全球广泛应用的新兴载体,HVT也是一种较为理想的载体,能包含多种保护性基因,以期同时预防多种疾病,rHVT-ND载体疫苗可大规模接种,受母源抗体影响较小,能够诱导机体产生细胞免疫和体液免疫,并产生终身免疫的双重保护作用。研发的Vectormune®ND是一种高效的抗异型基因型Ⅶ.1.1速发型毒株的疫苗,是利用HVT载体表达基因型Ⅰ型NDV-F蛋白,构建出的重组载体活疫苗,可诱导机体产生抵御基因型Ⅶ.1.1速发型毒株攻击的完全临床保护作用,肌肉注射或滴鼻免疫两种攻毒途径达到相似效果,但肌肉注射与滴鼻免疫相比,前者更显著减少病毒脱落[25]。rHVT-ND载体疫苗与传统疫苗联合应用经滴眼免疫途径接种SPF雏鸡,结果显示对基因型Ⅶ型毒株的具有100%的保护作用,几乎可以提供完全临床保护,且毒株通过口鼻和泄殖腔途径的脱落显著减少[26]。但rHVT-ND载体疫苗需要在冷链或液氮中储存,并要求在解冻后1 h内施用,另外需要连续接种免疫至少28 d才能够使机体达到完全免疫的效果[12]。
NDV自身就是一种很有前景的载体。NDV复制过程是在胞浆中完成,与宿主细胞发生基因交换与重组的概率低,安全性高,稳定性好;病毒基因组大,易于嵌入外源基因片段,操作方便高效;NDV更易于在ECEs以及体内的呼吸道和消化道内增殖,且表现出病毒滴度高特征,可诱导机体产生黏膜免疫、体液免疫和细胞免疫,适用于大规模生产和接种。目前已有以NDV为载体的AI重组活载体疫苗进行商业化生产,对国内高致病性AI疫情防控起到推动作用。在NDV载体中插入人工标记目的基因,将构建出的活载体疫苗接种鸡群,可以用来鉴别ND毒株自然感染和疫苗免疫接种的鸡群[27]。但NDV载体疫苗在体内的实际效力受母源抗体的影响,这也是阻碍其发展的障碍,也是未来需要克服的一大难题。
4 纳米疫苗
纳米疫苗(Nano-vaccine)是指以纳米颗粒材料为载体,将抗原或免疫调节剂呈递给特定的靶细胞,通过靶向传送或者利用自身免疫刺激特性来达到诱导机体产生特异性免疫反应的目的。作为未来疫苗研究中的一颗冉冉升起的新星,高效稳定、安全精准的纳米疫苗被广泛应用研究。
目前纳米颗粒载体主要分为病毒样颗粒(Virus-like particles,VLPs)、自组装蛋白纳米颗粒、聚合物纳米颗粒、无机纳米颗粒4类[28]。Pushko P等[29]制备了AI病毒H5N1、H7N3和H9N2这3种亚型血凝素蛋白的VLPs,并利用杆状病毒表达系统表达出了H5/H7/H9/N1/gag VLPs蛋白,在高致病性AI的攻毒试验中,与空白对照组相比,试验组全部存活;在低毒攻击下,也检测到机体所产生的特异性免疫应答,表明了以VLPs为载体的纳米疫苗有望成为AI疫苗的一种前景。Dwivedi V等[30]研制了可降解的聚合酶纳米颗粒PLGA,将其包裹猪繁殖与呼吸综合征灭活疫苗对猪群进行滴鼻免疫,试验结果显示:试验组猪群内的肺匀浆和血清中IFN-γ、CD3+CD8+、CD4+CD8+等水平均高于对照组,表明了以聚合物纳米颗粒为载体的纳米疫苗为猪繁殖与呼吸综合征疫苗的研发提供了新的方向。
ND纳米疫苗的研究目前较少,临床毒理数据还尚不清楚,走向商业化生产应用的道路任重而道远。随着科学技术的发展,具有高水平免疫原性的纳米材料也渐渐被发现、合成,制备流程也愈加完善成熟,对ND纳米疫苗的研究逐渐深入,有望为ND的防控起到重要作用。
5 总结与展望
5.1 目前鸡新城疫疫苗商业化面对的技术难题
面对ND流行,我国凭借严格的防控对策和科学的疫苗免疫,使得该流行病得到了良好的控制,但对于一些发展中国家,由于缺乏冷链设备以及严格的生物安全措施,导致非典型ND持续传播以及毒株在鸡群间持续复制感染[10-11]。ND疫苗商业化主要面临五大技术难题。(1)受ND的影响,机体免疫力下降,存在交叉感染的风险。(2)减毒活疫苗存在毒力返强等安全隐患且在偏远贫困地区缺少冷链运输设备,疫苗质量会大打折扣,容易出现免疫失败现象。(3)ND疫苗效价受母源抗体影响,只有当母源抗体水平≥4 log2时再进行ND疫苗的首次免疫,可确保免疫效力。(4)NDV为负链RNA病毒,基因重组变异概率高,易出现新的基因型,目前在多数ND流行的国家,流行株与疫苗株之间主要保护性抗原的同源性低,易造成疫苗株诱导感染变异株的机体产生的抗体水平低。(5)研制以及储存疫苗设备所需成本太高,会阻碍安全有效的商业化疫苗的研发。
5.2 ND疫苗未来的研究方向
目前已有多种商业化ND疫苗投入生产使用,正处于试验阶段的疫苗也取得了一定的研究成果,例如亚单位疫苗、病毒颗粒样疫苗、核酸疫苗等基因工程疫苗以及多价苗、多联苗等。理论上,基因工程疫苗相较于传统疫苗来说具有安全性高、免疫原性强、稳定性显著等优势,也是研发有效商业化ND候选疫苗的最有希望的方向。通过基因工程技术对目的毒株内的毒力基因和免疫抑制基因实施精确删除和定点修饰,以期获得基因型匹配的安全有效的疫苗。构建反向载体技术为减毒活疫苗、病毒载体活疫苗等基因工程疫苗的研发突破搭建了一个有前景的平台,为研发不同疾病、不同基因型的多价苗、多联苗开辟了新途径,有望达到降低成本、提高安全性、免疫效力高的目标。除此以外,新型纳米疫苗技术取得了突破性的进展,高效、低毒、安全的特性使其进入了大众视野,也为ND疫苗的研发带来了更多的可能,是人们向着彻底消灭ND的美好愿景更进一步。
