宁夏地区肉牛和滩羊多杀性巴氏杆菌流行调查分析
2024-05-09郭亚男王建东张正刚陈建银
郭亚男,王建东*,张正刚,2,马 科,陈建银
(1.宁夏农林科学院动物科学研究所,宁夏银川 750002;2.宁夏大学动物科技学院,宁夏银川 750021;3.宁夏同心县科技服务中心,宁夏同心 751300;4.原州区动物疾病预防控制中心,宁夏固原 756000)
多杀性巴氏杆菌(Pasteurellamultocida)是一种革兰氏阴性的条件致病菌,能够感染多种宿主[1],包括人、伴侣动物、牲畜和野生动物,是引起禽霍乱、牛和水牛及家兔出血性败血病的病原菌,该病的发病率和死亡率很高。该病在世界各地广泛传播,是严重危害畜牧业发展的病原菌之一,给畜牧业造成巨大的经济损失[2]。P.multocida作为一种重要的呼吸道病原体,可诱发宿主上皮屏障的功能障碍,从而导致细菌入侵以及气道和肺的多中炎症性疾病的发展[2,3]。P.multocida病通常无明显季节性,主要呈散发或地方流行性特征。环境条件,应激和动物的整体健康在疾病的发生和传播过程中发挥重要的作用[4]。寒冷季节呈散发性流行,在封闭潮湿的气候条件下,本病更易发生[5]。同时,圈舍中污染的水源、饲料及直接接触的器具都可成为该病的传播媒介,也可通过空气飞沫进行传播,从而侵入健康动物的呼吸道,诱发该病的发生[6-7]。肉牛和滩羊养殖作为宁夏的特色产业,通过检测疾病流行形势,制定合理的疾病防治措施,是推动宁夏肉牛和滩羊产业发展的重要手段。为掌握宁夏地区多杀性巴氏杆菌的流行现状,对宁夏地区肉牛和滩羊主要养殖地区P.multocida流行情况进行调查,分析并掌握该病的分布规律与流行状况,为宁夏地区肉牛和滩羊P.multocida的预防和治疗提供基础数据。
1 材料与方法
1.1 材料
1.1.1 病料 在2022年2月至2023年2月期间,在宁夏部分地区,即同心县、盐池县、原州区、平罗县、海原县、贺兰县、西夏区和灵武市等对这些区域集约化养殖牧场的肉牛和滩羊进行随机采样,总共采集肉牛和滩羊鼻拭子382份(表1)。用酒精棉迅速擦去肉牛和滩羊鼻口周围的污物,选用一次性无菌棉签,插入肉牛和滩羊鼻腔内5~10 cm深度,轻轻旋转后抽出棉签,并置于装有2 mL生理盐水的无菌管中。对采集的病料样本低温运输保存至宁夏农林科学院动物科学研究所畜禽疫病防治实验室进行病原分离和鉴定。
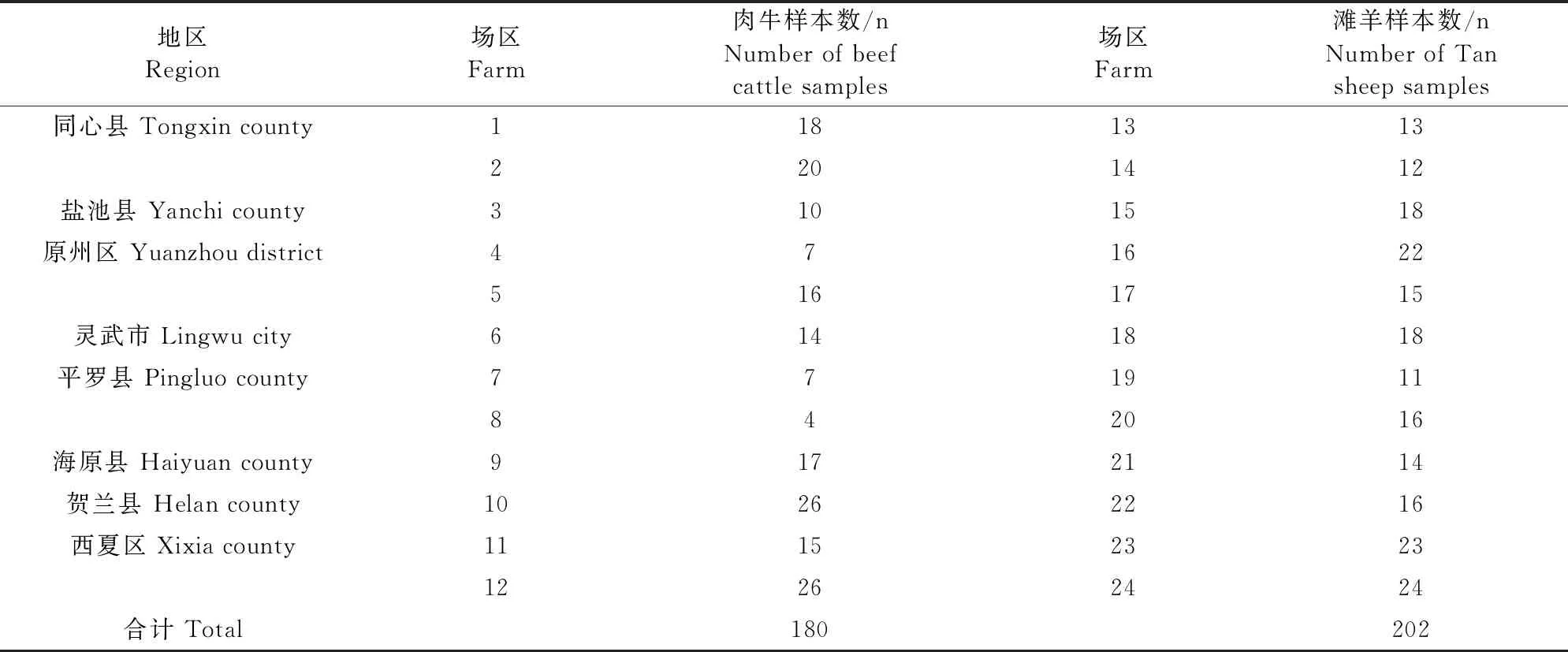
表1 肉牛和滩羊鼻拭子采样信息
1.1.2 主要试剂TaqProbe 2X qPCR-Multiplex 预混液(B630005),PCR 预混液(B110006),生工生物工程(上海)股份有限公司产品;细菌基因组DNA提取试剂盒(DP302),天根生化科技(北京)有限公司产品;胶回收试剂盒(D2500-01),OMEGA公司产品;DL500 DNA Marker(3590A),宝生物工程(大连)有限公司产品;豆粉琼脂培养基(WZ7030),金克隆(北京)生物技术有限公司产品;脱纤维羊血(1001339-1),北京索莱宝科技有限公司产品。
1.1.3 主要仪器 二氧化碳培养箱(BPN-0CH),上海一恒科学仪器有限公司产品;恒温振荡摇床(QYC-200),上海福玛实验设备有限公司产品;Real-time PCR仪(CFX96),美国伯乐生物科技有限公司产品。
1.2 方法
1.2.1 引物合成 参考朱丽霞[8]依据P.multocidaKmt1基因合成Pm-F和Pm-R引物;根据本实验室建立的针对血清A型的hyaC-hyaD基因、B型的bcbD基因、D型的dcbF基因、E型的ecbJ基因、F型的fcbD基因荧光定量PCR检测方法合成引物和探针,由生工生物工程(上海)股份有限公司合成(表2),引物和探针离心后用ddH2O稀释至10 μmol/L的工作浓度,置-20 ℃保存备用。

表2 不同基因特异性引物和探针序列列表
1.2.2 病原分离培养 在无菌操作台内,将装有采集的鼻拭子样本的离心管涡旋振荡15 s后,用无菌接种环蘸取悬液划线于5%无菌脱纤维绵羊血固体培养基,然后将平板置于37 ℃恒温培养箱24 h后观察菌落形态。并挑取典型单菌落于脑心浸出液培养基中,37 ℃、180 r/min培养24 h。
1.2.3 分离菌株PCR鉴定 取分离菌株的液体培养物2 mL,12 000 r/min离心5 min,使用细菌基因组DNA提取试剂盒对分离菌株进行基因组DNA的提取。采用Kmt-F和Kmt-R引物进行病原鉴定,Kmt1基因PCR反应体系为50 μL体系:模板2 μL,上、下游引物各1 μL(10 μmol/L),2×TaqMaster Mix 25 μL,ddH2O 21 μL。Kmt1反应条件:95 ℃ 2 min;95 ℃ 30 s,56 ℃ 20 s,72 ℃ 30 s,30个循环;72 ℃延伸8 min。PCR扩增产物经1%琼脂糖凝胶电泳分析后,用凝胶回收试剂盒纯化回收PCR产物,将PCR纯化产物送生工生物工程(上海)股份有限公司测序。
1.2.4 多杀性巴氏杆菌分型 采用细菌基因组DNA提取试剂盒提取测序分析后确定为P.multocida的分离菌株DNA组,根据本实验室建立的P.multocida血清型分型方法,按照表2中分型引物和探针进行TaqMan荧光定量PCR分型鉴定。TaqMan荧光定量PCR反应体系20 μL体系:2×Premix ExTaqTM10 μL,hyaC-hyaD、fcbD上、下游引物(10 μmol/L)各 0.4 μL(终浓度为 0.4 μmol/L),bcbD、dcbF、 ecbJ、上、下游引物(10 μmol/L)各 0.6 μL(终浓度为 0.6 μmol/L)、hyaC-hyaD探针(10 μmol/L)0.45 μL(终浓度为 0.45 μmol/L),bcbD、ecbJ、fcbD探针(10 μmol/L)0.6 μL(终浓度为 0.6 μmol/L),dcbF探针(10 μmol/L)0.55 μL(终浓度为 0.55 μmol/L),模板1 μL,ddH2O补足至20 μL;反应程序为:95 ℃ 5 min;95 ℃ 10 s,59 ℃ 30 s,并收集荧光信号,共39个循环。扩增结束后得到扩增曲线图和CT值,根据不同血清型所选用的荧光基团不同进行分型判定,CT<35视为结果可信。
1.2.5 统计分析 检测结果使用Excel软件进行阳性率分析;采用Graphpad prism 7统计分析软件中的卡方检验进行差异分析,并进行分析图的绘制。P<0.05表示差异显著;P<0.01表示差异极显著。
2 结果
2.1 病原分离培养结果
接种于5%脱纤维羊血固体培养基的样品在37℃恒温培养箱中培养24 h后,培养基上可观察到淡灰白色、边缘整齐、表面光滑、黏稠、湿润的露珠状小菌落,无溶血现象。
2.2 多杀性巴氏杆菌PCR鉴定结果
以挑取单菌落培养物DNA为模板,多杀性巴氏杆菌特异性鉴定引物扩增Kmt1基因,结果显示,扩增产物在456 bp处出现目的条带,与标准菌株P.multocida(CVCC1662)阳性对照条带大小一致(图1),标准菌株和分离菌株菌株扩增产物测序后与NCBI数据库比对并分析,与P.multocida基因序列同源性高达100%,由此可判定分离到的菌为P.multocida。

M.DNA标准DL 500;2~23.样品;1.阳性对照;24.阴性对照M.DNA Marker DL 500; 2-23.Sample; 1.Positive control; 24.Negative control
2.3 不同县区多杀性巴氏杆菌阳性率统计分析
从宁夏8个县(区)规模化养殖场共采集382份肉牛和滩羊鼻拭子,分离鉴定结果见表3。共分离到P.multocida77株,总阳性率为20.2%(77/382),不同地区阳性率在12.7%~34.3%之间,其中在灵武市采集的样品阳性率最高,为34.3%;其次是盐池县、贺兰县,阳性率分别为28.6%、26.2%,同心县采集的样品阳性率最低,阳性率为12.7%。
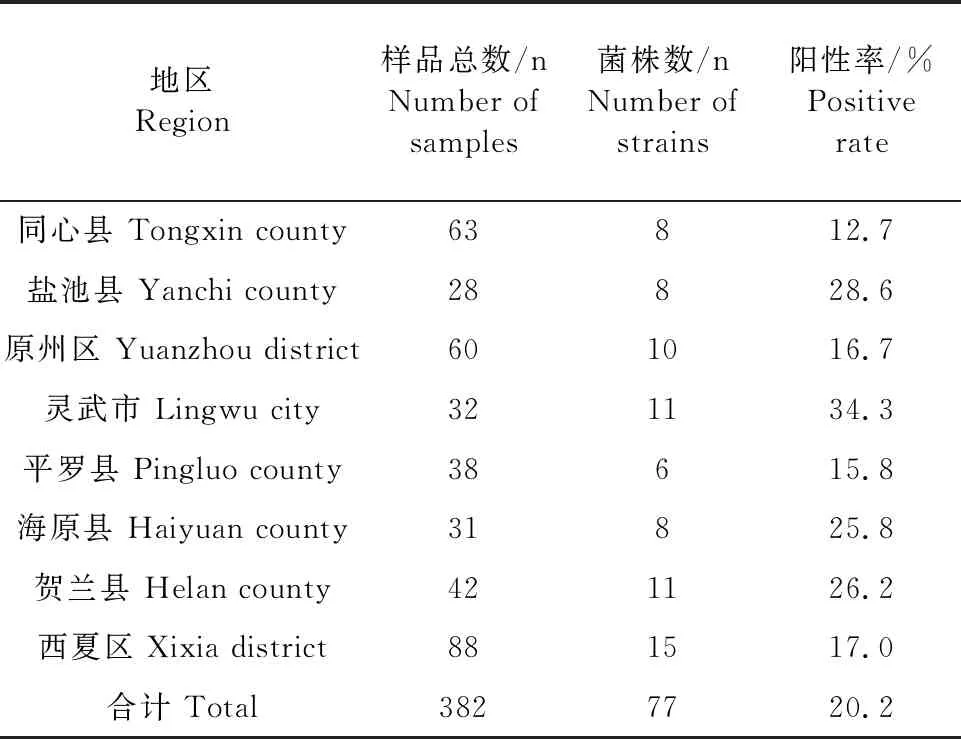
表3 不同地区样品P.multocida分离情况
2.4 多杀性巴氏杆菌病分型检测结果
对采集的382份样品进行病原分离,分子生物学鉴定共分离到77株P.multocida,分离率为20.2%。对所分离菌株经荚膜PCR分型,其中A型44株(57%),B型29株(38%),D型4株(5%)(图2)。在分离得到的77株P.multocida中,同心县分离到6株荚膜A型菌、2株荚膜B型菌;分离率为10.4%;盐池县分离到7株荚膜A型菌、1株荚膜B型菌,分离率为10.4%;原州区分离到7株A型菌、2株B型菌,1株D型菌,分离率为13.0%;灵武市分离到5株A型菌、6株B型菌,分离率为14.3%;平罗县分离到2株A型菌,3株B型菌,1株D型菌;海原县分离到2株A型菌,4株B型菌,2株D型菌;贺兰县分离到7株A型菌,4株B型菌;西夏区分离到8株A型菌,7株B型菌(图3)。
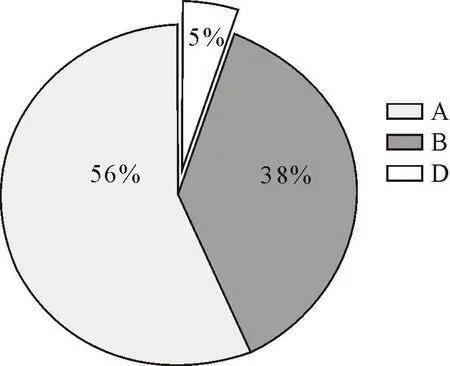
图2 77株P.multocida荚膜分型情况

a.同心县;b.盐池县;c.原州区;d.灵武市;e.平罗县;f.海原县;g.贺兰县;h.西夏区
2.5 宁夏地区不同月龄肉牛和滩羊多杀性巴氏杆菌流行调查
在对不同月龄的肉牛和滩羊进行流行病学调查发现,在采集的382份病料中,1月龄、2月龄肉牛P.multocida阳性率分别10%和6%,相对较低,3~7月龄是P.multocida高发期,阳性率范围为16.7%~31.3%,相对1~2月龄感染有所增加,且3月龄肉犊牛阳性率最高,占3月龄采样总数31.3%,可能是肉母牛通过乳汁将病原菌传播给肉犊牛,或者是带毒肉牛通过与肉犊牛密切接触而传播。8月龄~1岁肉牛,P.multocida阳性率则呈下降趋势,可能是随年龄的增长机体抵抗力增强的原因,而2岁肉牛几乎不发病,阳性率为0(表4)。滩羊P.multocida感染率主要集中在2~5月龄,阳性率为21.4%~30.8%;9月龄和2岁的滩羊阳性率最低,分别为8.3%、0(表4)。对不同月龄的肉牛P.multocida阳性率差异性分析可知,3~7月龄的肉牛P.multocida阳性率最高,与2月龄、1岁和2岁肉牛阳性率相比差异性极显著(P<0.01);4~6月龄与7~9月龄肉牛P.multocida阳性率相比差异性显著(P<0.05),而在不同月龄滩羊P.multocida阳性率差异性分析可知,3月龄、4月龄和8月龄阳性率最高,与1月龄、9月龄和1岁滩羊P.multocida阳性率相比差异性极显著(P<0.01);其余月龄之间相比差异性不显著(图4)。
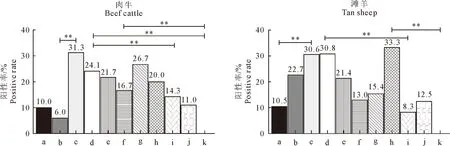
**.差异性极显著;*.差异性显著;a.1月龄;b.2月龄;c.3月龄;d.4月龄;e.5月龄f.6月龄;g.7月龄;h.8月龄;i.9月龄;j.1岁;k.2岁
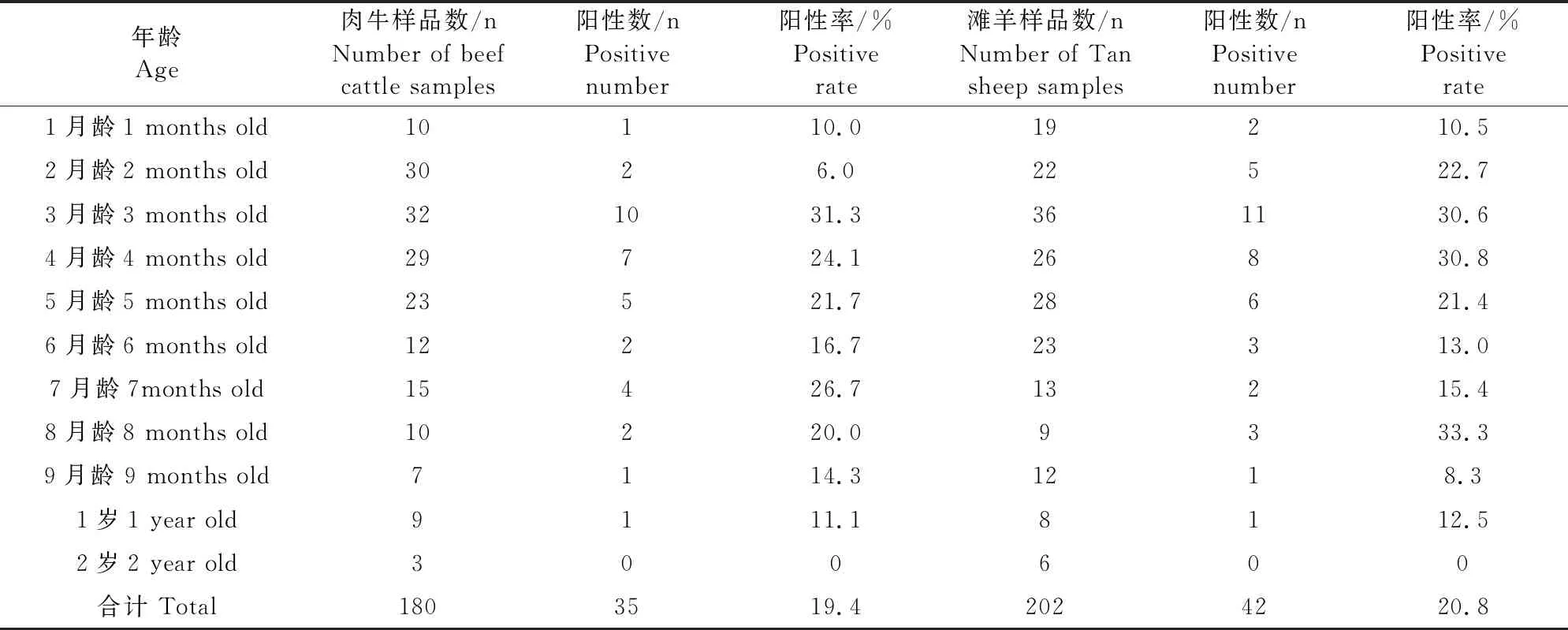
表4 不同月龄的肉牛和滩羊多杀性巴氏杆菌的阳性率统计
3 讨论
多杀性巴氏杆菌是动物呼吸道常见的致病菌之一[9]。该病原广泛的存在于各种健康动物的鼻腔、咽及肺等部位,当机体受到外界不良刺激造成免疫水平下降时,该菌大量繁殖引发疾病[10-11]。本研究所采集的病料来源都是宁夏主要肉牛和滩羊养地区,所以对这些规模化养殖场进行P.multocida的调查具有代表性。研究发现,P.multocida在灵武市的阳性率最高,为34.3%,而同心县的阳性率最低,为12.7%;其他6个县(区)平均阳性率为21.7%。对不同月龄肉牛和滩羊多杀性巴氏杆菌的流行情况进行调查发现,肉牛P.multocida的高发期主要集中在3~8月龄之间,平均阳性率为23.4%,3月龄以下和8月龄以上感染率相对较低;滩羊P.multocida阳性率最高月龄是3月龄,阳性率为30.6%;1月龄、9月龄和2岁龄阳性率最低(0~12.5%)。以上结果说明了P.multocida发病阶段主要集中在幼龄阶段,可能是幼畜对病原菌的抵抗力较弱,故感染率较高,当饲养环境拥挤,春秋季节更替,动物机体免疫力下降的情况时,更易发生P.multocida感染。
对采集的382份鼻拭子进行检测与病原分离,分离出77株P.multocida菌株,阳性率为20.1%,其中肉牛阳性率为19.4%,滩羊阳性率为20.8%,每个地区均检出P.multocida,说明了P.multocida在宁夏地区普遍流行。Wang等[12]2011-2012年期间在我国江苏省禽霍乱疫情中分离并确定了40株菌株,通过荚膜分型发现这些菌株全部为荚膜A型。日本学者Katsuda等2009-2012年期间从临床健康和患病牛鉴定分离出378株P.multocida,其中A型菌354株(93.7%),D型菌24株(6.3%),证实荚膜A型分离株比荚膜D型分离株更为常见[13]。Christa Ewers等1982-2004年期间在德国通过PCR和DNA-DNA杂交从临床不同宿主分离出289株P.multocida,通过荚膜分型发现牛源和禽源荚膜A型占比分别高达92.3%、85.7%,另外在41株猪源多杀性巴氏杆菌中,荚膜A型占34.9%,荚膜D型占58.1%[14]。鲍娟[15]等2003-2008年期间针对荚膜生物合成位点hyaD、bcbD、dcbF碱基序列分别合成3对特异性引物,对17株待检P.multocida分离物进行荚膜PCR分型,其中8株鉴定为A型,占47.06%;9株鉴定为D型,占52.94%。唐先春等2005年在海南、湖北、湖南等地区从猪的鼻拭子中分离出66株P.multocida,其中有46株为D型,18株为A型,1株为B型P.multocida,1株无法定型[16]。本研究中分离得到77株多杀性巴氏杆菌中,多数为荚膜血清型A(57%)和荚膜血清B(38%)、荚膜血清D(5%),没有检出E和F型。以上数据结果表明,宁夏地区P.multocida主要以荚膜A型和荚膜B 型为主,荚膜血清D型次之。在宁夏地区普遍流行。Wang等[12]2011-2012年期间在我国江苏省禽霍乱疫情中分离并确定了40株菌株,通过荚膜分型发现这些菌株全部为荚膜A型。日本学者Katsuda等2009-2012年期间从临床健康和患病牛鉴定分离出378株P.multocida,其中A型菌354株(93.7%),D型菌24株(6.3%),证实荚膜A型分离株比荚膜D型分离株更为常见[13]。Christa Ewers等1982-2004年期间在德国通过PCR和DNA-DNA杂交从临床不同宿主分离出289株P.multocida,通过荚膜分型发现牛源和禽源荚膜A型占比分别高达92.3%、85.7%,另外在41株猪源多杀性巴氏杆菌中,荚膜A型占34.9%,荚膜D型占58.1%[14]。鲍娟[15]等2003-2008年期间针对荚膜生物合成位点hyaD、bcbD、dcbF碱基序列分别合成3对特异性引物,对17株待检P.multocida分离物进行荚膜PCR分型,其中8株鉴定为A型,占47.06%;9株鉴定为D型,占52.94%。唐先春等2005年在海南、湖北、湖南等地区从猪的鼻拭子中分离出66株P.multocida,其中有46株为D型,18株为A型,1株为B型P.multocida,1株无法定型[16]。本研究中分离得到77株多杀性巴氏杆菌中,多数为荚膜血清型A(57%)和荚膜血清B(38%)、荚膜血清D(5%),没有检出E和F型。以上数据结果表明,宁夏地区P.multocida主要以荚膜A型和荚膜B 型为主,荚膜血清D型次之。
