氟比洛芬酯对根治性胃切除患者围手术期体温及寒颤的影响*
2024-05-09汪志勇张民皓谢辉兰
王 杰,刘 辉,汪志勇,张民皓,鲁 振,谢辉兰
(江苏省肿瘤医院/江苏省肿瘤防治研究所/南京医科大学附属肿瘤医院麻醉科,南京 210009)
胃癌是我国常见的恶性肿瘤之一,外科手术是治疗胃癌的主要方法[1]。在手术过程中,凉爽的手术环境、腹腔开放及麻醉等多种原因均可引起患者体温出现非控制性的下降。术后寒颤通常是由于机体体温过低而导致,既往相关研究表明术后寒颤的发生率为40%~65%[2]。术后寒颤可导致患者氧耗增加、乳酸堆积、苏醒时间延长,影响患者的预后[3]。因此,降低恶性肿瘤患者术后寒颤的发生,对改善患者预后具有重要作用。
氟比洛芬酯是一种非选择性环氧酶抑制剂,主要用于术后镇痛。有研究表明环氧化酶-2(COX-2)抑制剂在体温调节中起到重要作用,但在围手术期应用氟比洛芬酯对患者体温和寒颤的影响报道较少[4]。因此,本研究通过术中使用氟比洛芬酯,探讨其对行根治性胃切除手术患者的体温和寒颤的影响。
1 资料与方法
1.1 一般资料
选取2022年1-8月本院收治的行根治性胃切除术全身麻醉患者。患者纳入标准:年龄18~80岁,美国麻醉医师协会(ASA)分级Ⅱ~Ⅲ级;手术时间≥60 min;拟行根治性胃切除手术;术后进入苏醒室;术前体温正常。剔除标准:术前体温异常或服用过调节体温相关药物;伴有汗腺功能异常;术中出血量≥500 mL;术中需要输血;手术时间≥4 h,术后无法配合进行VAS评分;对非甾体抗炎药或其他药物过敏;肝肾功能异常。采用随机数字表法将患者分为两组:对照组(C组)和氟比洛芬酯组(F组)。本研究已取得患者及其家属知情同意和本院伦理委员会批准(2019-010)。
1.2 方法
患者术前禁食、禁饮,入手术室后开放右颈内静脉,监测血压、心率(HR)、脉搏氧饱和度(SpO2)、呼气末二氧化碳分压(PETCO2)、体温及麻醉深度。麻醉诱导依次静脉给予咪达唑仑0.1 mg/kg,丙泊酚1~2 mg/kg,舒芬太尼0.03 μg/kg和罗库溴铵1 mg/kg进行诱导,3 min后行气管插管,插管成功后固定导管行容量控制模式进行机械通气,维持PETCO235~45 mmHg。术中静脉输注丙泊酚4~8 mg·kg-1·h-1,瑞芬太尼0.15~3 μg·kg-1·min-1,苯磺酸顺阿曲库铵0.15 mg·kg-1·h-1,右美托咪定0.2~1.0 μg·kg-1·h-1进行维持,F组麻醉诱导后给予100 mg氟比洛芬酯,C组给予10 mL 0.9%生理盐水。根据血流动力学参数及麻醉深度调节术中用药,术中血压低于术前基础值,使用麻黄碱6 mg或多巴胺2 mg。手术方式均为开腹性根治性胃切除术,术中静脉输注醋酸林格试剂补偿空腹及术中失液量。关腹前均使用常温0.9%生理盐水1 000 mL进行冲洗,在麻醉期间或麻醉后都没有主动保暖。两组术毕均接静脉自控镇痛(PCIA),镇痛药物为:地佐辛0.8 mg/kg+托烷司琼6 mg,用生理盐水配至100 mL,背景输注速率2 mL/h,负荷剂量2 mL,每次追加剂量1 mL,锁定时间15 min,镇痛48 h,维持VAS评分≤4分,如果VAS评分>4分,则给予羟考酮50 mg。手术结束后转入PACU继续观察,恢复室温度维持在22~24 ℃,房间湿度保持在60%左右。每例患者拔管后都通过面罩给氧,覆盖相同厚度的被子。如果出现术后寒颤进行寒颤强度分级,0级为无寒颤;1级为轻度寒颤,仅局限于颈部和(或)胸部轻度抽搐或心电图干扰;2级为多个肌群可见肌肉活动;3级为全身寒颤反应[5]。当寒颤强度≥2级时,静脉给予曲马多100 mg,并观察30 min。当患者Steward清醒评分>4分,生命体征平稳时送回病房。
1.3 观察指标
采用自行设计的“根治性胃切除术患者术后寒颤资料收集表”进行资料收集。记录患者一般资料和手术前基本参数;记录患者手术前(T0)、入恢复室(T1)、出恢复室(T2)时的血压、心率、耳膜温度,记录在恢复室期间发生寒颤的患者例数及寒颤强度、持续时间。记录拔管后30 min及1 h VAS评分及恶心呕吐等不良反应的发生情况。
1.4 样本估算
应用PASS11.0软件,以α=0.05为统计意义水准,检验效能(1-β)为80%,根据文献报道术后寒颤的发生率为40%~65%,预计C组术后寒颤发生率为50%,而F组术后寒颤发生率降至20%,计算出每组至少需要39例患者。在本研究中,每组招募60例患者,以防出现剔除病例。
1.5 统计学处理
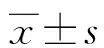
2 结 果
2.1 两组患者一般资料比较
本研究初始共纳入120例患者,C组因术后直接转入ICU剔除3例,手术时间过长剔除2例,术后无法配合VAS评分3例,共52例患者入组。F组因手术时间过长剔除3例,共纳入57例患者。两组患者年龄、性别、体重等一般资料差异无统计学意义,见表1。

表1 两组患者一般资料比较
2.2 两组患者不同时间点平均动脉压(MAP)和HR比较
两组患者不同时间点的MAP、HR差异均无统计学意义(P>0.05),见表2、3。F组有12例(21.1%)使用多巴胺或去氧肾上腺素,C组有13例(25.0%)使用多巴胺或去氧肾上腺素。
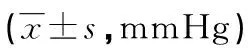
表2 两组患者不同时间点MAP比较
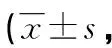
表3 两组患者不同时间点HR比较次/min)
2.3 两组患者不同时间点耳膜温度比较
与T0相比,T1、T2时两组耳膜温度明显降低(P<0.05),T0、T1、T2时间点两组耳膜温度比较差异无统计学意义(P>0.05),见表4。
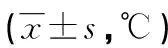
表4 两组患者不同时间点耳膜温度比较
2.4 两组患者寒颤的发生例数及强度、持续时间比较
入恢复室后F组患者10例(19.2%)和C组23例(40.4%)观察到术后寒颤。C组总寒颤发生率明显高于F组(P<0.05),14.8%(16/109)的患者经历2级和3级寒颤,C组1、2、3级寒颤发生的患者数量明显高于F组(P<0.05),且F组仅出现1例3级寒颤,两组患者寒颤发生持续时间比较无差异,见表5。

表5 两组患者寒颤的发生例数及强度、持续时间比较
2.5 两组患者术后不良反应比较
T3、T4时间点C组VAS评分均高于F组,两组患者术后恶心、呕吐等不良反应差异无统计学意义(P>0.05),见表6。
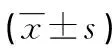
表6 两组患者术后不良反应比较
3 讨 论
围手术期出现术中体温过低是术后寒颤的主要危险因素,但体温正常的患者也会发生寒颤[6-7]。本研究结果表明两组患者不同时间点体温差异无统计学意义,但入PACU后体温明显低于术前。目前影响术后寒颤发生的危险因素有很多,例如麻醉导致的交感神经活动降低、肾上腺功能抑制、挥发性麻醉药物的使用、手术中热原物质的释放、术中失血及手术时间过长、术后疼痛或阿片类药物戒断等[2,8]。
本研究中行根治性胃切除术患者围手术期寒颤的发生率为30.3%,与相关报道发生率相似,给患者术后快速康复带来一定风险[9]。有研究表明在麻醉诱导后给予40 mg帕瑞昔布钠不仅有效降低了术后寒颤的发生,还可改善患者术后疼痛[10]。一项回顾性研究表明在141例妇科开腹手术结束前给予氟比洛芬酯50 mg,术后寒颤发生率为6.5%,明显低于对照组(21.3%),多因素logistic回归分析表明,手术结束前给予氟比洛芬酯50 mg与降低术后寒颤发生独立相关[11]。本研究中麻醉诱导后给予氟比洛芬酯100 mg,发现术后寒颤发生率明显低于对照组,且不增加术后不良反应。
氟比洛芬酯降低术后寒颤的的确切机制尚不明确。在围手术期,手术、疼痛等应激可产生多种细胞因子诱导COX-2的表达,COX-2在由花生四烯酸合成PGE2的过程中起着重要作用[12]。而COX-2/PGE2通路在温度调节通路中起着关键作用[13]。PENG等[14]报道COX-2抑制剂在围手术期通过下调COX-2/PGE2通路抑制海马COX-2表达和PGE2合成。因此作者认为氟比洛芬酯对术后寒颤的影响可能是通过抑制下丘脑水平的COX-2表达和PGE2合成,在下丘脑水平抑制体温调节中心,降低寒颤的发生。SHEN等[10]研究发现COX-2抑制剂帕瑞昔布钠并未影响术中体温降低。本研究也表明氟比洛芬酯并未明显影响术中体温降低,提示有可能是通过中枢机制抑制体温调节反应。
有研究报道术后疼痛会使非体温调节性寒颤发生。如舒芬太尼已被证明可以通过μ受体防止术后寒颤发生[15]。而氟比洛芬酯通过抑制COX-2表达和PGE2合成来产生镇痛作用,已被推荐用于术后镇痛[16]。在本研究中,在麻醉恢复期间,氟比洛芬酯的疼痛评分显著降低。氟比洛芬酯的抗寒颤作用可能是由于有效地抑制术后疼痛。
氟比洛芬酯是一种安全且快速有效的药物,但禁用于高血压或心血管疾病高危患者。在本研究中,未观察到氟比洛芬酯对血流动力学的影响,同时在全身麻醉后恢复时间也未发生任何不良反应。
本研究仍存在一定局限性,首先为单临床中心研究,样本来源较单一;其次并未评估不同剂量或不同时间点给予氟比洛芬酯的效果,所有患者于麻醉诱导后给予100 mg氟比洛芬酯,其他剂量或时间点是否对术后寒颤发生有影响有待于进一步研究。
