基于孟德尔随机化的DHA水平与ADHD的关系研究*
2024-05-09谭景蓝罗庆华
张 郑,谭景蓝,罗庆华
(重庆医科大学附属第一医院精神科,重庆 400016)
注意缺陷与多动障碍(attention deficit hyperactivity disorder,ADHD)是最常见的儿童神经发育障碍之一,其特点是持续注意力不集中、难以控制冲动行为或过度活跃,常发病于7~12岁,男孩的发病率是女孩的3倍,影响着世界5%~7%的儿童[1]。与其他精神疾病相同,遗传因素发挥了重要的病因作用,但其他外部环境因素,如怀孕期间接触酒精、烟草或毒素、情绪障碍、早产、低出生体重和产前或产后脑损伤等也被证明是ADHD的致病原因[2]。
Omega-3多不饱和脂肪酸(Omega-3 polyunsaturated fatty acids,n-3PUFAs)在大脑功能和神经细胞膜结构及髓鞘和视网膜的发育中发挥着核心作用[3],特别是二十二碳六烯酸(docosahexaenoic acid,DHA)构成了人类大脑中90%的n-3PUFAs和总脂质的10%~20%[4],对母婴健康有许多积极的影响[5],其主要是通过食用富含脂肪的鱼类和其他海鲜摄入。有研究表明,ADHD患儿血清中DHA和n-3PUFAs水平较正常对照组低[6]。还有研究发现,较高的DHA摄入量可以降低精神分裂症、双相情感障碍、抑郁、焦虑和行为障碍的风险,而较低的DHA水平似乎是精神疾病的潜在风险因素[7]。此外,DHA对于神经发育的改善,尤其是认知功能的改善仍存在争议,需要进一步证明[8]。
观察性研究因难以准确考虑所有的混杂因素,很容易受到混杂偏倚的影响。相比之下,孟德尔随机化(mendelian randomization,MR)分析将遗传变异作为工具变量,规避了混杂因素或反向因果关系的影响,并可用于研究影响人群健康的风险因素[9]。目前还没有研究采用MR方法来探究DHA对ADHD发病风险是否存在因果效应,或ADHD和DHA水平的因果关系。基于此,本研究设计并完成了一项双向MR分析,现报道如下。
1 资料与方法
1.1 一般资料

表1 MR研究中GWAS数据库的简要信息
1.2 方法
1.2.1MR研究3个假设
SNP作为代理表型的遗传工具变量(instrumental variables,IVs)被用来进行双样本MR研究。所筛选的SNP应满足MR的3个主要假设:(1)假设一,工具变量应与相应的表型具有强相关;(2)假设二,工具变量不受与结局有关联的潜在混杂因素的影响;(3)假设三,工具变量和结果之间没有直接关系[9]。通过MR分析来评估DHA与ADHD之间的双向因果关系,流程见图1。

实线箭头线:MR分析流程,且只能通过暴露影响结局;虚线箭头:违背MR 3个假设的影响路径。
1.2.2工具变量的选择
所选用于代理DHA工具变量的SNP均满足全基因组统计显著性阈值(P<5×10-8),以满足假设一,为了获得独立的SNP,进行了去连锁不平衡LD(r2<0.001,kb=10 000)[13]。为了进一步评价工具变量强度(R2),计算了每个SNP的F统计量,其中F<10(视为弱工具变量)的工具变量被剔除[14],具体计算公式如下:
F=[(N-k-1)/k]×[R2/(1-R2)][15]
①
R2通过以下公式计算得来:
R2=2×(1-MAF)×MAF×(β/SD)2[16-17]
②
公式中的N代表所选取数据集的样本量,k是选择用于MR分析的SNP总数,MAF是次要等位基因频率,β是SNP对DHA的效应估计值,SD是β的标准差。
此外,进行反向MR分析,以验证ADHD对DHA是否存在因果关系。同样从数据集中筛选了全基因组显著(P<5×10-8)和独立遗传(r2<0.001)且无LD的SNP,通过上述标准筛选的SNP用作MR分析的最终工具变量。
1.2.3去除混杂和回文SNP
为了满足MR假设二,在PhenoScannerV2数据库(http://www.phenoscanner.medschl.cam.ac.uk/)评估了每个SNP及其相关表型,并在r2>0.80的阈值上剔除了与ADHD相关性状的SNP[18-19]。通过上述选择的SNP去除具有中间等位基因频率的所有回文SNP来协调DHA和ADHD的数据[20],回文SNP定义为具有A/T或G/C等位基因的SNP,且中间等位基因频率为0.01~0.30[21]。
实验组学生和教师任务分解。学生任务:(1)小组学习:学生按5~6人组成学习小组,学习内容分为热点问题和案例学习两部分。课外每名学生根据发放材料进行文献收集、阅读、思考,然后开展小组讨论,达成小组共识,重新组织内容,为课堂展示做准备。(2)学生课堂:以小组为单位,进行学习内容讲解,同时回答其他组的提问。其中热点问题6学时,案例学习6学时,学习成果、学习经验分享2学时。(3)课外训练:利用第二课堂,以小组为单位开展社会实践活动。学生以问卷形式开展社区、养老机构老年健康需求调查,或应用所学知识、技能开展老年慢性病健康教育、护理服务活动。
1.2.4效应统计和敏感性分析
采用逆方差加权法(inverse-varianceweighted,IVW)作为主要的统计分析方法,该方法通过应用Wald比率结合了SNP特异性估计,通过meta分析法综合了DHA对ADHD的汇总因果效应[22]。并使用了加权中位数法(weighted median,WM)、MR-Egger回归和MR多效性残差和离群值(MR-PRESSO)模型作为补充分析方法。MR-Egger截距的P值用于指示定向多效性,MR-PRESSO法用于检测并去除异常值后再生成估计值,以区分去除异常值前后估计值之间的差异[23]。此外,使用Cochran’sQ值来表示DHA所用的工具变量之间的异质性[24]。此后,在反向MR分析中使用与上述相同的MR方法。用效应指标优势比(odds ratio,OR)和95%CI报告效应估计值,若OR>1,说明暴露对结局可能是一个危险因素,增加了该结局发生的可能性;若OR>0~<1,则说明暴露对结局存在潜在保护作用。
1.3 统计学处理
采用R4.1.0进行数据分析,计数资料以例数或百分比表示,以P<0.05为差异有统计学意义。
2 结 果
2.1 正向MR分析
经过上述筛选标准(P<5×10-8,r2<0.001,F>10),并排除与结局存在潜在关联的混杂因素后,共纳入37个SNP作为DHA的工具变量。分别与ADHD1、ADHD2数据集进行同方向纠正,并剔除回文SNP后确定了两组工具变量,包括19个来自PGC2019和15个来自PGC2022的SNP,且筛选出的SNP具有较强的统计强度,F为398.1~441.5,超过了常规阈值10,见表2。

表2 基于IVW模型的DHA对ADHD风险的因果效应
IVW结果显示,DHA对ADHD存在潜在因果效应,两组MR分析结果均说明DHA是ADHD的潜在保护因素;此外,WM分析也得出了一致的结论,但结果显示差异无统计学意义(P>0.05),见表3。然而,在PGC2019数据集中MR-Egger方法得到了相反的结论,但结果显示差异无统计学意义(P>0.05),见图2。

A:ADHD1与DHA水平分析;B:ADHD2与DHA水平分析;水平X轴:DHA遗传效应;垂直Y轴:ADHD遗传效应;黑点:MR分析中使用的SNP;由于IVW和WM在分析中估计值相似,图片视觉上显示重叠。

表3 基于3种MR方法的DHA与ADHD风险因果关系
2.2 反向MR分析
在满足上述阈值(P<5×10-8,r2<0.001,F>10)下,来自PGC2019数据集的ADHD1未找到足够的SNP,因此反向MR共纳入了来自PGC2022数据集的27个SNP作为ADHD的工具变量,与DHA数据集进行同方向纠正,并剔除回文SNP后确定20个SNP,结果显示ADHD对DHA存在潜在因果效应,IVW和WM提示ADHD患者体内DHA水平低于健康人群(P<0.05),见表4。此外,MR-Egger分析也得出了一致的结论,但结果显示差异无统计学意义(P>0.05),见图3。
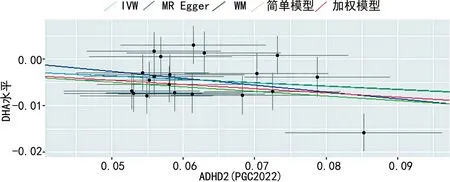
水平X轴:ADHD遗传效应;垂直Y轴:DHA遗传效应;黑点:MR分析中使用的SNP;由于IVW和WM在分析中估计值相似,图片视觉上显示重叠。

表4 基于3种MR方法的ADHD与DHA风险因果关系
2.3 敏感性与多效性分析
正向MR分析中,MR-Egger未显示任何多效性(P>0.05);对于反向MR分析,MR-Egger也未显示存在任何多效性(P>0.05)。使用Cochran’sQ检验评估每个数据集内部异质性,检验数据集内无明显的异质性证据(P>0.05)。此外,还进行了MR-PRESSO检验,得到一致结果,均未发现存在定向多效性和离群SNP,见表5。
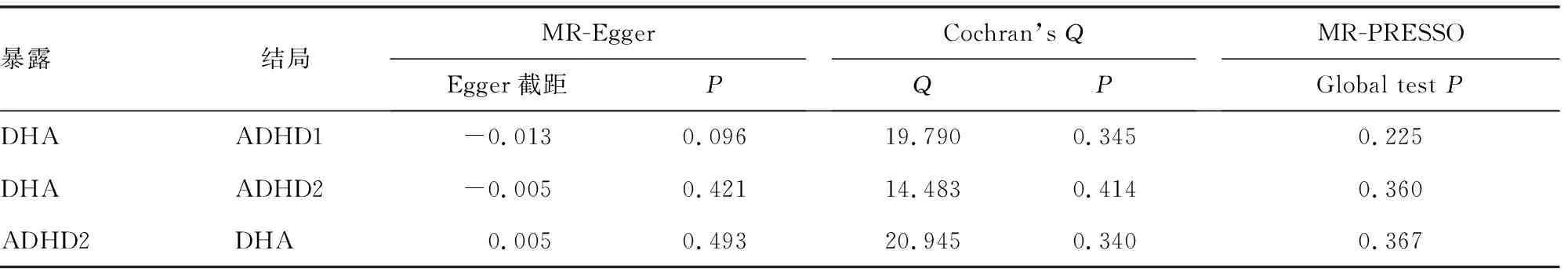
表5 敏感性分析结果的总结
3 讨 论
本研究从遗传角度发现DHA和ADHD存在双向因果关联,为ADHD的早期预防提供了依据,有助于为孕产妇饮食摄入提供指导,以降低ADHD的发病风险。
正向MR分析结果显示,DHA是ADHD发病的潜在保护因素。有研究表明,DHA在妊娠晚期至儿童2岁时被迅速融入视网膜和脑神经组织中[25],由于胎儿DHA的自主合成较低,母体DHA的摄入和胎盘的转运功能对胎儿获取DHA至关重要[26]。存在多项流行病学证据表明DHA水平与注意力呈正相关,与ADHD的严重程度呈负相关[27],而DHA补充剂有助于改善7~14岁儿童的心理社会功能、注意力集中及情绪问题[28]。此外,产前补充DHA同样有益于学龄前儿童的注意力和执行能力[29],尤其是早产儿[30],这与本研究结果一致。有学者认为,这可能是因胎儿较低的DHA水平导致脑白质完整性缺陷和额底神经胶质回路的功能连接降低,进而增加儿童患ADHD症状的风险[31]。还有研究表明,DHA可能通过抑制核因子-κB活性,促进过氧化物酶体增殖物激活受体-γ(PPAR-γ)的活性,进而起到抗炎作用来控制ADHD症状[32]。目前来说,DHA影响ADHD的具体机制尚不明确,其可能还与皮层多巴胺神经递质的改变[25]及脑-肠轴有关[33]。
反向MR分析结果显示,ADHD患者具有较低的DHA水平,这与既往研究[34]结论一致,ADHD儿童在红细胞膜上呈现独特的脂肪酸谱,DHA水平明显低于健康儿童。
本研究优势在于使用MR来研究DHA与ADHD之间的双向因果效应,由于遗传信息在时间顺序上先于出生后环境因素的暴露,故而避免了观察性研究中混杂因素带来的偏倚,相比于随机对照试验的成本和伦理问题,更高效地探讨了二者的因果关系。当然,本研究也存在一定的局限性,研究对象为欧洲人群,其他种族能否得出相同的结论有待进一步研究。
综上所述,本研究基于双向MR,利用遗传数据进行了DHA与ADHD的双向因果推断,结果发现DHA水平对ADHD的发病存在潜在保护作用,同时ADHD患儿具有较低的DHA水平。但二者之间具体的作用机制尚不明确,仍需进一步研究。
