血清微小RNA-25表达与急性脑梗死恢复期血管内皮功能及神经功能障碍的相关性
2024-05-08朱中勤田娣李伟
朱中勤 田娣 李伟
急性脑梗死是常见的脑血管疾病,具有高致残率、复发率、死亡率的特点[1-2]。经临床治疗后虽能控制病情进展,但稳定恢复期仍遗留不同程度的血管内皮功能和神经功能障碍,因此如何有效保护、改善血管和促进神经功能恢复成为临床关注的重点[3]。微小RNA(miR)因在多种脑部疾病的发展过程中扮演重要角色而受临床研究的关注[4]。既往研究报道,miR-25-3p可靶向调节内皮细胞中血管内皮生长因子受体-2、正闭锁小带蛋白1、闭合蛋白和连接蛋白的表达从而促进血管通透性和血管生成;miR-25还可通过下调AGE-RAGE和减少烟酰胺腺嘌呤二核苷酸磷酸氧化酶作为糖尿病神经病变的保护因子[5-6]。本研究探讨血清miR-25表达与急性脑梗死恢复期血管内皮功能及神经功能的关系,为临床防治提供参考。
对象与方法
1.对象:选取本院2020年3月~2022年3月收治的急性脑梗死患者272例作为疾病组,其中男146例、女126例,年龄45~73岁,平均年龄(61.87±8.44)岁;BMI 19.45~28.61 kg/m2,平均BMI(24.01±2.32)kg/m2。纳入标准:(1)均符合急性脑梗死的诊断标准[7];(2)首次发病。排除标准:(1)合并心、肝、肺功能不全;(2)伴有颅脑内恶性肿瘤;(3)合并脑出血;(4)伴有自身免疫性、代谢类、全身感染类疾病;(5)既往神经功能障碍;(6)对研究药物过敏。根据疾病组入院时间和疾病恢复情况将其分为急性期组(入院时间≤24 h)136例和恢复期组(距离收入本院时间>4周,且疾病处于稳定状态)136例。另选取本院同期健康体检者129例作为对照组,其中男68例、女61例,年龄44~75岁,平均年龄(60.34±8.31)岁;BMI 19.67~29.12 kg/m2,平均BMI(24.23±2.42)kg/m2。两组受试者性别、年龄、BMI比较差异均无统计学意义(P>0.05),具有可比性。本研究经我院伦理委员会审核批准,所有受试者均签署知情同意书。
2.方法:依据《中国急性缺血性脑卒中诊治指南2018》[8]对急性脑梗死患者进行治疗,综合评估病情后行溶栓、取栓及口服阿司匹林治疗,术后根据患者自身情况进行抗凝、扩容、神经保护等处理。收集所有受试者一般资料(性别、年龄、BMI)、实验室检查指标[血清miR-25、血管内皮生长因子(VEGF)、内皮素-1(ET-1)、一氧化氮(NO)]及疾病组患者脑梗部位和梗死病灶面积。采用美国国立卫生研究院卒中量表(NIHSS)[9]评估恢复期患者神经功能并将其分为轻度组(NIHSS评分≤5分,63例)、中度组(NIHSS评分6~15分,42例)和重度组(NIHSS评分>15分,31例)。
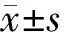
结 果
1.疾病组患者脑梗死情况:急性脑梗死患者脑梗部位:基底节区130例,脑干84例,小脑58例;梗死病灶面积3~25 cm2,平均病灶面积(13.26±3.62)cm2。
2.急性期组、恢复期组和对照组受试者VEGF、NO、ET-1及miR-25表达水平比较:急性期组、恢复期组和对照组受试者VEGF、ET-1水平依次降低,NO、miR-25表达水平依次升高(P<0.05)。见表1。
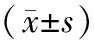
表1 急性期组、恢复期组和对照组受试者VEGF、NO、ET-1及miR-25表达水平比较
3.不同组别患者miR-25表达水平比较:急性期组患者NIHSS评分高于恢复期组[17.74±3.23)分比(14.23±2.65)分,t=9.797,P<0.05]。疾病恢复期轻度组(0.76±0.12)、中度组(0.71±0.09)和重度组(0.65±0.07)患者血清miR-25表达水平依次降低(P<0.05)。
4.血清miR-25表达水平与急性脑梗死恢复期患者血管内皮功能、神经功能的相关性:Pearson相关分析结果显示,血清miR-25表达水平与VEGF(r=-0.593)、ET-1(r=-0.528)、NIHSS评分(r=-0.644)均呈负相关,与NO(r=0.473)呈正相关(P<0.05)。见表2。
讨 论
急性脑梗死可引起血管内皮通透性改变和脑组织缺氧缺血损伤,经临床治疗后仍在血管内皮功能和神经功能尚未完全恢复的状况[10]。本研究显示脑梗死急性期患者NIHSS评分高于恢复期患者,有研究证实,急性脑梗死发生后,NIHSS评分越高,侧支循环代偿越差,加重患者神经功能受损[11]。本研究还显示,急性期组、恢复期组和对照组受试者VEGF、ET-1水平依次降低,NO、miR-25表达水平依次升高,提示血管内皮功能损伤与急性脑梗死患者病情发展有关。在急性脑梗死发生到恢复阶段低氧作为一种信号激活VEGF/VEGF受体系统,诱导半暗带VEGF高表达,促进新生血管生成,加快急性脑梗死患者的恢复。当机体发生急性脑梗死后,会导致NO分泌下降、ET-1合成增多,破坏两者平衡,引起脑梗死边缘侧支血管强烈收缩,进一步减少病灶周围血管流量,加重脑损伤[12-13]。
近年来,miR-25在脑血管疾病中发挥重要作用,可靶向作用于脑血管生成基因,调控正常脑血管生成及发育。有研究证实,miR-25的靶基因参与细胞增殖、分化、应激、炎症反应等多种生物活动调节,在急性脑梗死的发生中发挥着重要作用[14]。本研究发现疾病恢复期轻度组、中度组和重度组患者血清miR-25表达水平依次降低,提示miR-25可能参与急性脑梗死的发生发展过程。Pearson相关分析结果发现,恢复期患者miR-25表达水平与NHISS评分呈负相关,提示miR-25表达水平与神经功能密切相关。Zhou等[15]在急性缺血性中风研究中发现,miR-25可通过抑制人组蛋白去乙酰化酶3(HDAC3)和重组人失调蛋白3(ATXN3)从而减少神经元损失,减少大鼠梗死面积和神经元凋亡,提高神经元和轴突的可塑性,保护神经功能。miR-25还可在大动脉粥样硬化性脑卒中患者中可通过调控人脐静脉内皮细胞(HUVECS)增殖、迁移和早期凋亡,从而保护神经功能[16]。因此,猜测急性脑梗死恢复期患者中miR-25可能靶向作用于多种促营养、促生长的细胞因子,进而影响神经功能的恢复情况。
本研究还发现,血清miR-25表达水平与VEGF、ET-1均呈负相关,与NO呈正相关,表明miR-25表达水平与血管内皮功能密切相关。miR-25可通过抑制线粒体凋亡过程,对抗氧化应激损伤,从而影响ET-1和NO的表达[17]。Lian等[18]在研究中发现,miR-25-3p可通过靶向调节抑制T-细胞泛素配体-2/脾酪氨酸激酶信号通路调节VEGFR-2的磷酸化,而VEGFR-2在VEGF的信号转导和血管内皮生成中起主导作用,因此miR-25可通过影响VEGFR-2调控VEGF的表达。miR-25还可通过抑制细胞增殖和Ki-67表达,调控血管平滑肌细胞的增殖,直接影响血管内皮细胞,调控血管内皮功能[19]。故推测miR-25与血管内皮功能可能存在一定相关性,可通过调控miR-25水平促进血管再生,减轻患者病情。
综上所述,miR-25在急性脑梗死恢复期患者中异常低表达,且与恢复期患者的血管内皮功能和神经功能密切相关,可有望成为改善急性脑梗死患者恢复期神经功能和血管内皮功能的潜在治疗靶点。
