基于网络药理学探讨龙藤通络方治疗癌症疼痛的作用机制
2024-05-07苏羚子焦丽静
苏羚子,焦丽静,许 玲,周 迪
(上海中医药大学附属岳阳中西医结合医院,上海 200437)
癌痛特指由肿瘤直接压迫、致痛介质(炎性因子等)分泌、癌细胞浸润转移等原因,累及空腔及实质器官,诱发局部坏死、炎症等,引起疼痛,常伴有牵涉痛。疼痛作为与生活治疗相关的一个重要的因子(HRQOL),提供了生存的预后信息,对恶性肿瘤患者的生活质量产生了严重的影响。据统计,90%患者在病情发展的不同阶段出现癌痛症状,80%晚期患者可出现中重度疼痛[1]。自世界卫生组织推广实施三阶梯止痛方案以来,癌痛的治疗已取得了较大的进步,对于中重度的癌痛患者,阿片类止痛药无可取代,但其引起便秘、恶心、呼吸抑制等不良反应给患者造成了很大的困扰[2]。近年来,中医药逐渐成为临床治疗癌痛的辅助手段,有研究证实中医药与止痛药的结合使用,可以提高止痛药的疗效并减轻不良反应[3]。龙藤通络方由上海中医药大学特聘教授许玲教授创制,是基于长期大量临床实践而总结的经验方,由穿山龙、延胡索、川楝子、乳香、没药、络石藤、海风藤组成,具有解毒化瘀、活血通络功效。经过1项中美NIH国际合作项目,3项国家自然科学基金的研究,已授权国家发明专利(专利号:ZL201510580078.X)。课题组前期研究发现龙藤通络方外用治疗肺癌、乳腺癌、前列腺癌、肠癌等导致的疼痛临床疗效显著、使用安全,可减少阿片类药物的应用,减轻不良反应,提高生活质量[4]。基础研究提供了龙藤通络方外用治疗大鼠骨癌痛的行为学支撑,初步阐明了止痛的外周机制和部分中枢机制[5-8]。然而,目前龙藤通络方治疗癌痛的机制及分子作用机制尚未明确。因此,本研究基于网络药理学方法,探讨龙藤通络汤治疗癌痛的潜在成分、作用靶点及分子通路,阐明其作用机制。
1 资料与方法
1.1龙藤通络方药物活性成分和相关靶点的筛选利用中药系统药理学数据库与分析平台[9](https://tcmspw.com/tcmsp.php)收集龙藤通络汤中延胡索、乳香、没药、络石藤、海风藤、川楝子的化合物成分。以口服生物利用度为≥30%、药物相似性≥0.18为阈值设置ADME属性,获取药物相关活性成分,再利用该平台获取活性成分作用的蛋白质靶点信息。由于TCMSP数据库中未找到穿山龙相关的靶点,因此,穿山龙的化合物成分通过Batman-TCM数据库[10](http://bionet.ncpsb.org.cn/batman-tcm/)进行补充,选取得分>20分的成分靶点纳入。所有靶点经UniProt数据库[11](https://www.uniprot.org/)校正, 去掉非人类靶点。
1.2癌症疼痛相关靶点的筛选 以“cancer pain”为关键词,在GeneCards数据库[12](https://www.genecards.org/),NCBI基因数据库[13](https://www.ncbi.nlm.nih.gov/)以及DisGeNET数据库[14](https://www.disgenet.org/)进行人类基因检索。其中,GeneCards数据库的靶点根据得分进行中位值的筛选以获得更加相关的靶点。
1.3龙藤通络汤活性成分-癌痛靶点的可视化网络的构建 利用网络在线工具Venny 2.1.0 (http://bioinfogn.cnb.csic.es/tools/venny/),针对龙藤通络汤活性成分的作用靶点与癌痛的靶点绘制韦恩图,所得的交集靶点即为龙藤通络汤作用于癌痛的靶点。利用Cystoscape 3.8.0对前期收集到的关于药物成分和交集靶点的数据进行可视化处理,构建“药物活性成分-癌痛靶点”网络,选择Network Analyzer工具进行拓扑分析。
1.4蛋白互作网络图的构建及关键靶点的获取将药物疾病共有靶点导入String数据库[15](https://string-db.org/cgi/input.pl)构建蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络模型,选择生物种类为“Homo sapiens”,可信度>0.9,得到PPI 网络图。将PPI网络导入Cystoscape 3.8.0[16]中,构建通过NetworkAnalyzer工具进行拓扑分析,通过degree排序,选取分值大于平均分的基因作为关键靶点,总共筛选出个61关键靶点,将前20个靶点使用R 4.0.3进行图片绘制,横坐标为每个靶点的度值。通过插件MCODE[17]进行基因簇的分析以及核心靶点的筛选。
1.5基因本体(Gene ontology,GO)生物过程分析将药物疾病交集靶点进行GO的生物过程(biological process,BP)、分子功能(molecular function,MF)、细胞组分(cell component,CC)富集,引用String 数据库,将校正P值<0.05的项目进行筛选。
1.6京都基因与基因组百科全书(Kypyo encyclopedia of genes and genomes,KEGG)通路富集分析 将药物疾病共有靶点进行KEGG通路富集分析,引用String 数据库,将校正P值<0.05的项目进行筛选, 且从小到大排序作为筛选条件, 选取符合条件的前20位的KEGG通路。
1.7“成分-疾病-通路-靶点”网络构建 利用Cytoscape 3.8.0中的关联功能, 合并活性成分-疾病-通路-靶点网络图,在输出结果中,以不同颜色的节点分别表示活性成分、疾病、通路和靶点。化合物和潜在靶点通过边缘(edge)相连,目标蛋白和通路也通过边缘相连。
2 结 果
2.1龙藤通络汤药物活性成分和相关作用靶点通过TCMSP数据库检索检索延胡索、乳香、没药、络石藤、海风藤、川楝子的化合物成分和靶点,经汇总删重后,获得延胡索活性成分49种及其作用靶点201个;获得乳香活性成分8种及其作用靶点11个;获得没药活性成分45种及其作用靶点184个;获得络石藤活性成分9种及其作用靶点112个;获得海风藤活性成分21个及其作用靶点54个;获得川楝子活性成分9种及其作用靶点144个;获得穿山龙活性成分3种及其作用靶点128个靶点。
2.2癌症疼痛靶点 在GeneCards 数据库中根据关键词“cancer pain”获得癌痛相关靶点2 946个;在NCBI数据库中获癌痛相关靶点447个;在DisGeNET数据库获得62个相关靶点。将这3个数据库的基因合并删重之后,得到8 019个癌痛相关基因。
2.3龙藤通络汤活性成分-癌症疼痛靶点的可视化网络 将筛选出的药物有效成分靶点与癌痛靶点输入软件Venny 2.1,制作韦恩图,得到215个交集靶点,见图1。交集靶点对应龙藤通络汤中的113个化学成分,见表1。为了更好地理解成分、疾病以及相应靶点之间的复杂作用关系,使用Cytoscape 3.8.0构建成分-疾病-靶点网络图,见图2。将成分-疾病-靶点网络图导入Cytoscape 3.8.0进行拓扑分析,将成分按度值大小排序,度值越高成分越重要,度值最高的药物活性成分为槲皮素(度值为121,介度为0.144 852,紧密度为0.510 638),其次为木樨草素(度值为51,介度为0.409 756,紧密度为0.025 654)、豆甾醇(度值为28,介度为0.400 955,紧密度为0.014 448),推测槲皮苷、木樨草素、豆甾醇为龙藤通络汤治疗癌痛的主要成分,见表2。
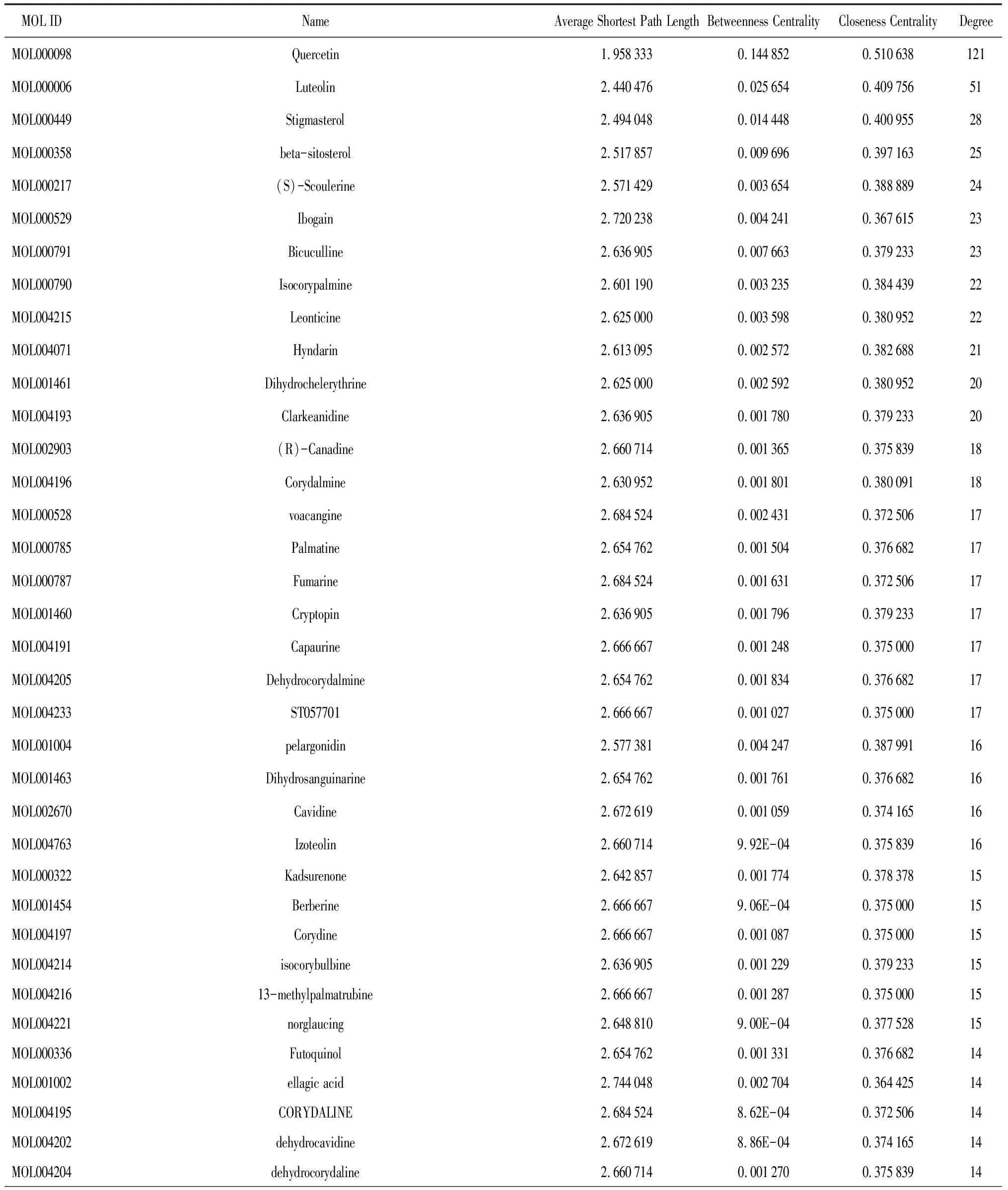
表1 交集靶点对应龙藤通络汤中的113个化学成分信息

表2 MCODE聚类分析详细信息

图1 龙藤通络方-癌痛的共有靶点韦恩图
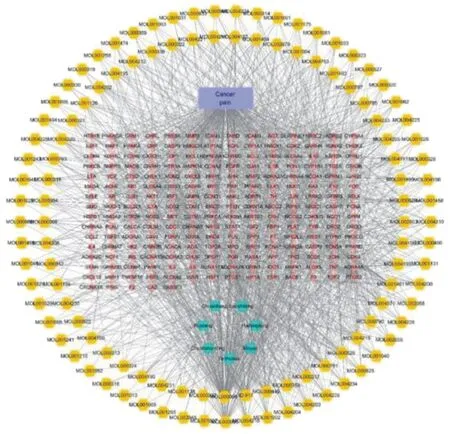
注:网络中黄色为活性成分,粉色为药物作用于疾病的靶点,绿色为中药,蓝色矩形为疾病
2.4PPI网络构建及关键靶点的获取 将交集靶点数据输入String数据库进行PPI网络的构建,该网络中有215个节点,723条边,平均度值为6.67,见图3和图4(图3为string网站导出的PPI网络图,图2为Cytoscape软件绘制PPI网络图)。将PPI网络导入Cystoscape 3.8.0中,通过Network Analyzer工具进行拓扑分析,通过degree排序,选取分值大于平均分的基因作为关键靶点,总共筛选出个61关键靶点,将前20个靶点,即STAT1、NCOA1、AR、RXRA、CCND1、EGFR、CDKN1A、RB1、MYC、IL6、CAV1、FOS、MAPK14、ESR1、TNF、RELA、JUN、MAPK1、AKT1、HSP90AA1,使用R 4.0.3进行图片绘制,横坐标为每个靶点的度值,见图5。度值越大,节点越大,则蛋白之间的关系越密切,其中度值排名前4位的靶点即HSP90AA1、AKT1、MAPK1。通过MCODE分析进行核心基因的筛选。将已经构建好的PPI网络导入Cytoscape 3.8.0中,使用MCODE模块进行基因簇的分析以及核心靶点的筛选。总共得到10个基因簇和8个核心基因,核心基因为PARP1、CXCL8、CDK2、CHRNA7、PPARG、GRIN2A、VCAM1、MMP3,见表2。
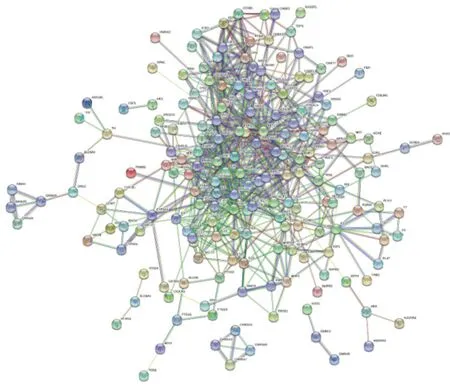
图3 龙藤通络方活性成分癌痛交集靶点的PPI网络图
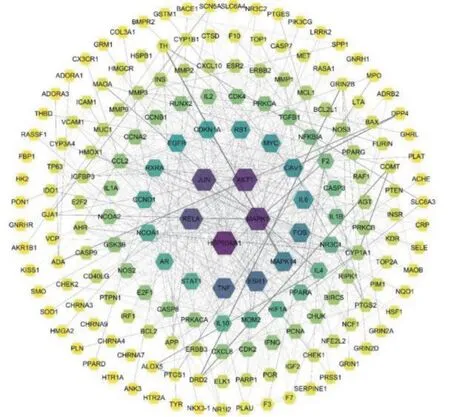
注:图中的节点颜色和大小根据度值调整,越大,颜色越深,度值越大;线的粗细,从粗到细表示edge betweenness从大到小
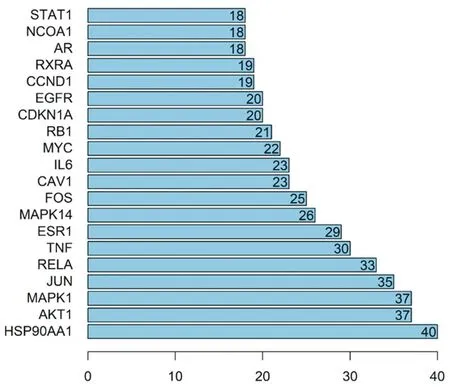
图5 龙藤通络汤作用靶点拓扑分析靶点的度值
2.5GO功能富集分析及KEGG通路富集分析通过R语言软件的clusterProfiler对交集靶点进行GO功能富集分析,结果富集到生物进程条目2 682项,分子功能188项,细胞组成124项。结果显示,龙藤通络汤治疗癌痛相关靶点参与的生物进程主要包括对药物的反应、对金属离子的反应、对脂多糖的反应、对细菌起源分子的反应等。涉及的主要细胞组分包括膜阀、膜微区、膜区域、等离子膜伐等。涉及的分子功能包括神经递质受体活性、核受体活性、配体活化、转录因子活性、DNA结合转录因子结合等。输出各组分排名前10的条目,绘制成气泡图,见图6。通过R语言软件的clusterProfiler对交集靶点进行KEGG通路富集分析,结果富集到龙藤通络汤治疗癌痛的信号通路共175条,参与通络主要涉及糖尿病并发症中的AGE-RAGE信号通路、TNF信号通路、IL-17信号通路等。龙藤通络汤的有效成分可能通过作用于这些信号通路达到治疗癌痛的目的。将富集结果绘制出气泡图,见图7。

注:BP、CC、MF分别代表生物进程、细胞组分、分子功能
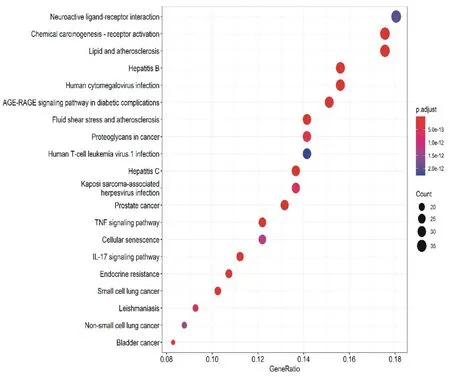
图7 龙藤通络汤治疗癌痛交集靶点的KEGG通路富集分析(仅展示前20位)
2.6成分-疾病-通路-靶点网络构建 选取核心的-个基因,制作“成分-疾病-通路-靶点”的网络关系表,将其导入Cytoscape 3.8.0软件,构建出龙藤通络汤治疗癌痛的通路网络图,更直观地展示中药活性成分在治疗疾病过程中的多成分-多靶点的作用特点,见图8。
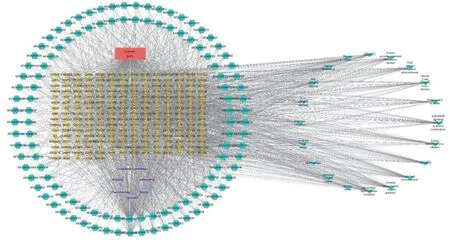
注:绿色为化合物,黄色为中药作用于疾病的靶点,蓝色为最显著的前20条通路,紫色为疾病,红色为中药
3 讨 论
癌性疼痛是中、晚期癌症患者最常见、最痛苦的症状之一,对患者临床治疗的依从性与生活质量均有较大的影响。目前,三阶梯止痛药物在癌性疼痛中的应用十分普遍,但并不能让所有患者受益,且该类药物会导致便秘、恶心、呼吸抑制等不良反应, 如何有效止痛,并最大限度地改善晚期癌痛患者地生活质量是临床面临地重大课题。
古代中医典籍中,对疼痛的认识,《内经》《诸病源候论》《千金方》《证治要诀》等经典中皆有记载,早在《内经》就记载有“寒入经而稽迟,泣润而不行,客于脉外则血少,客于脉中则气不通,故猝然而痛……”在古代典籍中虽无癌痛的直接命名,但有许多类似于癌痛的具体描述。如《内经》中有“大骨枯槁、大肉下陷、胸中气满、喘息不便、内痛引肩颈”的描述,极似肺癌晚期疼痛。《证治要诀》中“痞积在胃脘,大如覆杯,痞塞不通,背痛心痛”是对临床肝癌痛表现的描述。许玲教授在长期临床实践的基础上,认为气滞血瘀、脉络不通为癌痛的主要病机,并贯穿其整个病理过程,治疗时强调行气活血、通络止痛,并组方龙藤通络方。方中穿山龙活血舒筋,延胡索、川楝子理气散瘀,乳香、没药活血化瘀、消肿止痛,佐以海风藤、络石藤加强祛风通络、理气止痛之功效。此方在行气活血的同时,又可解毒散结、通络止痛。中药单体及复方的研究是现代中医治疗疾病的主要方法,通过潜在的多成分、多靶点相互作用起到治疗效果,在复杂疾病的治疗中发挥了重要作用。通过现代药理学、网络药理学等研究可进一步对药物成分及生物信息得以进一步的认识,从而呈现药物、疾病、靶点之间的相互关系。现代药理学对龙藤通络方中诸药已有一定的认识。其中,穿山龙具有抗炎、镇痛作用,其机制可能与抑制体内IL-1β与IL-6表达有关[18]。延胡索味辛、苦,性温,具有活血散瘀、理气止痛的功效,现代药理学研究显示,延胡索总碱的镇痛效价是吗啡的40%,其镇痛高峰可维持约2 h[19]。川楝子味苦,性寒,具有泻热疏肝、行气镇痛功效,研究表明川楝子醇提取物具有抗炎镇痛的作用[20]。没药味辛、苦,性平,乳香味辛、苦,性温,具有活血化瘀止痛功效,现代药理学研究表明,乳香和没药具有抗炎、抗肿瘤、抗菌、镇痛等作用,其中对神经性疼痛的止痛效果显著[21]。海风藤味辛、苦,性微温,具有祛风湿、通经络、止痹痛的功效。研究表明海风藤提取物能通过抑制环氧合酶-1(COX-1)和5-LOX减少前列腺素和白细胞三烯的生物合成,海风藤正丁醇提取物可减缓炎症反应,并可延长疼痛反应出现的时间[22-23]。络石藤主要成分为络石藤总黄酮,实验证明该物质可明显提高小鼠热板反应的痛阈值,具有抗炎镇痛作用[24]。
本研究直观地呈现了113个化合物成分、10个基因簇、8个核心基因和175条作用通路和癌性疼痛疾病间的关联。经初步筛选发现,龙藤通络方作用于癌性疼痛靶基因的主要活性成分以槲皮素、木樨草素、豆甾醇为主。槲皮素是植物界分布广泛,具有多种生物活性的黄酮醇类化合物,已被证明有抗氧化、抗炎和抗增殖作用,具有潜在的抗癌特性[25]。动物和细胞实验表明,槲皮素可在各种恶性肿瘤中下调AKT1、PTGS2和VEGFA的表达并上调TP53的表达,这些恶性肿瘤包括乳腺癌、前列腺癌和非小细胞肺癌,它们是最容易发生骨转移的排名前3位的恶性肿瘤。木犀草素是一种在植物中发现的类黄酮。它可抑制肿瘤细胞的增殖,激活细胞周期阻滞,通过不同的信号通路诱导凋亡,在体外和体内阻止癌症的发展[26]。木犀草素还可通过细胞骨架收缩、诱导上皮生物标志物E-cadherin表达以及下调间充质生物标志物N-cadherin、snail和vimentin等机制逆转上皮-间充质转化[27]。豆甾醇属于植物甾醇,具有较强的生理活性和表面活性。体外试验研究发现,豆甾醇能明显抑制LPS诱导的环氧合酶-2(COX-2)、诱导型一氧化氮合酶(iNOS)mRNA和蛋白水平的提高,抑制前列腺E2和一氧化氮的释放,具有抗炎的作用[28]。有研究发现,口服0.3~3 mg/kg豆甾醇,对醋酸诱导的扭体试验、手术切口引起的机械性疼痛、部分坐骨神经结扎等多种急慢性疼痛模型表现出非常有效的镇痛作用[29]。
PPI分析结果显示,度值排名前3的靶点分别是HSP90AA1、AKT1、MAPK1、JUN。热休克蛋白(heat shock protein,HSP)是一类高度保守的蛋白质,参与多种生物过程,HSP90AA1作为家族的重要成员,可通过其C末端结构域嵌入脂质双层中,在应激条件下对膜稳定具有重要作用。Lei等[30]实验发现,HSP90通过ERK机制调节疼痛行为,能够提高吗啡的镇痛效果,减少吗啡的不良反应。丝氨酸/苏氨酸蛋白激酶(AKT)的激活可导致各种刺激引起的疼痛[31]。AKT1是3种蛋白激酶之一,参与多个炎症、免疫、代谢和细胞增殖相关的信号通路[32]。AKT蛋白在大多数癌症类型中都高度表达,包括肺癌、肝癌、乳腺癌和结肠癌,其中AKT1是治疗癌症的主要靶点,在细胞增殖和抗凋亡的过程中发挥作用。mTOR是AKT通路的下游激酶之一,在疼痛相关的中枢神经系统中被激活,并作为阿片类药物诱导痛觉过敏的有效靶点。AKT-mTOR信号级联参与了一些生理和病理过程,如吗啡耐受、痛觉过敏、血管生成等[33]。JUN属于转录因子活化蛋白1,包括c-Jun、JunB、JunD, 其中多以c-Jun为主。c-Jun被活性氧激活后,可上调基质金属蛋白酶2表达,从而增强癌细胞的侵袭和迁移能力,促进癌细胞扩散,加速癌症病程进展,加重症状表现。
GO和KEGG富集分析进一步揭示了龙藤通络汤治疗癌痛的作用机制。通过对龙藤通络方治疗癌性疼痛的8个核心基因进行GO生物进程富集,显示龙藤通络方治疗癌痛主要涉及对药物的反应、对金属离子的反应、对脂多糖的反应、对细菌起源分子的反应等生物进程,膜阀、膜微区、膜区域、等离子膜伐等细胞组分,神经递质受体活性、核受体活性、配体活化、转录因子活性、DNA结合转录因子结合等分子功能。KEGG富集分析发现,上述生物进程的主要通路涉及AGE-RAGE信号通路、TNF信号通路、IL-17信号通路等。AGE-RAGE信号通路通过激活PKC/JNK/NF-κB信号通路,促进炎症因子IL-1、IL-6、TNF-α等的表达与释放,从而引起炎症反应的发生[34]。除此之外,它还可以激活PCK/PK-1信号通路,使得MCP-1、MMP-2、ICAM-1等蛋白过表达,使得血液黏滞度增加。IL-17信号通路和肿瘤坏死因子通路与炎症、免疫调节相关,IL-17可与TNF-α共同诱导细胞产生炎症因子IL-6,而IL-6不仅可促进C反应蛋白的生成,也对IL-17有正向反馈作用,三者互相影响加重炎症反应[35]。此外,已有研究发现IL-17与其他疾病(如多发性硬化症)的疼痛症状有关[36]。肿瘤坏死因子α是一种促炎因子,可由肿瘤或受肿瘤刺激的周围组织产生,与肿瘤的生长、转移密切相关。Constantin等[37]发现,TNF-α拮抗剂对于降低热源性痛觉和机械性疼痛敏感性具有一定作用。
本研究初步阐释了龙藤通络方治疗癌性疼痛的潜在活性成分及其可能的作用机制,筛选出槲皮苷、木樨草素、豆甾醇等活性成分,JUN、MAPK1、AKT1、HSP90AA1等作用靶点,以及AGE-RAGE信号通路、TNF信号通路、IL-17信号通路等与疾病发生相关的通路。通过调控上述靶点和信号通路,减少癌细胞增殖,减少致痛介质释放,缓解因肿瘤生长引起的牵涉痛及炎性因子相关性疼痛,从而达到治疗癌痛的目的。为研究龙藤通络汤的分子机制提供了依据,为癌痛的治疗提供了新的选择。然而,本研究基于网络大数据得到的预测,存在一定的局限性,结果还需要通过动物体内实验和细胞体外实验进一步验证。
利益冲突:所有作者均声明不存在利益冲突。
