蟾酥诱发人成骨肉瘤MG-63细胞凋亡的作用机制研究
2024-05-07卞泗善苏庆红滕加文赵新芝
卞泗善,苏庆红,秦 燕,滕加文,赵新芝
(1. 山东中医药大学附属医院,山东 济南 250014;2. 山东第一医科大学,山东 济南 250000;3. 济南市中西医结合医院,山东 济南 271100;4. 山东省中医药研究院,山东 济南 250014)
骨肉瘤是临床常见的骨恶性肿瘤,恶性增殖的肉瘤细胞可产生肿瘤性骨样组织或不成熟骨,甚至肿瘤可穿过骨骺侵犯关节,预后多较差。目前关于骨肉瘤发生及进展的具体机制尚不十分清楚,西医主要采用手术、化疗、放疗相结合的综合疗法治疗,其中约有30%的患者对化疗药物不敏感[1],截肢治疗后的3~5年存活率仅为5%~20%[2],而且放化疗过程中存在着严重的胃肠道反应、骨髓抑制、心肌损害等不良反应。目前中药治疗骨肉瘤的临床效果得到广泛认可,主要体现在控制病情、提高免疫、增效减毒、控制术后复发等方面。蟾酥具有解毒去积的功效,其有效成分具有广谱抗癌活性[3-4]。既往实验研究发现,蟾酥可以调控人骨肉瘤细胞的凋亡、迁移及侵袭[5-6],但作用机制有待明确。基于此,本研究探讨了不同浓度的蟾酥对人成骨肉瘤MG-63细胞的影响及其可能的作用机制。
1 实验材料与方法
1.1实验动物 30只SPF级雄性C57BL/6J小鼠,鼠龄6~8周,体重(20±3)g,购自济南朋悦实验动物繁育有限公司,实验动物许可证号:SCXK[鲁]20190003。小鼠饲养在山东中医大学动物实验中心,每笼4~6只,使用SPF级垫料(山东中医大学动物实验中心提供),每2 d更换1次垫料;保持环境温度(21±1)℃,相对湿度(50±5)%,明暗时间为12/12,自由获取饮用水(自来水沸腾后常温冷却水)和标准饲料(11.5%的脂肪、20.8%的蛋白质和67.7%的碳水化合物,鲁抗,济宁) ,适应性喂养1周。动物处置符合《实验动物管理条例》要求。
1.2实验细胞、药物及主要试剂和仪器 人骨肉瘤细胞系MG-63(中科院上海细胞库),DMEM培养液(美国HyClone公司);蟾酥水溶液(山东中医药大学附属医院中心实验室提供,货号:20170601;1 g蟾酥里含蟾毒灵、华蟾酥毒基和脂蟾毒配基的总量是6.8%,即为0.068 g);特级胎牛血清(以色列BI公司); CCK-8溶液(南京诺唯赞医疗科技有限公司,批号:A311-02-AA);结晶紫染色液(武汉赛维尔生物科技有限公司,批号:G1014);膜联蛋白V-FITC/PI细胞凋亡检测试剂盒(南京诺唯赞医疗科技有限公司,批号:A211-02),胰酶细胞消化液(春仕生物科技有限公司,批号:BL512A);整合素α4(Integrin α4,武汉三鹰生物有限公司,批号:19676-1-AP,1∶200);抗狂犬病IgG Fab2 Alexa Fluor®488分子探针(美国CST公司,批号:4412S,1∶100);碱性磷酸酶(ALP)检测试剂盒(上海碧云天生物技术有限公司,批号:P0321S);钙盐染色液(改良茜素红S法)(北京索莱宝科技有限公司,批号:G3280);多功能酶标仪(美国BIO-RAD公司);显微镜(日本尼康公司);Transwell 小室(美国康宁公司);流式细胞仪(美国BD公司);研究级正置荧光显微镜(日本尼康公司)。
1.3含药血清制备方法 将30只C57 BL/ 6J小鼠随机分为3组,每组10只。蟾酥低剂量组给予100 μg/mL浓度蟾酥水溶液灌胃,蟾酥高剂量组给予200 μg/mL浓度蟾酥水溶液灌胃,空白组给予生理盐水灌胃,灌胃量均为6 mL/kg,2次/d,连续灌胃7 d。末次灌胃2 h后,腹主动脉采血,无菌分离血清,灭活后-20 ℃保存备用。
1.4MG-63细胞培养及传代 将细胞小心从-80 ℃冰箱取出,放入37 ℃水浴锅中,使细胞在1~2 min内完全解冻后转移至T25细胞培养瓶,4~5 h后换液,将细胞悬液转移至15 mL离心管中,封好口后,室温1 000 r/min离心5 min。加入4~6 mL培养基重悬,转移至2-3皿100 mm细胞培养皿。
1.5检测指标及方法
1.5.1细胞增殖情况 实验分为对照组、2.5%蟾酥含药血清组和5%蟾酥含药血清组,每组设3个复孔。将MG-63细胞按3×103个/孔接种于96孔板上,每孔加入200 μL培养液,接种后8 h细胞完全贴壁,将培养液换成不含血清的基础培养基培养24 h。然后2.5%蟾酥含药血清组和5%蟾酥含药血清组分别加入相应浓度的蟾酥含药血清,对照组加入等体积PBS。分别于培养24 h、48 h、72 h后,于检测板的所有复孔预留100 μL的培养液,每孔直接加入10μL的CCK-8,放回培养箱中原条件孵育4 h。之后弃去上清,每孔加入100 μL 10%的 SDS,37 ℃过夜培养。酶标仪检测各孔570 nm处吸光度,记录各组OD值。实验重复3次。
1.5.2细胞凋亡情况 将对数生长期细胞消化、离心和重悬后,以每孔(15~20)×104个细胞的密度接种于6孔板。实验分3组,2.5%蟾酥含药血清组和5%蟾酥含药血清组分别加入相应浓度的蟾酥含药血清,对照组加入等体积PBS,待处理结束后收集细胞,将细胞悬液收集至EP管中,1 000 r/min离心5 min。加入4~6 mL培养基重悬,转移至2-3皿100 mm细胞培养皿。离心5 min,弃上清。用预冷的PBS清洗细胞2次,1 000 r/min离心5 min。加入4~6 mL培养基重悬,转移至2-3皿100 mm细胞培养皿,离心5 min。加入300 μL 1×Bind buffer重悬(Bind buffer 现用现配),加入5 μL FITC Annexin V和5 μL PI,避光室温孵育15 min。每管加入500~600 μL Bind buffer重悬,在1 h内进行上机检测。
1.5.3细胞分化情况 以PNPP法检测细胞中ALP活性。细胞按2×104个/孔接种于24孔板,24 h细胞周期同步后更换新鲜诱导培养液。实验分3组,2.5%蟾酥含药血清组和5%蟾酥含药血清组分别加入相应浓度的蟾酥含药血清,对照组加入等体积PBS,每组均设3个复孔,每3 d换液1次,并补加刺激,继续培养9 d后,吸弃培养液,加入1% TritonX-100溶液200 μL,置4 ℃冰箱中放置1 h以裂解细胞,离心取上清,按ALP检测试剂盒及蛋白定量检测试剂盒分别测定ALP活性和蛋白含量,以IU/g蛋白质表示ALP活性,结果与对照组比较。
1.5.4细胞成骨情况 将MG-63细胞消化下来,铺板于24孔板中,每孔加入500 μL 10%FBS培养基,于37 ℃、5% CO2孵箱培养。待细胞增殖至融合度70%~80%时,按照“1.5.1”分组处理细胞48 h,弃掉原有培养基,加入4%成骨分化诱导液,诱导成骨分化21d,弃掉成骨分化培养基,分别加1 mL PBS润洗小室2~3次,加500 μL 4%多聚甲醛室温避光固定细胞30 min,回收多余的多聚甲醛,分别加1 mL PBS润洗小室2~3次,晾干小室。加入300 μL茜素红,室温孵育30 min,弃掉茜素红,分别加1 mL PBS润洗小室2~3次,晾干小室于显微镜下拍照保存。
1.5.5细胞侵袭转移情况 取预冷24 h的Transwell培养板,将30 μL MatrigelTM人工基质胶(无血清培养基按1∶3配置)铺在Transwell装置的上室并静置3 h。取对数生长期的MG-63细胞2×105个/mL,置于上室的胶层上。在24孔板下室加入10%胎牛血清+RPMI 1640培养液500 μL。提前用无血清培养基、2.5%蟾酥含药血清、5%蟾酥含药血清提前处理MG-63细胞24 h。于37 ℃、5% CO2孵育箱中培养24 h,然后用PBS液冲洗胶层,室温下用95%甲醇固定15 min,用结晶紫染色15 min。 高倍镜(200×)下随机对5个视野的细胞进行连续计数,取均值。实验重复3次。
1.5.6细胞中Integrin α 4表达情况 采用流式细胞仪技术定量检测:重悬贴壁培养的MG-63细胞,400目筛网去除细胞团块后均分成3组,2.5%蟾酥含药血清组和5%蟾酥含药血清组分别加入相应浓度的蟾酥含药血清,对照组加入等体积PBS,每组做3个复孔,继续培养24~72 h。以P4G9和阴性对照CBL600(1∶300)为一抗,羊抗鼠荧光素交联IgG(1∶1000)为二抗。冰上常规细胞免疫染色标记30 min,1 g/mL碘化丙啶对抗染色15 min,上机检测Integrin α4表达情况。
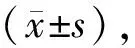
2 结 果
2.1各组人骨肉瘤MG-63细胞增殖情况 不同浓度蟾酥含药血清组各时间点细胞增殖率均明显低于同期对照组(P均<0.05),且5%蟾酥含药血清组各时间点细胞增殖率均明显低于同期2.5%蟾酥含药血清组(P均<0.05)。见表1。
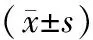
表1 对照组和不同浓度蟾酥含药血清组人骨肉瘤MG-63细胞增殖情况比较
2.2各组人骨肉瘤MG-63细胞凋亡情况 对照组、2.5%蟾酥含药血清组、5%蟾酥含药血清组细胞凋亡率分别为(4.95±0.21)%、(8.23±0.28)%、(14.65±0.25)%,不同浓度蟾酥含药血清组细胞凋亡率均明显高于对照组(P均<0.05),且5%蟾酥含药血清组细胞凋亡率明显高于2.5%蟾酥含药血清组(P<0.05)。见图1。

图1 对照组和不同浓度蟾酥含药血清组人骨肉瘤MG-63细胞凋亡情况
2.3各组人骨肉瘤MG-63细胞分化和成骨能力比较 对照组、2.5%蟾酥含药血清组、 5%蟾酥含药血清组ALP活性分别为(110.32±2.21)IU/g、(132.18±3.51)IU/g、(167.65±5.11)IU/g,不同浓度蟾酥含药血清组ALP活性均明显高于对照组(P均<0.05),且5%蟾酥含药血清组明显高于2.5%蟾酥含药血清组(P<0.05)。茜素红染色显示,与对照组相比,不同浓度含药血清组有橘红色结节、边界清楚细胞增多,见图2。
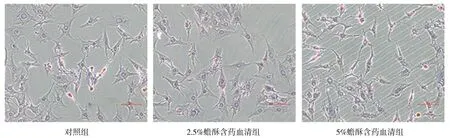
图2 对照组和不同浓度蟾酥含药血清组人骨肉瘤MG-63细胞茜素红染色情况(×100)
2.4各组人骨肉瘤MG-63细胞侵袭和转移情况比较 对照组、2.5%蟾酥含药血清组、 5%蟾酥含药血清组侵袭性细胞数量分别为(230.21±14.25)个/mL、(192.54±16.51)个/mL、(137.78±15.26)个/mL,转移性细胞数量分别为(320.56±15.05)个/mL、(272.62±14.78)个/mL、(201.63±15.32)个/mL,不同浓度蟾酥含药血清组侵袭性细胞和转移性细胞数量均明显少于对照组(P均<0.05),且5%蟾酥含药血清组均明显少于2.5%蟾酥含药血清组(P均<0.05)。见图3。
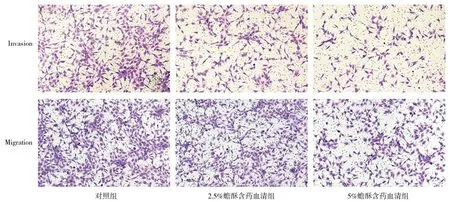
图3 对照组和不同浓度蟾酥含药血清组人骨肉瘤MG-63细胞侵袭和转移情况(×200)
2.5各组人骨肉瘤MG-63细胞中Integrin α4表达情况 对照组、2.5%蟾酥含药血清组、 5%蟾酥含药血清组细胞中Integrin α4表达占比分别为(53.23±4.23)%、(43.19±3.76)%、(26.45±3.07)%,不同浓度蟾酥含药血清组Integrin α4表达占比均明显低于对照组(P均<0.05),且5%蟾酥含药血清组明显低于2.5%蟾酥含药血清组(P<0.05)。见图4。
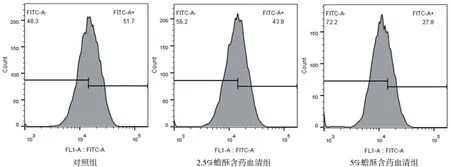
图4 对照组和不同浓度蟾酥含药血清组人骨肉瘤MG-63细胞中Integrin α4表达情况
3 讨 论
随着医学技术的飞速发展,新型辅助化疗疗法的出现,骨肉瘤患者的5年总生存率有明显提高,但耐药性和不良反应明显使骨肉瘤的治疗仍处于困境,例如甲氨蝶呤、顺铂等药物带来较好临床效果的同时,其耐药性及所带来的消化系统功能紊乱、免疫失衡,大大降低了患者的生活质量。中药可通过多靶点、多通路发挥协同作用,可用于各个时期骨肉瘤的治疗,而且这些优势随着研究的不断深入逐渐显露出来。肿瘤药物的耐药性是肿瘤患者化疗失败的主要原因,探索肿瘤药物的多药耐药的机制,寻找低毒有效、逆转耐药的中药已然成为国内外研究的热点。
骨肉瘤具有复杂的核型畸变,如染色体重排、易位、扩增和缺失等[7]。骨肉瘤细胞是一类具有多种成骨细胞表型特征的特殊肿瘤细胞,是成骨细胞分化为成熟骨细胞阶段的过渡中间体[8],具有无限增殖、可发生上皮间质细胞转化和易转移的特点[9]。相关研究发现,骨肉瘤细胞增殖受到各种分子信号调控,其中癌基因c-Myc是一种可使细胞无限增殖的关键基因[10],还可以诱导人成骨肉瘤细胞的分化[11]。整合素是细胞膜上的跨膜黏附蛋白,与恶性肿瘤的侵袭转移密切相关,其中Integrin α4可诱导MG-63细胞的恶性转移[12]。
蟾酥具有明显抗肿瘤作用,其单体化合物如脂蟾毒配基、华蟾毒素、蟾毒灵、远华嶋毒灵、蟾毒它灵、沙蟾毒精、华蟾毒它灵等对肿瘤细胞有较强的生长抑制作用[13-15]。牛天力[16]研究报道,华蟾酥毒基能在体外明显抑制多西他赛耐药的人激素非依赖性前列腺癌PC3细胞生长,并有诱导细胞凋亡的效果。赵迪等[6]实验研究显示,华蟾素毒基与顺铂联用可更有效抑制人骨肉瘤U2OS细胞增殖,诱导其凋亡。
本实验发现,不同浓度的蟾酥均可以促进MG-63细胞凋亡,改善细胞分化和成骨功能,抑制其侵袭和转移,下调Integrin α4表达,这种作用尤以5%浓度最为明显,提示蟾酥可以通过下调MG-63细胞中的Integrin α4表达抑制细胞侵袭和转移。但蟾酥有效成分颇为复杂,其所带有的毒性也大大限制了其临床应用,故寻找中药提纯方法,使抗肿瘤活性成分与毒性成分高度分离是今后的课题研究方向。
利益冲突:所有作者均声明不存在利益冲突。
