手术治疗复发性原发颅内黑色素瘤1例并文献复习
2024-05-07李剑杨柳张曙顾志恺严耀华沈剑虹
李剑 杨柳 张曙 顾志恺 严耀华 沈剑虹


【摘要】目的探讨原发性颅内黑色素瘤的临床表现、诊断及复发后的治疗。方法回顾性分析南通大学附属医院2022年4月收治的1例经病理检查证实的原发性颅内黑色素瘤复发病例,结合相关文献总结颅内黑色素瘤的临床表现、影像学特征、病理诊断及治疗方法。结果患者经首次手术全切除后病理报告为恶性黑色素瘤,术后未行放化疗等后续辅助治疗,随访7年余复发,二次术后恢复良好,随访5月余未见复发。结论原发性颅内黑色素瘤长期生存者较罕见,其影像学表现多变,术前易误诊,手术全切除是治疗关键,对于复发病例重复切除仍是延长生存期的方案;放化疗效果不确切,手术结合立体定性放射治疗、靶向治疗、免疫治疗等综合方案似乎是原发性颅内黑色素瘤的最佳方案。
【关键词】黑色素瘤;颅内;原发性;诊断;治疗
【中图分类号】R739.41【文献标志码】B【文章编号】1672-7770(2024)01-0110-04
Surgical treatment for recurrent primary intracranial melanoma: a case report and literature review LI Jian, YANG Liu, ZHANG Shu, et al. Department of neurosurgery, Affiliated Hospital of Nantong University, Nantong 226000,China
Corresponding author: YANG Liu
Abstract: ObjectiveTo investigate the clinical manifestations, diagnosis and treatment for recurrent primary intracranial melanoma. MethodsA case of recurrent primary intracranial melanoma which confirmed by pathological examination admitted to Nantong University Affiliated Hospital in April 2022 was analyzed retrospectively, and the clinical manifestations, imaging features, pathological diagnosis and treatment methods of intracranial melanoma were summarized in combination with relevant literature. ResultsTotal resection was performed in the first operation, and the pathological report was malignant melanoma. No radiotherapy and chemotherapy were performed after the operation. The follow-up period was more than 7 years, and there was no recurrence for 5 months after the second operation. ConclusionsLong-term survival of primary intracranial melanoma is rare, and its imaging manifestations are variable, and easy to misdiagnose before surgery. Total surgical resection is the key, and aggressively repeated surgical resection remains beneficial for recurrent cases. The effect of radiotherapy and chemotherapy are uncertain. Indeed, surgery combined with stereotactic radiosurgery(SRS), targeted therapy, immunotherapy seem to be the best solution for primary intracranial melanoma.
Key words: melanoma; intracranial; primary; diagnosis; treatment
作者單位:226000 南通,南通大学附属医院神经外科(李剑,杨柳,顾志恺,严耀华,沈剑虹),病理科(张曙)
通信作者:杨柳
原发性颅内黑色素瘤较为罕见,约占颅内肿瘤的0.07%~0.17%;恶性程度高,临床表现无特殊性,术前初次定性诊断较困难,预后不良,多数患者即使手术后仍短期复发或死亡,长期生存者更是罕见。本研究回顾性分析南通大学附属医院2022年4月收治的1例经手术切除、病理结果证实为原发性颅内黑色素瘤的病例,经过长达7年余随访,原位复发再次手术,现仍生存良好,并结合文献分析,以加深对复发性病例的认识。
1资料与方法
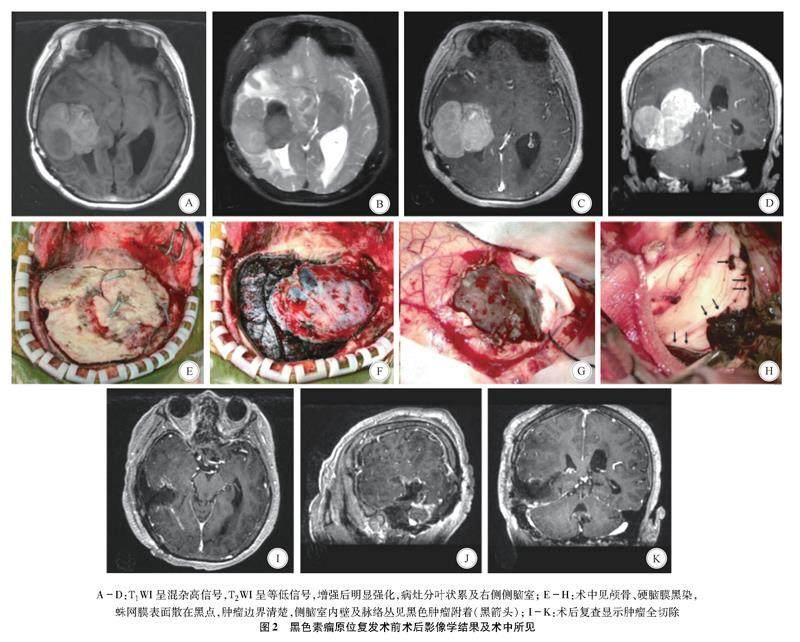
1.1一般资料患者女,63岁,因“反应迟钝伴左侧肢体无力2月余”于2022年4月23日入院。既往2015年在南通大学附属医院行右颞叶肿瘤切除术(图1),病理结合免疫组化检查(Envision法):HMB45(+)、S-100(+)、Melan-A(+)、Vim(+)、EMA(-)、CKPan(-),考虑 “恶性黑色素瘤”,术后家属未行放化疗。入院查体示,神志清楚,不能行走,反应迟钝,言语缓慢,双侧瞳孔等大等圆;全身皮肤未见色素斑;左侧肢体肌力Ⅱ级,右侧肢体肌力Ⅳ级,肌张力正常。辅助检查计算机断层扫描(computer tomography,CT)示右侧颞枕叶等密度团块影;核磁共振成像(magnetic resonance imaging,MRI)示,右侧颞枕叶可见团块状混杂信号,大小约5.2 cm×5.0 cm×5.5 cm,T1WI呈高信号,T2WI 及T2 FLAIR 呈等低信号,弥散加权成像(diffusion weighted imaging,DWI)呈高低混杂信号,增强后明显强化,病灶累及右侧侧脑室,脑中线结构受压左偏。诊断考虑右颞枕叶黑色素瘤复发(图2 A-D)。〖FL)〗〖KH-2D〗
1.2手术方法患者于2022年4月26日在全麻下行手术治疗,术中见颅骨板障内及硬脑膜明显黑染,脑皮层即可见黑色肿瘤(图2E-G),其质脆且软,血供丰富,但止血并不困难,有不完整包膜,與脑组织边界清楚,肿瘤内部有明显陈旧性出血,呈血凝块状或黑色污泥状;显微镜下连同侵入右侧侧脑室的肿瘤一并全切除(图2H),尽可能电凝切除增厚变黑的周边硬脑膜,同时以人工硬脑膜完全替代黑染硬脑膜,骨窗及骨瓣边缘电凝灼烧,骨瓣复位固定。
1.3病理检查苏木精伊红(hematoxylin eosin,HE)染色示,细胞呈片状、束状排列,细胞核较大,多为椭圆形,核分裂象多见,考虑恶性肿瘤;免疫组化标记结果(Envision法): Melan-A(黑色素A)(+), HMB-45(+),S-100(+),SOX10(+),CKpan(-),EMA(-),LCA(-),SMA(-),CD99(-),GFAP(-),Ki-67(约20%+)。诊断:结合HE及IHC结果,符合黑色素瘤(图3)。
1.4随访首次术后未行放化疗,经过7年余的随访肿瘤复发;本次术后出院时神志清楚,左侧肢体无力好转、肌力恢复至Ⅲ-Ⅳ级;二次术后仍建议其行后续放化疗和靶向、免疫治疗等,家属依从性差及经济原因未执行,随访至今5个月余,目前能独立行走、仍生存良好。
2讨论
颅内黑色素瘤分为原发性和转移性,以转移性黑色素瘤最多见,原发性黑色素瘤十分罕见。一般认为原发性颅内黑色素瘤来源于软脑膜或蛛网膜的黑色素细胞。
本例患者首次术前也无明显定位体征,单纯以头痛头晕入院;第二次肿瘤复发,由于肿瘤体积较大、有占位效应,导致反应迟钝和左侧肢体无力、不能行走等表现。
颅内黑色素瘤CT平扫无特异性,多为类圆形、结节状影,等密度或稍高密度。MRI表现多样,主要取决于肿瘤中黑色素的含量和肿瘤内的出血量[1]。典型的黑色素瘤因含有顺磁性的黑色素物质而表现为特征性的T1WI高信号、T2WI低信号, 增强扫描呈明显强化[2]。根据瘤内黑色素含量不同,将MRI表现分为4型。(1)黑色素型: T1WI高信号、T2WI低信号;(2)非黑色素型:T1WI 低或等信号,T2WI高或等信号;(3)混合型:MRI表现出一种混合性质;(4)出血型:表现不同时期出血的MRI特征。本例患者右颞叶肿瘤原位复发,呈分叶状,内侧部分符合典型黑色素瘤MRI特征,但外侧部分信号不完全一致,增强后可见脑膜、脑室内也有强化,手术证实颞底硬脑膜、蛛网膜、颅骨均被肿瘤侵及,脑室内壁及脉络丛均见肿瘤(图2)。虽然黑色素瘤具有一定影像学特征,但由于发病率低,有时影像学特点又不典型,术前仍难以准确诊断,特别是当并发有瘤内出血时,其磁共振信号混杂多样,更易误诊为单纯脑出血或不典型脑膜瘤。有报道17例中枢神经系统原发性黑色素瘤患者仅有3 例(18%) 术前确诊[3]。本例患者首次入院时亦是误诊,术前MRI报告为脑膜瘤可能(图1)。
病理是诊断黑色素瘤的金标准。典型黑色素瘤镜下可见大而圆的黑色素细胞, 其核深染, 胞浆丰富并含数量不等的黑色素(图3A)。免疫组化检测对诊断颅内黑色素瘤有重要意义,常用的肿瘤标记物有Melan-A、HMB-45、S-100、SOX10等,其中S-100敏感性最高但特异性较差,几乎在所有的黑色素瘤细胞中表达均阳性;Melan-A和HMB-45特异性较高,但敏感度不一;SOX10被认为是诊断恶性黑素瘤高敏感且特异的标志物,在原发性和转移性黑素瘤中敏感性高达97%~100%[4];Ki-67阳性率对于鉴别黑色素瘤良性与恶性有一定的意义。本病例中多种标记物均为阳性(图3),增加了诊断准确性。故在临床病理诊断中,常需要两种及以上的免疫标志物联合使用。
基于目前诊疗水平,尽管有多种可能的治疗方法,但临床对于颅内原发性黑色素瘤的治疗结果仍不满意;由于其恶性程度高、对放疗和化疗效果不确定、治疗后易复发等特点,导致其预后较差[2,5-6]。普遍认为,原发性颅内黑色素瘤患者的预后要好于继发颅内黑色素瘤的患者。原发性颅内黑色素瘤生存期数月至数年不等,而继发性颅内恶性黑色素瘤的中位生存期只有几个月甚至更短。廖声潮等[7]报告9例颅内黑色素瘤患者的临床资料,在随访的7例中6例术后3~18个月死亡,1例原发性颅内黑色素细胞瘤患者术后36个月死亡,平均生存期仅为6.8个月。Man等[8]对原发性中枢神经系统黑色素瘤进行了一项大宗病例回顾,统计分析了84例患者的生存期,其1年、2年、3年、5年的生存期分别为89.3%、75.6%、65.2%和37.7%,中位生存期为15个月;同时得出结论年龄小于19 岁,颅内肿瘤位置是预后差的独立危险因素。Byun等[9]研究结果显示,原发性颅内黑色素瘤总生存率在6个月时为100%,到18 个月时则降至25%;无进展生存率从3个月时66.7%降至12个月时的16.7%,中位生存期不到1年。目前比较一致的观点认为,手术切除是原发性颅内黑色素瘤的首选治疗方案[3,10-11];如情况许可,则尽可能全切除肿瘤,范围包括受侵犯的颅骨、周边硬脑膜,蛛网膜、软脑膜等。本例复发患者术中值得注意的一个细节,发现首次手术后修补替换的人工硬脑膜大部分未受肿瘤侵犯黑染(图2F),硬脑膜的复发黑染则表现在人工硬脑膜周围的正常硬脑膜上,这说明首次手术切除的彻底性很重要,尽可能多切除受累的硬脑膜,甚至连同受侵犯的颅骨一并去除,再更换钛板修补缺损,对于延缓复发时间、延长生存期有利。大部分研究表明,肿瘤全切除患者的生存率及预后优于部分切除的患者[12-16]。肿瘤切除程度与患者预后呈正相关[8-13]。对于复发性颅内黑色素瘤,积极重复的手术切除仍是首选,对患者仍然有益[13]。有个案报道显示,对多次复发的原发性颅内恶性黑色素瘤经过三次手术加术后放化疗,最长生存期达22年余[14]。目前,由于原发性颅内黑色素瘤少见,尚没有标准的化疗方案,多数研究表明即使术后化疗,但效果非常有限,迄今尚未观察到总体生存率改善。同样,放疗作为辅助治疗的疗效尚不肯定且存在争议,主要被推荐用于肿瘤部分切除残留或复发的颅内黑色素瘤患者。另外,对于病灶位于功能区、脑深部、病灶较小(直径≤3 cm)、不合并明显颅高压的病例,也可建议局部放疗(立体定性放射外科治疗、γ-刀等)。Dar等[15]回顾性分析了立体定向放射外科在13例复发或残留的颅内原发性黑色素瘤患者治疗中的作用,通过24个月的中位随访,肿瘤总体局部控制率为76.9%,认为立体定向放射外科治疗是复发和残留颅内原发性黑色素细胞瘤的合理选择。其实,对于原发性颅内黑色素瘤术后辅助治疗的效果一直存在不同观点。有研究显示接受术后辅助治疗与未行辅助治疗的患者生存期无显著差异[12]。部分研究认为,根治性切除加术后放疗和/或化疗可以获得更高总体生存期[10,16-17]。也有观点认为,与单纯手术患者相比,手术联合放疗虽然延长了肿瘤局部复发的时间,但总生存期并没有明显延长。近来靶向治疗和免疫治疗得到发展[18-19],特别是对携带BRAF V600E基因突变的转移性颅内黑色素瘤,一些指南强烈建议靶向治疗可作为一线治疗选择[20-21]。Rulli等[22]认为,靶向治疗联合免疫治疗比免疫联合放疗更能改善转移性黑色素瘤的预后。虽然目前相关的靶向治疗、免疫治疗研究集中于转移性黑色素瘤,但也为它们在原发性颅内黑色素瘤中的研究与应用开辟了道路,有望成为新的治疗选择[12,16]。本例患者首次术后未行任何辅助治疗,但生存良好7年余,据此也印证了手术全切除的重要性,从另一个侧面反映了放化疗可能对延长复发和生存期效果不确定;肿瘤原位复发,再次积极手术全切除,神经功能改善、恢复良好,也说明对于复发病例重复切除仍是改善生存质量、延长生存期的关键。但由于该患者二次术后随访时间偏短,后续仍需进一步跟踪观察治疗效果。
总之,原发性颅内黑色素瘤临床较为罕见,未行辅助治疗而长期生存的更是罕见,影像学表现多变,术前易误诊,手术全切除是治疗关键,对于复发病例重复切除仍是延长生存期的首选方案;放化疗效果不确切,根治性切除结合立体定性放射治疗、靶向治疗、免疫治疗等综合方案似乎是原发性颅内黑色素瘤的最佳方案。
利益冲突:所有作者均声明不存在利益冲突。
[参 考 文 献]
[1]Setsu T,Tsuchiya A,Terai S.Changes in magnetic resonance imaging findings in a malignant melanoma patient[J].Intern Med,2020,59(13):1671-1672.
[2]刘俊杰,汪卫建,周彦汝,等.颅内恶性黑色素瘤的影像学特点分析[J].中国实用神经疾病杂志,2021,24(17):1506-1515.
[3]陈利锋,韩丽娜,刘嘉霖,等.中枢神经系统原发恶性黑色素瘤临床分析[J].临床神经外科杂志,2020,17(5):528-532.
[4]Mito JK,Conner JR,Hornick JL,et al.SOX10/keratin dual-color immunohistochemistry:an effective first-line test for the workup of epithelioid malignant neoplasms in FNA and small biopsy specimens[J].Cancer Cytopathol,2018,126(3):179-189.
[5]Curti BD,Faries MB.Recent advances in the treatment of melanoma[J].N Engl J Med,2021,384(23):2229-2240.
[6]Davis LE,Shalin SC,Tackett AJ.Current state of melanoma diagnosis and treatment[J].Cancer Biol Ther,2019,20(11):1366-1379.
[7]廖聲潮,龙飞,莫凯,等.手术治疗颅内黑色素瘤的临床疗效观察[J].中华神经外科杂志,2021,37(3):295-297.
[8]Man WT,Wang GH.Incidence,outcomes and predictors of primary central nervous system melanoma:a SEER-based study[J].World Neurosurg,2019,129:e782-e790.
[9]Byun J,Park ES,Hong SH,et al.Clinical outcomes of primary intracranial malignant melanoma and metastatic intracranial malignant melanoma[J].Clin Neurol Neurosurg,2018,164:32-38.
[10]Hani U,Bakhshi SK,Shamim MS.Primary intracranial malignant melanoma[J].J Pak Med Assoc,2020,70(3):554-556.
[11]黄银兴,望家兴,田君,等.颅内恶性黑色素瘤的外科治疗体会(附七例报道)[J].中华神经医学杂志,2020,19(8):820-824.
[12]Arai N,Kagami H,Mine Y,et al.Primary solitary intracranial malignant melanoma:a systematic review of literature[J].World Neurosurg,2018,117:386-393.
[13]Huang YM,Yeh KY,Chen PY,et al.Primary intracranial malignant melanomas in solitary type:a tertiary center experience[J].J Clin Neurosci,2022,101:37-46.
[14]Wong TF,Chen YS,Zhang XH,et al.Longest survival with primary intracranial malignant melanoma:a case report and literature review[J].World J Clin Cases,2022,10(30):11162-11171.
[15]Dar N,Mantziaris G,Pikis S,et al.Stereotactic radiosurgery for intracranial primary melanocytomas[J].World Neurosurg,2022,164:160-166.
[16]Li CB,Song LR,Li D,et al.Primary intracranial malignant melanoma:proposed treatment protocol and overall survival in a single-institution series of 15 cases combined with 100 cases from the literature[J].J Neurosurg,2019,132(3):902-913.
[17]Puyana C,Denyer S,Burch T,et al.Primary malignant melanoma of the brain:a population-based study[J].World Neurosurg,2019,130:e1091-e1097.
[18]Dummer R,Queirolo P,Abajo Guijarro AM,et al.Atezolizumab,vemurafenib,and cobimetinib in patients with melanoma with CNS metastases(TRICOTEL):a multicentre,open-label,single-arm,phase 2 study[J].Lancet Oncol,2022,23(9):1145-1155.
[19]Fujimura T,Muto Y,Asano Y.Immunotherapy for melanoma:the significance of immune checkpoint inhibitors for the treatment of advanced melanoma[J].Int J Mol Sci,2022,23(24):15720.
[20]Tawbi HA,Forsyth PA,Hodi FS,et al.Long-term outcomes of patients with active melanoma brain metastases treated with combination nivolumab plus ipilimumab(CheckMate 204):final results of an open-label,multicentre,phase 2 study[J].Lancet Oncol,2021,22(12):1692-1704.
[21]Tawbi HA,Forsyth PA,Hodi FS,et al.Safety and efficacy of the combination of nivolumab plus ipilimumab in patients with melanoma and asymptomatic or symptomatic brain metastases(CheckMate 204)[J].Neuro Oncology,2021,23(11):1961-1973.
[22]Rulli E,Legramandi L,Salvati L,et al.The impact of targeted therapies and immunotherapy in melanoma brain metastases:a systematic review and meta-analysis[J].Cancer,2019,125(21):3776-3789.
(收稿2022-09-29修回2023-02-03)
