黄皮不同部位多糖的结构特性及体外降血糖活性
2024-05-06何俊叶
何俊叶
刘 成
于宠洋
孙朋朋
任圆圆
(长江大学生命科学学院,湖北 荆州 434025)
黄皮,芸香科黄皮属乔木植物,主要分布在中国南方和东南亚的热带和亚热带地区[1]。黄皮果具有独特的味道和丰富的生物活性物质,深受消费者欢迎[2]。黄皮的每一个部位都具有极高的药用价值:种子可治疝气;果皮可消风肿、去疳积;果肉可健胃消食、顺气镇咳,有润肺生津、清热消暑的功效[3]。Wu等[4]发现黄皮酸性多糖具有抗氧化能力;Song等[5]研究发现黄皮果胶具有益生元功能。
植物多糖是自然界来源最广泛的多糖,无细胞毒性,而且某些多糖已被临床用于疾病治疗和健康改善[6]。据报道[7-10],植物多糖具有很多生物活性,如抗肿瘤、抗细胞凋亡、抗病毒、抗凝血、抗氧化、降血糖、镇痛和抗疲劳等。
糖尿病,是一种以高血糖为特征的代谢紊乱疾病,目前尚缺乏治疗糖尿病的有效方法,临床上还是以降糖药物为主[11]。但是,这些药物通常有一定的副作用,或者对患者的依从性较差,不能完全满足患者的需求。Wu等[12]研究发现刺梨多糖有抑制α-淀粉酶和α-葡萄糖苷酶的能力;赵凯迪等[13]研究表明桔梗多糖对2型糖尿病大鼠有降低血糖作用,但有关黄皮多糖降血糖活性的研究尚未见报道。研究拟从黄皮果肉、果皮和种子3个部位提取多糖,比较其结构特性和抗氧化性,并重点分析其体外降血糖活性,旨在提高黄皮的利用率,为其抗氧化产品和防治糖尿病药物的开发提供依据。
1 材料与方法
1.1 材料
黄皮:市售;
α-淀粉酶(猪胰腺)、α-葡萄糖苷酶、对硝基苯基-α-D-吡喃葡萄糖苷(PNPG)、半乳糖醛酸:上海源叶生物科技有限公司;
甘露糖、阿拉伯糖、半乳糖、葡萄糖醛酸、溴化钾:上海麦克林生化科技股份有限公司;
其他试剂均为国产分析纯。
1.2 设备
集热式恒温加热磁力搅拌器:DF-101S型,上海科升仪器有限公司;
离心机:Allegra 25R型,默瑞(上海)生物科技有限公司;
紫外分光光度计:UV-2600型,岛津企业管理(中国)有限公司;
傅里叶变换红外光谱仪:IR-960型,天津瑞岸科技有限公司;
扫描电镜:TESCAN VEGA3型,泰思肯(中国)有限公司;
高效液相色谱仪:Waters e2695型,美国沃特斯公司;
高效液相色谱仪:LC1200型,安捷伦科技有限公司。
1.3 方法
1.3.1 黄皮不同部位粗多糖提取 取一定量的黄皮果肉、果皮和种子。果肉打浆,加入两倍体积的无水乙醇脱脂;果皮和种子剪碎,50 ℃烘干,粉碎,加无水乙醇(湿重的4倍)搅拌24 h脱脂,10 000 r/min离心15 min,沉淀干燥后粉碎,待用。
取一定量黄皮果肉、果皮和种子干燥粉末,以料液比(m粉末∶V水)1∶40 (g/mL)热水浴(80 ℃)连续提取3次,每次2 h(黄皮种子在第一次热水提取时加入高温淀粉酶除淀粉),10 000 r/min离心15 min,合并上清滤液,旋转蒸发,浓缩至原体积的1/5。准确量取浓缩液,加入4倍体积的无水乙醇,边加边搅拌,4 ℃静置20 h,10 000 r/min离心15 min,沉淀用少量去离子水复溶,用截留相对分子质量100 000的透析袋透析72 h,冷冻干燥得到黄皮果肉、果皮和种子粗多糖,将其分别命名为CWP-F、CWP-P和CWP-S。
1.3.2 化学组成测定
(1) 总糖含量:采用苯酚—硫酸法[14]。
(2) 还原糖含量:采用DNS法[15]。
(3) 蛋白质含量:采用考马斯亮蓝法[16]。
1.3.3 相对分子质量测定 采用高效凝胶渗透色谱法。色谱柱为TSK gel G4000PWXL色谱柱(7.8 mm×300 mm);柱温30 ℃;示差折光检测器(RID)温度35 ℃;流动相为超纯水;流速0.6 mL/min。采用标准葡聚糖(T-10、T-40、T-70、T-110、T-500和T-2000)绘制标准曲线。
1.3.4 单糖组成 分别称取10 mg CWP-F、CWP-P和CWP-S于样品瓶中,加入4 mL三氟乙酸(2 mol/L)溶液溶解,110 ℃油浴4 h,分3次加入甲醇溶液,旋转蒸发以除去三氟乙酸。单糖标准品和样品水解液经PMP柱前衍生法进行分析。色谱柱为Agilent Eclipse XDB-C18色谱柱(4.6 mm×250 mm,5 μm);流动相A为乙腈—0.05 mol/L磷酸缓冲液(KH2PO4—NaOH,pH 6.9)(V乙腈∶V磷酸缓冲液=40∶60),流动相B为乙腈—0.05 mol/L磷酸缓冲液(KH2PO4—NaOH,pH 6.9)(V乙腈∶V磷酸缓冲液=15∶85);梯度洗脱(0~10 min,2%~6% A;10~22 min,6%~12% A;22~26 min,12%~9% A;26~40 min,9%~2% A;40~42 min,2% A);柱温30 ℃;流速1 mL/min;检测波长245 nm;进样体积10 μL。
1.3.5 傅里叶变换红外光谱(FT-IR) 将样品与溴化钾按m样品∶m溴化钾为1∶100混匀,充分研磨后压片,利用傅里叶红外光谱(FTIR)进行扫描,扫描波数范围为4 000~400 cm-1。
1.3.6 扫描电镜(SEM) 取适量样品,用导电胶固定后进行镀金,扫描电子显微镜于20 kV下放大500,2 000倍对样品的表面形态进行观察并拍照。
1.3.7 体外抗氧化性
(1) DPPH自由基清除能力:根据文献[17]并修改。将3 mL乙醇—DPPH(0.1 mmol/L)溶液分别加入到2 mL质量浓度为0,0.2,0.4,0.6,0.8,1.0 mg/mL的多糖样品溶液中,混匀,避光30 min,测定517 nm处吸光值。以VC作为阳性对照,按式(1)计算DPPH自由基清除率。
(1)
式中:
a——DPPH自由基清除率,%;
A1——样品组吸光度;
A2——样品对照组吸光度;
A0——空白组吸光度。
(2) 羟自由基清除能力:参考文献[18]。
(3) 总还原力:根据文献[19]并修改。分别取1 mL质量浓度为0,0.2,0.4,0.6,0.8,1.0 mg/mL的多糖样液,依次加入2 mL PBS(0.2 mol/L,pH 6.6)和0.5 mL 1%铁氰化钾溶液,50 ℃水浴30 min,冷却至室温,加入1 mL 10%三氯乙酸,4 500 r/min离心10 min,取2 mL上清液,加0.1 mL 0.1%三氯化铁和3 mL去离子水,避光反应20 min,测定700 nm处吸光值。
1.3.8 体外降血糖活性
(1)α-淀粉酶抑制率:根据文献[20]。
(2)α-葡萄糖甘酶抑制率:根据文献[21]并修改。分别取30 μL不同浓度的样液于96孔板中,加入30 μLα-葡萄糖苷酶溶液(0.5 U/mL),37 ℃孵育10 min,加入30 μL PNPG溶液(5 mmol/L),37 ℃孵育30 min,加入60 μL Na2CO3溶液(0.2 mmol/L)终止反应,测定405 nm处吸光值,以阿卡波糖为阳性对照。按式(2)计算多糖对α-葡萄糖苷酶的抑制率。
(2)
式中:
b——α-葡萄糖苷酶的抑制率,%;
A1——样品组吸光度;
A2——样品对照组吸光度;
A3——空白组吸光度;
A4——空白对照组吸光度。
(3) 抑制α-淀粉酶和α-葡萄糖苷酶动力学分析:根据文献[22]并修改。固定α-淀粉酶(5 U/mL)活力,测定不同质量浓度CWP-F(0,2,4,6 mg/mL)和CWP-P(0,0.025,0.050,0.100 mg/mL)存在时,对应体系的反应速率随底物质量浓度(1,2,4,8,10 mg/mL)的变化。固定α-葡萄糖苷酶(0.5 U/mL)活力,测定不同质量浓度CWP-F(0,2,4,6 mg/mL)和CWP-P(0,0.005,0.010,0.050 mg/mL)存在时,对应体系的反应速率随底物浓度(1,2,4,8,10 mmol/L)的变化。
Lineweaver-Burk方程:
(3)
混合型抑制:
(4)
(5)
(6)
式中:
v——酶促反应速率,μmol/min;
Vmax——最大酶反应速率,μmol/min;
[S]——淀粉质量浓度或对硝基苯基-α-D-吡喃葡萄糖苷浓度,mg/mL或mmol/L;
c——CWP-F和CWP-P质量浓度,mg/mL;
Km——米氏常数;
Ki——抑制剂与酶结合的平衡常数;
Kis——抑制剂与酶—底物复合物结合的平衡常数;
k——斜率;
b——截距。
1.3.9 数据处理 所有试验均重复3次,利用Origin软件绘图,采用SPSS软件进行差异显著性分析,P<0.05为差异显著。
2 结果与分析
2.1 黄皮不同部位多糖的化学组成
由表1可知,从黄皮不同部位提取的粗多糖的化学组成明显不同(P<0.05),其中果肉部位提取的多糖含量最高,且蛋白质含量最低;果皮部位的多糖含量最低,但还原糖含量最高;种子部位的总糖、蛋白质含量最高。

表1 黄皮不同部位粗多糖的化学组成†
2.2 相对分子质量分布
由图1可知,CWP-F、CWP-P和CWP-S的峰均不对称,说明其存在不同相对分子量的黄皮多糖组分。根据标准曲线lgMw=-0.342 3t+9.421,R2=0.995 6,计算每种多糖第1个峰所对应的相对分子质量分别为5 776 600,5 681 800,1 993 300,其中CWP-S的相对分子质量显著低于CWP-F和CWP-P。
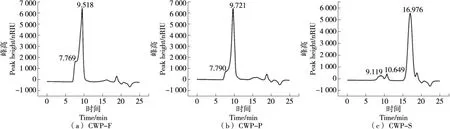
图1 多糖液相色谱图
2.3 单糖组成
由表2可知,CWP-F、CWP-P和CWP-S 3种多糖均含有甘露糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖,但各自比例(摩尔分数)不同。此外,CWP-P还含有鼠李糖,但只占0.06%。CWP-F、CWP-P和CWP-S中占比最大的单糖分别为半乳糖(60.10%)、半乳糖醛酸(35.54%)和葡萄糖(89.77%)。3个样品的单糖组成及摩尔分数有所差异,主要是样品来源部位不同引起的。
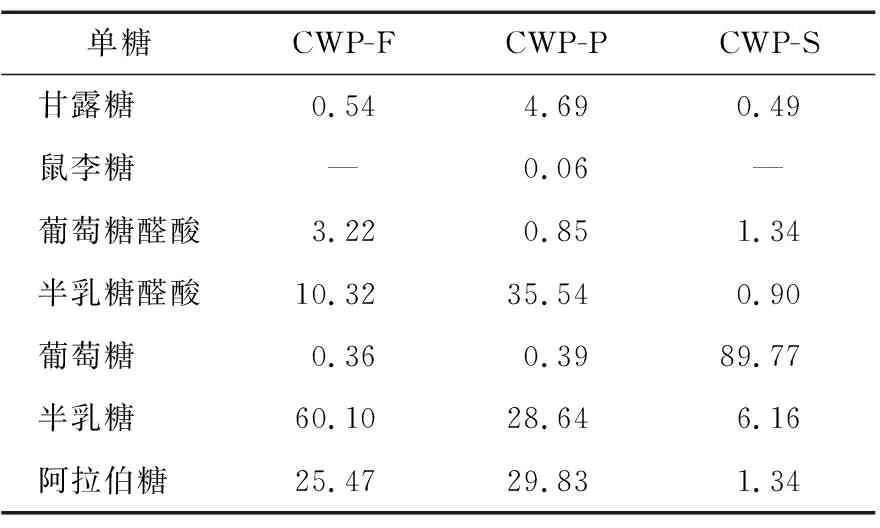
表2 CWP-F、CWP-P和CWP-S的单糖组成
2.4 傅里叶变换红外光谱
由图2可知,3 407 cm-1处吸收峰是由—OH的伸缩振动引起的,2 932 cm-1附近吸收峰是—CH2基团中C—H的不对称伸缩振动引起的[23]。CWP-F和CWP-P在1 751 cm-1附近的吸收峰归属为被酯化的羧基(—COOR),CWP-F、CWP-P和CWP-S在1 641 cm-1附近的吸收峰归属为离子化的羧基(—COO—)[24]。CWP-S在1 549 cm-1处的吸收峰归属为N—H弯曲振动[25]。CWP-F和CWP-P在1 447 cm-1以及CWP-S在1 419 cm-1处的吸收峰是由C—H弯曲振动引起的[20]。CWP-F、CWP-P和CWP-S在1 238 cm-1附近的吸收峰归属于C—O伸缩振动,在1 146,1 027 cm-1处的吸收峰归属于C—O—C拉伸振动[21]。CWP-F和CWP-S在1 081 cm-1以及CWP-P在1 104 cm-1处的吸收峰表示有β-半乳聚糖,在1 027 cm-1处的峰表示有阿拉伯聚糖[26]。CWP-S在935 cm-1处的吸收可能与糖单元之间的β-糖苷键有关[27]。CWP-F、CWP-P和CWP-S在841 cm-1处的峰表明存在α-糖苷键;在765,711 cm-1处的吸收峰表明存在呋喃环[26]。综上,CWP-F、CWP-P和CWP-S是含有羟基、羧基、α-糖苷键和呋喃糖环的阿拉伯半乳聚糖,而CWP-S还具有β-糖苷键构型。

图2 多糖红外光谱图
2.5 扫描电子显微镜
由图3可知,CWP-F呈连续的片状结构,表面光滑且有褶皱;CWP-P由许多带有分支的小片连成,且片与片之间有很大的空隙;CWP-S由许多不规则的片状结构堆成,有空隙。3个样品微观结构差异可能是由于它们的相对分子质量和单糖组成不同,从而影响了分子内氢键与多糖之间的相互作用,形成不同结构[28]。

图3 多糖扫描电子显微镜图
2.6 体外抗氧化性
2.6.1 DPPH自由基清除率 由图4(a)可知,CWP-F、CWP-P和CWP-S均具有清除DPPH自由基的能力,且随质量浓度的增大而增大(P<0.05),在1 mg/mL时达到最大值,分别为73.81%,75.62%和41.26%。此外,3种多糖清除DPPH自由基的能力大小依次为CWP-P>CWP-F>CWP-S。

小写字母不同表示组间差异显著(P<0.05)
2.6.2 羟自由基清除率 由图4(b)可知,3种多糖均具有清除羟自由基的能力,CWP-P的清除力与其质量浓度成正比(P<0.05),在1 mg/mL时达到了45.38%,而CWP-F和CWP-S的清除能力随质量浓度的增加无明显变化。此外,CWP-F、CWP-P和CWP-S的羟自由基清除率均明显低于维生素C的,其清除能力大小为CWP-P>CWP-F>CWP-S。
2.6.3 总还原力 由图4(c)可知,CWP-F和CWP-P具有一定的还原力,且随质量浓度的增加显著增大(P<0.05),在1 mg/mL时达到了最大值,分别为0.30和0.86。而CWP-S的还原力较弱。
综上,CWP-P具有最强的抗氧化力,CWP-F的次之,CWP-S的较弱。多糖具有抗氧化能力,可能是其结构中的氢与附近的自由基结合形成稳定的自由基,从而结束自由基链式反应[29]。此外,Wang等[30]认为半乳糖醛酸的存在会螯合金属离子,随后清除DPPH自由基,而CWP-P单糖组成中含量最多的为半乳糖醛酸,这可能是其清除DPPH自由基能力最强的主要原因。
2.7 体外降血糖
2.7.1α-淀粉酶和α-葡萄糖苷酶抑制率 由图5(a)可知,CWP-F和CWP-P有抑制α-淀粉酶的能力,且其抑制率随质量浓度的增加而增大(P<0.05),其中CWP-P的抑制能力最强,略低于阿卡波糖。CWP-F和CWP-P的IC50值分别为13.803 8,0.040 8 mg/mL。而CWP-S无抑制α-淀粉酶的能力。
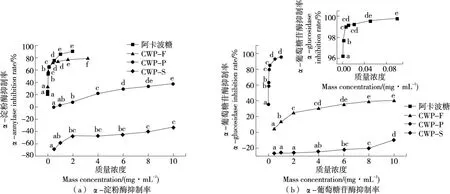
小写字母不同表示组间差异显著(P<0.05)
肠上皮细胞分泌的α-葡萄糖苷酶是将低聚糖水解为单糖的关键酶,α-葡萄糖苷酶抑制剂可以延缓膳食中碳水化合物的摄入,降低餐后高血糖,因此可以用于治疗糖尿病[31]。由图5(b)可知,CWP-F和CWP-P的抑制率与其浓度呈正相关(P<0.05),但明显低于阿卡波糖,其IC50值分别为14.223 300,0.008 649 mg/mL,而CWP-S对α-葡萄糖苷酶无抑制力。
综上,CWP-P抑制α-淀粉酶和α-葡萄糖苷酶的能力均显著大于CWP-F,而CWP-S无降血糖的能力。多糖具有α-淀粉酶和α-葡萄糖苷酶抑制作用,可能与其高醛酸含量、高酯化程度和高相对分子质量有关[32]。CWP-P具有最好的体外降血糖能力可能是其具有高半乳糖醛酸和高相对分子质量。此外,抗糖尿病作用是通过抗氧化活性和保护胰腺组织实现的[33]。Zhang等[34]发现TFE和TTE(翻白草总黄酮提取物和总三萜提取物)通过减弱脂质过氧化而引起抗氧化特性,从而影响脂质特征并负责其抗糖尿病特性。CWP-P的降血糖活性高于CWP-F和CWP-S,可能是因为其抗氧化能力更高。而Chung等[35]认为,多糖具有降血糖作用,其作用机理可能是通过抑制淀粉水解成葡萄糖,延缓葡萄糖的吸收和运输,从而降低血糖含量。
2.7.2α-淀粉酶和α-葡萄糖苷酶抑制动力学 由图5可知,CWP-S对α-淀粉酶、α-葡萄糖苷酶无抑制能力,因此试验只分析CWP-F和CWP-P对α-淀粉酶和α-葡萄糖苷酶的抑制类型。
表3~表6和图6为CWP-F、CWP-P对α-淀粉酶和α-葡萄糖苷酶的抑制类型。由表3和图6(a)可知,随着CWP-F质量浓度的增加,Km和Vmax逐渐减小,各质量浓度的酶促反应速率拟合直线互相平行,说明CWP-F对α-淀粉酶为反竞争性抑制作用,即CWP-F不能与游离的α-淀粉酶结合,只能在酶和底物结合成复合物后再与酶结合而抑制酶活性[36]。
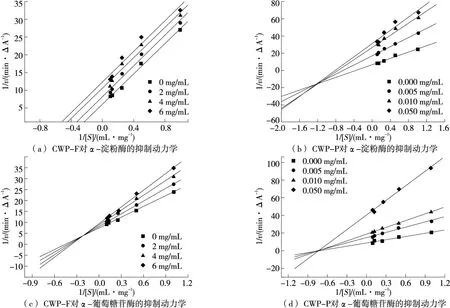
图6 CWP-F和CWP-P的抑制动力学
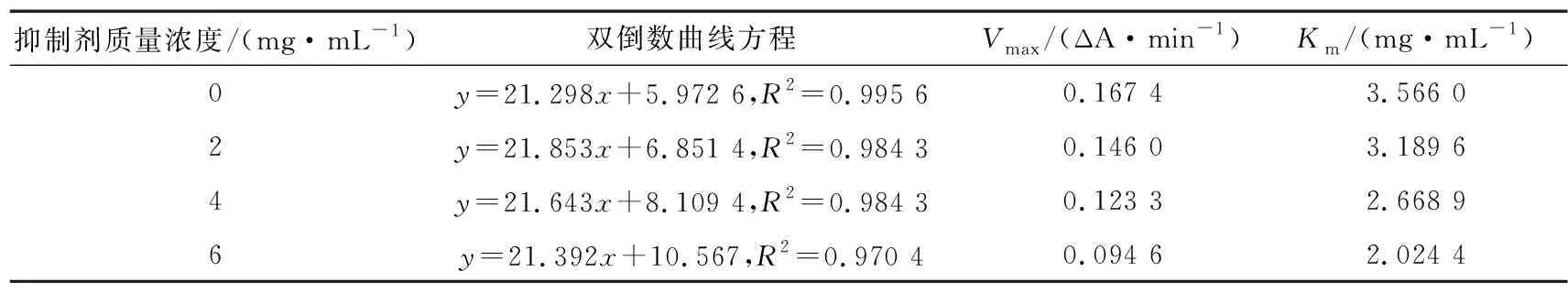
表3 CWP-F抑制α-淀粉酶的Vmax和Km值
由表4和图6(b)可知,随着CWP-P质量浓度的增加,Km和Vmax同时减小,各质量浓度的酶促反应速率拟合直线相交于第3象限,说明CWP-P对α-淀粉酶为非竞争性和反竞争性的混合型抑制[22]。其中,Ki值为0.107 9,Kis值为0.041 0,说明CWP-P更倾向于与α-淀粉酶—底物复合物结合。
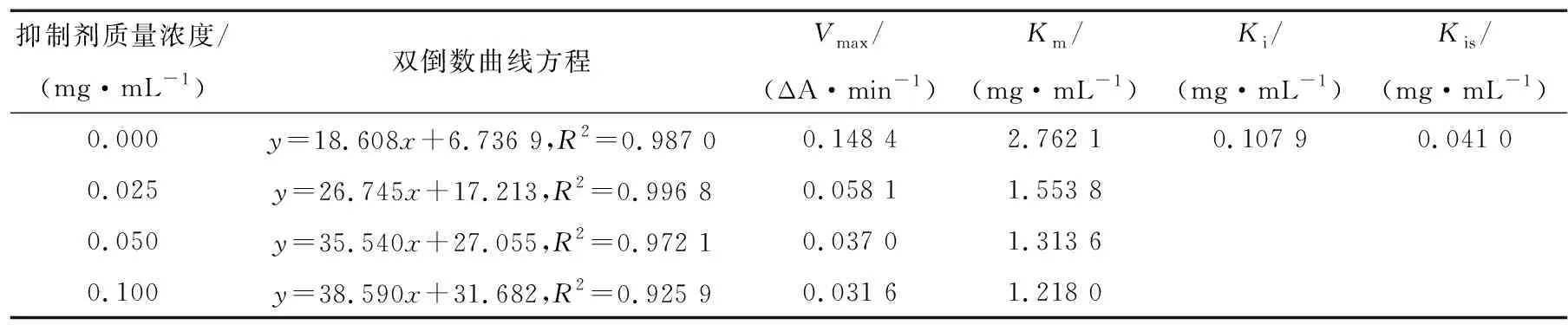
表4 CWP-P抑制α-淀粉酶的Vmax和Km值
由表5和图6(c)可知,随着CWP-F质量浓度的增加,Km逐渐增大,Vmax逐渐减小,各质量浓度的酶促反应速率拟合直线相交于第2象限,说明CWP-F对α-葡萄糖苷酶为竞争性和非竞争性的混合型抑制。其中,Ki值为10.901 6,Kis值为21.524 8,说明CWP-F更倾向于与游离的α-葡萄糖苷酶结合。
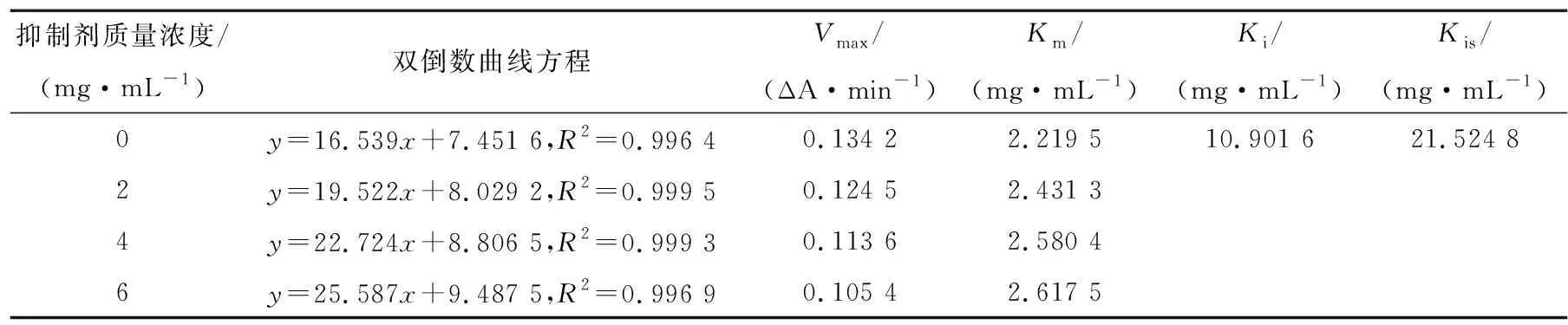
表5 CWP-F抑制α-葡萄糖苷酶的Vmax和Km值
由表6和图6(d)可知,随着CWP-P质量浓度的增加,Km不变,Vmax逐渐减小,各质量浓度的酶促反应速率拟合直线相交于x轴,说明CWP-P对α-葡萄糖苷酶为非竞争性抑制作用[37]。
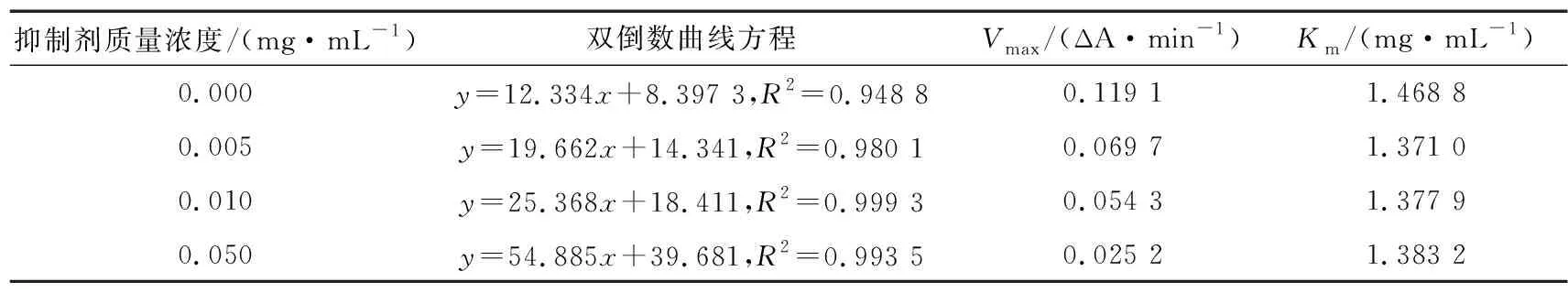
表6 CWP-P抑制α-葡萄糖苷酶的Vmax和Km值
3 结论
从黄皮不同部位提取的果肉多糖(CWP-F)、果皮多糖(CWP-P)和种子多糖(CWP-S)的理化指标、结构和活性存在显著差异(P<0.05),其中,CWP-F多糖含量最高,相对分子量最大,单糖组成主要为半乳糖,体外抗氧化和降血糖能力居中;CWP-P多糖含量最低,单糖组成主要为半乳糖醛酸,体外抗氧化和降血糖能力最强;CWP-S多糖相对分子质量最小,单糖组成主要为葡萄糖,体外抗氧化能力最弱,无降血糖能力;CWP-F和CWP-P对α-淀粉酶和α-葡萄糖苷酶的抑制类型不同,表明多糖的结构特征会影响其体外抗氧化和体外降血糖活性,但还需深入探究。此外,CWP-P具有良好的抗氧化和降血糖活性。因此,CWP-P可以作为一种新的抗氧化剂和潜在辅助治疗2型糖尿病的功能性食品。
