补肾降浊方在糖尿病肾病中的作用及其机制研究*
2024-05-06李萍胡剑卓周珂
李萍,胡剑卓,周珂
(湖南中医药大学第二附属医院 肾病内分泌科,湖南 长沙 410005)
糖尿病肾病(diabetic nephropathy, DN)是糖尿病常见的微血管并发症,也是终末期肾病的主要原因[1]。糖尿病的典型病理特征是肾小球基底膜增厚、系膜扩张和基质积聚,最终进展为肾小球和肾小管纤维化[2-3]。其发病机制非常复杂,涉及晚期糖基化终产物、炎症、氧化应激、细胞凋亡、自噬和导致细胞外基质沉积和肾间质纤维化的各种信号传导[4],最后导致蛋白尿和肾小球滤过率的逐渐降低[5]。尽管DN研究取得了进展,但在开发可靠的早期诊断标志物或针对这种疾病的有效治疗方法方面尚未取得突破[6-7]。目前,DN的主要西医治疗方法是通过胰岛素和肾素-血管紧张素系统抑制剂调节血糖和血压[8]。然而,这些方法只能延缓DN的进展,并不能预防或治愈。最近,中药配方因治疗DN疗效突出、副作用小、经济实惠等特点越来越受到关注[9]。因此,探寻治疗DN的中药配方,探究其分子机制对于DN的预防和治疗具有重要的意义。
中医典籍记载糖尿病多责之于肾,病机多为消渴日久,肾气虚损,精气不固而泄于下。气虚则帅血无力,阴虚则脉道失于润泽,阳虚则血脉失于温煦[10]。因此,DN的治疗应以补肾气固肾精为主,佐以活血通络。补肾降浊方具有益气滋阴固肾,活血通络降浊之功效,对DN有很好的疗效。有研究证实补肾降浊方多种主要成分在肾功能损伤中具有保护作用[11]。既往研究表明,补肾降浊方中的六味地黄丸能够显著改善肾阴亏虚型糖尿病患者肾功能障碍[12]。临床上使用补肾降浊方治疗DN患者对改善其肾功能不全具有良好的疗效,并对患者的肾脏、脾胃具有积极的保护作用[13]。然而,对于补肾降浊方的具体作用机制尚不清晰,需深入探究。
NAD+依赖性脱乙酰酶沉默信息调节因子1(silence information regulator 1, SIRT1)作为Sirtuin家族的成员之一,在多种疾病中都具有保护作用[14]。在正常肾脏中可检测到SIRT1蛋白表达,但在糖尿病肾脏中其表达水平降低[15]。研究发现补肾降浊方主要的成分在多种疾病中都可以参与SIRT1的表达调控。熟地黄主要活性物质梓醇可以通过诱导SIRT1表达对阿霉素诱导的肾脏疾病发挥很强的保护作用[16]。然而,补肾降浊方是否通过调节SIRT1的表达,而改善DN肾组织损伤,尚未见报道。
1 材料与方法
1.1 实验材料
18只SPF级雄性SD大鼠购自北京维通利华有限公司,实验动物生产许可证号:SCXK(京)2021-0006,实验动物使用许可证号:SYXK(京)2022-0052;血尿素氮检测试剂盒(货号:BC1535)、血肌酐检测试剂盒(货号:BC4915)、HE染色试剂盒(货号:G1120)和Masson染色试剂盒(货号:G1340)均购自北京索莱宝科技有限公司,Prime Script™ RT试剂盒(货号:RR047A)和SYBR®Premix Ex Tap™ Ⅱ试剂盒(货号:DRR820A)均购自日本TaKaRa公司,RIPA裂解液(货号:P0013B)购自上海碧云天生物技术有限公司,SIRT1(货号:#8469)、p-p38(货号:#8690)、p38(货号:#4511)、p-NF-κB p65(货号:#3033)和NF-κB p65(货号:#8242)均购自美国Cell Signaling Technology公司,GAPDH(货号:ab181602)、山羊抗兔二抗(货号:ab205718)和ECL Western Blotting底物试剂盒(货号:ab65623)均购自英国Abcam公司。
1.2 实验仪器
大鼠代谢笼尿液收集冷却装置(DXL-DJMC型,北京德耳斯仪器有限公司),酶标仪(ELx808型,美国Biotek公司),高速冷冻型微量台式离心机(D1524R型,北京大龙兴创实验仪器股份公司),紫外分光光度仪(NP80型,德国Implen公司),ABI7500实时荧光定量PCR仪(4377354型,美国Thermo Fisher Scientific公司),蛋白垂直电泳仪(1658033型,美国Bio-rad公司),明美生物显微镜(ML31-M型,济南爱来宝仪器设备有限公司)。
1.3 复制模型
大鼠体重(220±10)g,在(23±1)℃、12 h光照/黑暗循环中自由饮水和标准食物饲养。1周后,随机选取6只大鼠作为Control组,正常喂食。余12只大鼠食用高脂饲料(包括基础饲料71.5%、猪油10%、蛋黄10%、葡萄糖5%、奶粉2.5%、胆固醇1%)4周,参照参考文献[17]并根据实验实际情况调整复制DN大鼠模型。大鼠禁食12 h后将新鲜制备的65 mg/kg链脲佐菌素(Streptozotocin, STZ)加入柠檬酸钠缓冲液(pH 4.5),进行腹腔内一次性注射以诱导DN模型。STZ注射72 h后,连续3 d血糖水平>16.7 mmol/L大鼠被认定患有糖尿病。随后连续饲喂脂肪饮食3周,实验结束前1天用代谢笼收集24 h尿,大鼠尿白蛋白≥ 30 mg/24 h表明DN模型复制成功。随机分为DN组、DN + 补肾降浊方组[含生药11.04 g/(kg·d),相当于成人剂量的6.3倍],每组6只。
1.4 补肾降浊方制作
补肾降浊方:熟地黄24 g,黄芪、丹参各30 g,山茱萸、山药各12 g,党参、桑寄生、当归、菟丝子各20 g,茯苓、牡丹皮、泽泻各9 g,芡实、金樱子、淫羊蕾、大黄各10 g,生药共255 g。以上药物于湖南中医药大学第二附属医院中药房购买并熬制成煎剂,使用0.5%羧甲基纤维素钠溶液配制成混悬液,储存于4℃冰箱中备用。DN + 补肾降浊方组按1 mL/100 g容积给药,1次/d,共12周。
1.5 血清和尿液生化检测
给药干预12周后,使用代谢笼收集各组大鼠24 h尿液,记录尿量后留取5 mL尿液标本,以3 000 r/min离心20 min,置于-80 ℃冰箱冷冻保存,使用生化分析仪测定尿中的尿蛋白水平。而后采用10%水合氯醛0.35 mL/100 g麻醉处死大鼠,收集大鼠腹主动脉血液后静置1 h,离心取血清并置于-80 ℃冰箱冷冻保存。血尿素氮和血肌酐用检测试剂盒进行测定。对处死大鼠迅速摘取右肾,置于-80 ℃冰箱冷冻保存备用。
1.6 肾组织的病理分析
将大鼠右肾进行脱水处理,然后放入58 ℃石蜡包浸机中,浸蜡,凝固后制成4 cm × 2 cm的石蜡块。将石蜡包埋块置于切片机切片,每个肾标本切3片,厚度3 μm。对切片进行HE染色、Masson染色。在400倍显微镜下采用盲法观察每个染色切片,评估组织病理学损伤。
1.7 实时荧光定量聚合酶链反应检测SIRT1 mRNA表达
使用TRIzol试剂从肾组织中提取总RNA。使用逆转录试剂盒将总RNA逆转录为cDNA。将浓度和纯度符合要求的RNA样品,稀释到合适的浓度,利用Prime Script ™ RT试剂盒进行逆转录。采用ABI7500实时荧光定量PCR仪,使用SYBR®Premix Ex TapTMⅡ试剂盒,运用Applied Biosystems 7500HT系统进行PCR。SIRT1正向引物:5'-AGTTGATCAAG GTAGTGCTGGTA-3',反向引物:5'-TGCCACCTAGAA CATGGCTC-3',分别为23和20 bp;GAPDH正向引物:5'-ACCCCTCCTGGGTTTGTAGT-3',反向引物:5'-CATCCAAGCATTCAACCGGC-3',均为20 bp。扩增步骤:95℃预变性30 s、1个循环,59℃退火20 s,72℃延伸20 s,共45个循环。并通过2-ΔΔCt法分析数据,每个样品重复3次,计算均值。
1.8 Western blotting检测蛋白表达
使用RIPA裂解缓冲液在冰上提取蛋白质,使用增强的BCA蛋白浓度测定试剂盒来确定每种裂解物中的总蛋白浓度。将等量的蛋白质上样到10% SDS-聚丙烯酰胺凝胶上,通过电泳分离并转移到PVDF膜上。将膜在室温下于5%脱脂牛奶中封闭2 h,并在4 ℃下与一抗SIRT1(1∶1 000)、p-p38(1∶1 000)、p38(1∶2 000)、p-NF-κB p65(1∶1 000)和NF-κB p65(1∶2 000)孵育过夜,以GAPDH(1∶10 000)作为对照。随后,将膜用山羊抗兔辣根过氧化物酶偶联的二抗(1∶2 000)进行探测。使用ECL Western blotting底物试剂盒检查蛋白条带,显影,分析。
1.9 统计学方法
数据分析采用SPSS 23.0统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血尿素氮、血肌酐、尿白蛋白水平比较
各组大鼠血尿素氮、血肌酐、尿白蛋白水平比较,差异均有统计学意义(P<0.05),DN组较Control组升高(P<0.05),补肾降浊方组较DN组降低(P<0.05)。表明补肾降浊方治疗可显著缓解DN大鼠肾功能损伤程度。见表1。
表1 各组大鼠血尿素氮、血肌酐、尿白蛋白水平比较(n=6,±s)
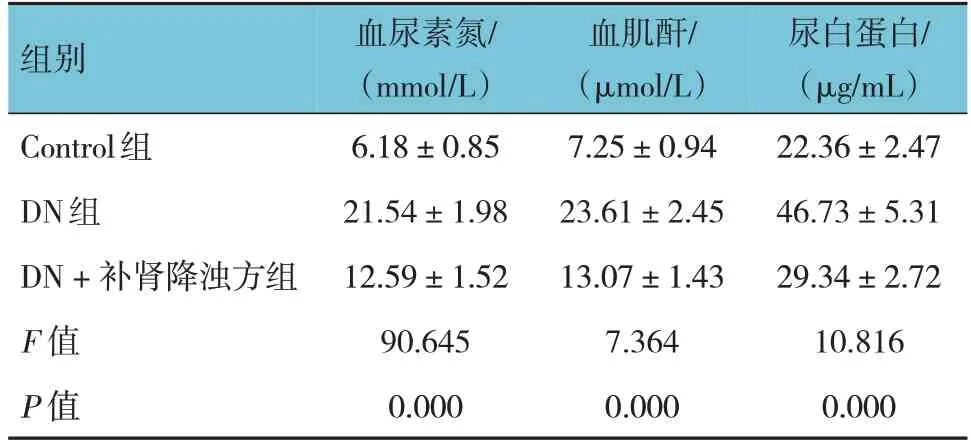
表1 各组大鼠血尿素氮、血肌酐、尿白蛋白水平比较(n=6,±s)
组别Control组DN组DN + 补肾降浊方组F 值P 值血尿素氮/(mmol/L)6.18±0.85 21.54±1.98 12.59±1.52 90.645 0.000血肌酐/(μmol/L)7.25±0.94 23.61±2.45 13.07±1.43 7.364 0.000尿白蛋白/(μg/mL)22.36±2.47 46.73±5.31 29.34±2.72 10.816 0.000
2.2 各组大鼠肾组织SIRT1 mRNA相对表达量比较
Control组、DN组、DN+补肾降浊方组肾组织中SIRT1 mRNA相对表达量分别为(1.00±0.08)、(0.38±0.05)、(0.89±0.07),经方差分析,差异有统计学意义(F=82.255,P=0.000),DN组较Control组降低(P<0.05),DN + 补肾降浊方组较DN组升高(P<0.05)。说明补肾降浊方可促进DN大鼠肾组织SIRT1的表达。
2.3 补肾降浊方对DN大鼠肾组织病理损伤的影响
Control组肾小球和肾小管形态完整,而DN组肾小管基底膜增厚,肾小球肥大,表明DN组大鼠肾功能受到严重损害。与DN组相比,DN + 补肾降浊方组大鼠肾小管基底膜增厚和肾小球肥大情况明显减少。表明经补肾降浊方治疗后,DN大鼠肾组织病理损伤得到明显缓解。见图1。
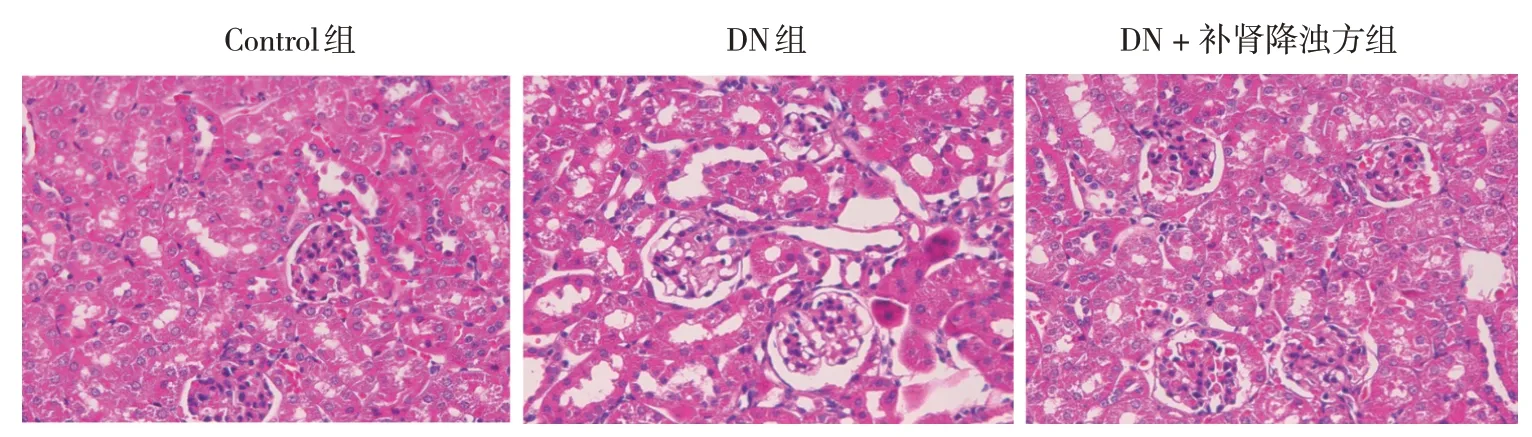
图1 各组大鼠肾组织病理损伤评估 (HE染色×400)
2.4 补肾降浊方对糖尿病大鼠肾组织纤维化的影响
与Control组比较,DN组肾小球和肾小管腔中胶原蛋白的沉积量明显增加。与DN组比较,DN +补肾降浊方组大鼠肾小球和肾小管腔中胶原蛋白的沉积量明显减少。表明补肾降浊方治疗后,DN大鼠肾组织纤维化得到明显缓解。见图2。
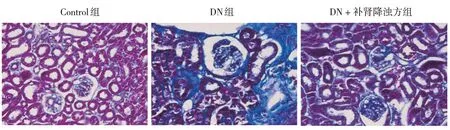
图2 各组大鼠肾组织纤维化情况评估 (Masson染色×400)
2.5 各组大鼠肾组织SIRT1蛋白、p-p38/p38和p-NF-κB p65/NF-κB p65比较
各组大鼠肾组织SIRT1蛋白、p-p38/p38和p-NF-κB p65/NF-κB p65比较,差异均有统计学意义(P<0.05)。DN组SIRT1蛋白较Control组降低(P<0.05),p-p38/p38、p-NF-κB p65/NF-κB p65较Control组升高(P<0.05);DN +补肾降浊方组SIRT1蛋白较DN组升高(P<0.05),p-p38/p38、p-NF-κB p65/NFκB p65较DN组降低(P<0.05)。说明补肾降浊方对DN大鼠肾组织的保护作用可能与其抑制MAPK/NF-κB信号通路有关。见表2和图3。
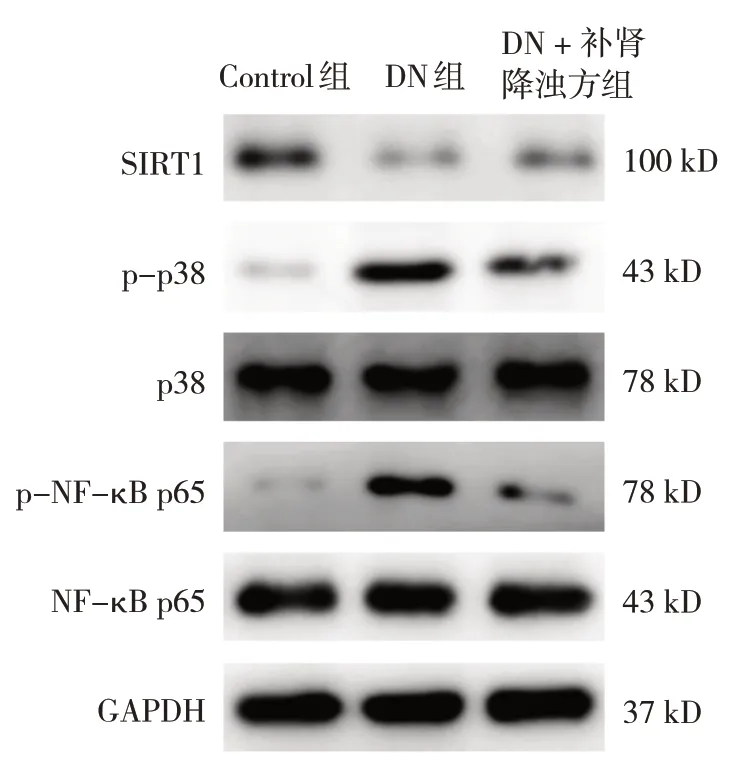
图3 各组大鼠肾组织SIRT1和MAPK/NF-κB信号通路相关蛋白条带图
表2 各组大鼠肾组织中SIRT1蛋白、p-p38/p38和p-NF-κB p65/ NF-κB p65比较 (n=6,±s)
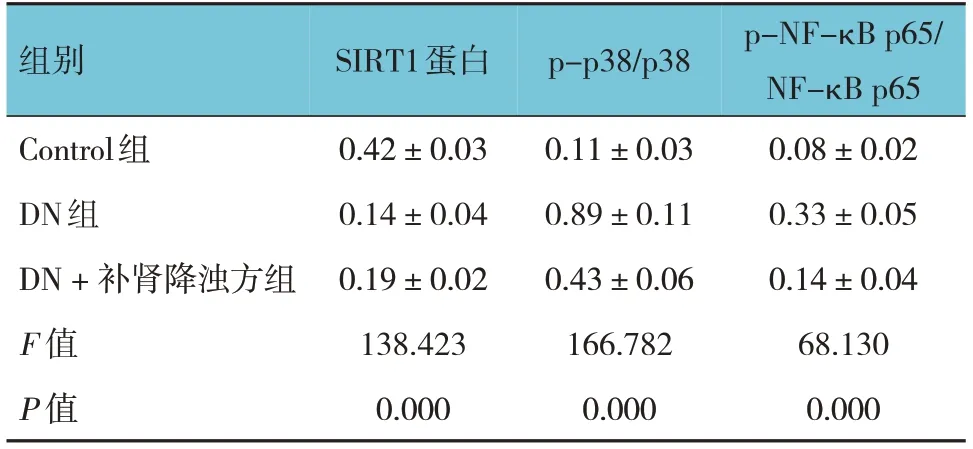
表2 各组大鼠肾组织中SIRT1蛋白、p-p38/p38和p-NF-κB p65/ NF-κB p65比较 (n=6,±s)
组别Control组DN组DN + 补肾降浊方组F 值P 值SIRT1蛋白0.42±0.03 0.14±0.04 0.19±0.02 138.423 0.000 p-p38/p38 0.11±0.03 0.89±0.11 0.43±0.06 166.782 0.000 p-NF-κB p65/NF-κB p65 0.08±0.02 0.33±0.05 0.14±0.04 68.130 0.000
3 讨论
DN主要由肾脏结构和功能的改变所致[18]。其中20%~40%糖尿病患者会进展为DN[19]。随着顽固的病理进展,DN往往会发展为慢性肾病,甚至肾衰竭尿毒症,不仅给患者增加痛苦,而且也加重公共卫生负担[20]。本研究结果发现,在DN大鼠模型中,肾组织SIRT1表达显著降低,肾小管基底膜增厚,肾小球肥大,肾小球和肾小管腔中胶原蛋白的沉积量明显增加。补肾降浊方可促进SIRT1表达,抑制MAPK/NF-κB信号通路,胶原蛋白的沉积量明显减少,肾组织病理损伤得到明显改善。从机制上讲,补肾降浊方能促进SIRT1的表达,抑制MAPK/NF-κB信号通路,改善DN肾组织损伤。表明补肾降浊方对治疗DN具有良好效果。
DN在中医典籍记载中没有具体的病名,但从其症状表现来看是继发于中医之消渴病,同时也属于水肿、关格、肾劳及肾消等范畴[21]。本院经方补肾降浊方以六味地黄丸为底方加味,主要由黄芪、山药、党参、熟地黄、当归、茯苓、泽泻、丹参、牡丹皮、大黄、淫羊藿、芡实、金樱子等中药材组成。有报道显示黄芪-当归复合物可显著降低糖尿病大鼠空腹血糖水平,提高胰岛素水平,改善肾功能,降低尿蛋白,抑制DN的进展[22]。生物信息学分析发现DN和丹参具有共同作用靶点,并且主要涉及晚期糖基化终产物、氧化应激、炎症反应和免疫调节[23]。赵锦等[24]证实淫羊藿苷可减少细胞外基质的增生并抑制肾组织细胞凋亡,减轻DN大鼠肾组织损伤。本研究结果表明,补肾降浊方可以抑制肾小管基底膜增厚和肾小球肥大,减少肾小球和肾小管腔中胶原蛋白的沉积,明显改善肾组织病理损伤。
越来越多的研究表明,SIRT1在DN中发挥重要作用。HONG等[25]研究发现在人类糖尿病肾脏的足细胞和肾小球细胞中SIRT1蛋白表达降低,并且使用EX527(SIRT1抑制剂)诱导了SIRT1的整体降低,加速了链脲佐菌素诱导的糖尿病小鼠肾病的进展。研究发现补肾降浊方中的主要成分可以调控SIRT1的表达。在缺血性脑损伤中,黄芪可以通过上调SIRT1的表达抑制促炎细胞因子的水平[26]。然而,SIRT1治疗DN的下游调控通路未知。有文献报道,SIRT1表达能够抑制p65 NF-κB的磷酸化来预防DN[27]。并且通过下调p38 MAPK和NF-κB p65的表达能够抑制炎症反应,延缓肾损伤,保护糖尿病大鼠的肾脏[28]。本研究结果证实,补肾降浊方可以促进SIRT1的表达,抑制MAPK/NF-κB信号通路的激活。
综上所述,本研究结果表明补肾降浊方促进SIRT1的表达,抑制MAPK/NF-κB信号通路,改善DN肾组织损伤。提示补肾降浊方对治疗DN具有良好效果。并为治疗DN提供新的研究思路。
