针刺对乳腺癌化疗后癌因性疲乏模型小鼠肠-脑轴相关因子的影响*
2024-05-06刘瑞东王泽鹏冯晓东程旭锋房璐阮晓迪聂晨晨苏凯奇吕转
刘瑞东,王泽鹏,冯晓东,程旭锋,房璐,阮晓迪,聂晨晨,苏凯奇,吕转
(河南中医药大学第一附属医院 1.乳腺外科,2.康复科,河南 郑州 450000)
乳腺癌作为目前全球发病率第一的恶性肿瘤,其疾病本身及在治疗过程中引发的疲乏、抑郁、失眠等不良反应较为常见[1-2],而60%乳腺癌幸存者存在不同程度的癌因性疲乏(cancer-related fatigue,CRF)症状[3]。CRF是一种由癌症或癌症治疗引起的,扰乱机体正常功能的、持续存在的主观感觉,并严重影响患者的机体功能康复和生活质量。其中接受化疗后的患者CRF发生率为70%~100%,而且患者疲乏程度较未化疗者明显加重[4]。研究表明,肿瘤化疗可激活促炎细胞因子网络,炎症因子可通过各种途径破坏肠道屏障,引起肠道炎症以及外周血炎症反应,进而导致中枢炎症反应及下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal, HPA)轴功能失调,从而引起CRF[5]。大量研究证实,肿瘤化疗可能会损伤肠道上皮组织,使更多肠道内容物暴露于隐窝中,导致肠道屏障功能的破坏以及肠道的炎症反应,使肠道中白细胞介素-1β(Interlenkin-1β, IL-1β)、IL-6和肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)等促炎因子表达水平升高。此外,有研究表明,肿瘤化疗可破坏血脑屏障功能,导致IL-1β、IL-6、TNF-α等中枢性促炎因子增加,进而引起皮质醇(Cortisol, CORT)、促肾上腺皮质激素释放激素(corticotropin-releasing hormone, CRH)、促肾上腺皮质激素(adrenocorticotropic hormone, ACTH)等HPA轴相关因子表达紊乱,加重疲乏症状[6]。
针刺是将针灸针插入人体特定穴位的一种非药物治疗方法,也是一种广泛应用于临床实践的辅助和替代治疗方法。相关研究证实,针刺可通过调节肠道炎症、中枢炎症及生理屏障功能来调节肠道菌群的紊乱,恢复体内稳态,在改善肿瘤治疗引起的不良反应中发挥重要作用[7]。笔者前期研究发现,通过复制乳腺癌化疗后疲乏模型小鼠针刺足三里、三阴交、百会、关元、气海穴位可通过调节肠道菌群结构丰度,增加肠道有益菌、抑制致病菌、提高机体免疫力,改善乳腺癌化疗引起的疲乏症状[8]。另有文献报道针刺可改善乳腺癌CRF患者的疲乏症状,提高患者生活质量[9]。据此提出针刺可能通过肠-脑轴改善乳腺癌CRF的假说。本研究通过复制乳腺癌化疗后CRF小鼠模型,观察针刺足三里、三阴交、百会、关元、气海穴对CRF小鼠下丘脑和结肠的炎症因子及HPA轴相关激素因子的影响,从而阐明针刺治疗CRF的可能机制。
1 材料与方法
1.1 实验动物
雌性SPF级BALB/c小鼠[实验动物生产许可证号:SCXK(京)2016-0006,实验动物使用许可证号:SYXK(豫)2020-0004]60只,6~8周龄,体重15~18 g,由北京市维通利华实验动物技术有限公司提供,饲养于河南中医药大学第一附属医院SPF级动物实验室。小鼠在室温20~25 ℃,相对湿度40%~70%,12 h / 12 h昼夜明暗交替,自由进食、饮水,适应性喂养1周。本研究经医院医学伦理委员会审批通过(No:YFYDW2021012)。
1.2 细胞
4T1-Luciferase小鼠乳腺癌细胞来源于美国国立癌症研究所,由中国中医科学院广安门医院肿瘤研究室提供。细胞常规培养于RPMI-1640培养液中,在37 ℃、5%二氧化碳条件下常规培养,2~3天传代1次,实验取对数生长期细胞。
1.3 药物、试剂与仪器
注射用环磷酰胺(CTX)0.2 g(德国ASTA Medica AG公司),RPMI-1640培养基(北京索莱宝科技有限公司),特级胎牛血清(以色列BI公司),PAGE凝胶快速制备试剂盒(上海雅酶生物科技有限公司),BCA蛋白测定试剂盒(北京索莱宝科技有限公司),ECL超敏发光液(上海雅酶生物科技有限公司),IL-1β、IL-6、TNF-α、β-actin一抗、二抗(武汉三鹰科技有限公司),20×TBST缓冲液(北京索莱宝科技有限公司),ACTH、CORT ELISA试剂盒(武汉伊莱瑞特科技有限公司),一次性华佗牌无菌针灸针(苏州医疗用品厂有限公司,规格0.2 mm×13 mm),Western blotting显影仪、蛋白垂直电泳槽(美国Bio-Rad公司)。
1.4 分组和模型复制
首先将60只雌性小鼠采用随机数字表法分为空白组10只,模型复制组50只。随后进行荷瘤加化疗模型制备:将4T1-Luciferase小鼠乳腺癌细胞浓度调整为2×106个/mL,分别在模型复制组小鼠的第4乳垫区皮下接种0.1 mL细胞,接种7~10 d,当肿瘤体积约0.5 cm×0.5 cm×0.5 cm时,给予模型复制组腹腔注射CTX 100 mg/(kg·d),连续3 d,以模型复制组小鼠体重下降、食欲减退、毛发稀疏、精神萎靡、行动迟缓、活动度减低、便溏等一般情况以及强迫游泳不动时间延长、旷场内的水平运动得分和垂直运动得分降低为模型复制成功标准。
1.5 干预方法
模型复制成功后于次日开始干预,共14 d。针刺组小鼠参考《实验动物常用穴位名称与定位第2部分:大鼠》[10],选取位于小鼠膝关节下方,腓骨头下0.3 cm处的肌沟中的“足三里”,后肢内踝尖上0.5 cm处的“三阴交”,脐后方1 cm处的“关元”,脐后方0.5 cm处的“气海”和顶骨正中的“百会”。在穴位处消毒后,足三里直刺3 mm,三阴交直刺1.5 mm,关元斜刺1.5 mm,气海斜刺1.5 mm,百会平刺1 mm,留针30 min,6 min行针1次,1次/d,6 d/周,共14 d;假针刺组每日陪同抓取,固定,不治疗。
1.6 小鼠一般情况、体力和疲劳情况评估
分别于模型复制后次日和干预14 d后观察各组小鼠的体重、精神状态、活动度、饮食、毛发及大便性状等。分别于模型复制后次日和干预14 d后采用强迫游泳实验和旷场实验检测小鼠疲乏状况。强迫游泳实验即在光线较暗的环境中将小鼠放入直径10 cm,高度25 cm的圆柱形透明水桶中,保持桶中的水深10~15 cm,水温在23~25 ℃,用摄像系统记录6 min小鼠游泳时间,统计后4 min小鼠的不动时间,以此评估小鼠的体力和疲劳情况;旷场实验是在光线较暗的环境中将小鼠放置在敞箱底面的中心方格内,箱上方安置摄像系统,记录分析小鼠在箱内3 min的水平运动得分(小鼠穿越底面块数,穿越1块计1分)和垂直运动得分(小鼠后腿直立次数,每次计1分),以此评估小鼠在陌生环境中的自发运动能力。
1.7 酶联免疫吸附试验检测小鼠血清ACTH、CORT的含量
小鼠治疗后,眼眶取血,于4 ℃、3 000 r/min离心15 min,提取上清液,置于-80 ℃冰箱保存待测。根据酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)试剂盒操作说明测定血清ACTH、CORT的含量。
1.8 Western blotting检测下丘脑和结肠中炎症因子的表达
小鼠干预14 d后,处死,开颅取脑,分离下丘脑组织,同时剖腹取结肠组织,放置在冻存管中,置入-80 ℃备用。取下丘脑和结肠组织称重后匀浆机匀浆,然后加入RIPA裂解液获取总蛋白,按照BCA蛋白定量试剂盒说明书测定蛋白含量;根据蛋白浓度上样,12.5% PAGE-SDS电泳80 V 30 min、120 V 60 min,转膜250 mA 30 min、脱脂奶粉封闭1 h,IL-1β、IL-6、TNF-α一抗孵育过夜后弃掉一抗,洗涤液洗板后,加入二抗室温孵育1 h。用ECL发光液和显影定影试剂发光显色,Image J软件系统分析灰度值,以目的蛋白与内参蛋白条带灰度值的比值作为目的蛋白相对表达量。
1.9 统计学方法
数据分析采用SPSS 22.0统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或方差分析,两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌化疗后CRF模型评价
本实验共使用50只小鼠复制乳腺癌化疗后CRF模型,其中5只小鼠模型复制过程中死亡;根据强迫游泳和旷场行为学实验进行模型复制后的行为学观察,剔除不疲乏小鼠6只,将剩余的39只模型复制小鼠随机分为模型组、针刺组、假针刺组,每组13只。在干预过程中,各组均死亡3只、部分数据不合格剔除2只,最终3组均剩余8只完成整个实验。
2.2 各组小鼠体重及一般情况观察
与空白组小鼠比较,模型组小鼠毛发稀疏、精神萎靡、摄食饮水减少、行动迟缓、大便稀黏等表现。在针刺干预2周后,与模型组比较,针刺组小鼠精神状态、摄食饮水、活动度、毛发情况恢复较好,接近空白组小鼠状态;而假针刺组与其比较无明显变化。
2.3 各组小鼠行为学比较
各组小鼠模型复制前强迫游泳不动时间比较,差异无统计学意义(P>0.05)。各组小鼠模型复制后强迫游泳不动时间比较,差异有统计学意义(P<0.05),模型组长于空白组。各组小鼠干预前和干预后强迫游泳不动时间比较,差异均有统计学意义(P<0.05),模型组干预后长于针刺组(P<0.05),假手术组干预后长于针刺组(P<0.05)。见表1。
表1 各组小鼠不同时间点强迫游泳不动时间比较(n=8,±s)
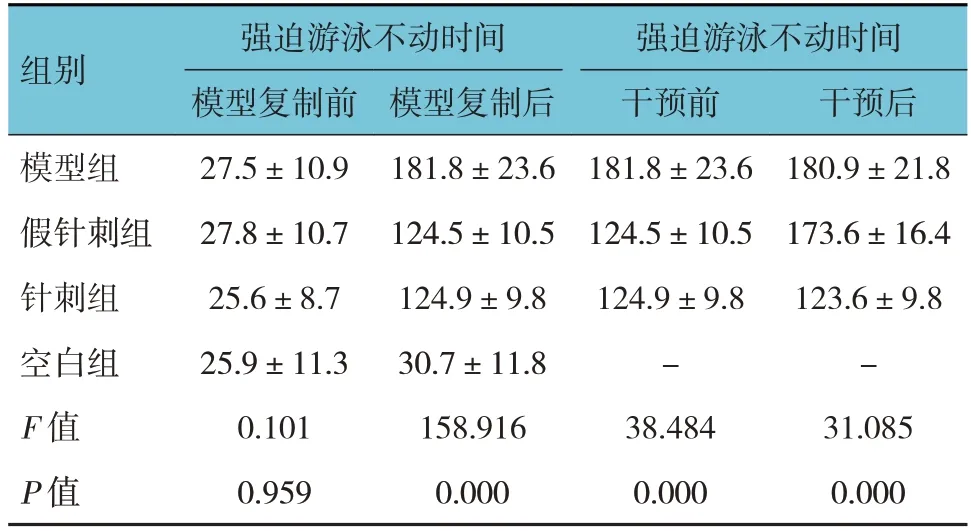
表1 各组小鼠不同时间点强迫游泳不动时间比较(n=8,±s)
组别模型复制后181.8±23.6 124.5±10.5 124.9±9.8 30.7±11.8 158.916 0.000强迫游泳不动时间模型复制前27.5±10.9 27.8±10.7 25.6±8.7 25.9±11.3 0.101 0.959模型组假针刺组针刺组空白组F 值P 值强迫游泳不动时间干预前181.8±23.6 124.5±10.5 124.9±9.8-38.484 0.000干预后180.9±21.8 173.6±16.4 123.6±9.8-31.085 0.000
模型组与空白组小鼠模型复制前水平运动得分、垂直运动得分比较,差异无统计学意义(P>0.05)。模型组与空白组小鼠模型复制后水平运动得分、垂直运动得分比较,差异有统计学意义(P<0.05),模型组低于空白组(P<0.05)。见表2。
表2 模型组与空白组小鼠模型复制前后水平运动得分、垂直运动得分比较 (n=8,±s)

表2 模型组与空白组小鼠模型复制前后水平运动得分、垂直运动得分比较 (n=8,±s)
组别模型组空白组F 值P 值水平运动得分模型复制前108.6±7.1 110.0±6.5 0.625 0.532模型复制后48.0±8.3 95.6±3.6 83.872 0.000垂直运动得分模型复制前24.8±8.3 25.1±7.0 0.264 0.792模型复制后11.4±1.5 26.2±7.2 21.657 0.000
模型组、假针刺组、针刺组小鼠干预前水平运动得分、垂直运动得分比较,差异无统计学意义(P>0.05)。模型组、假针刺组、针刺组小鼠干预后水平运动得分、垂直运动得分比较,差异均有统计学意义(P<0.05),针刺组高于模型组、假针刺组(P<0.05)。见表3。
表3 各组小鼠干预前后水平运动得分、垂直运动得分比较 (n=8,±s)

表3 各组小鼠干预前后水平运动得分、垂直运动得分比较 (n=8,±s)
组别垂直运动得分干预前13.0±11.0 11.4±3.5 13.1±4.0 0.304 0.743水平运动得分干预前41.3±9.4 43.3±9.5 45.3±9.7 0.212 0.812干预后30.3±5.9 29.5±4.9 41.2±8.8 4.673 0.032模型组假针刺组针刺组F 值P 值干预后6.8±1.9 7.2±2.9 11.6±3.7 4.305 0.039
2.4 各组小鼠小鼠下丘脑组织IL-1β、IL-6、TNFα蛋白相对表达量比较
各组小鼠下丘脑IL-1β、IL-6、TNF-α蛋白相对表达量比较,差异均有统计学意义(P<0.05)。模型组、假针刺组高于空白组(P<0.05),针刺组低于模型组、假针刺组(P<0.05)。见表4和图1。

图1 各组下丘脑组织炎症因子IL-1β、IL-6、TNF-α蛋白条带图
表4 各组小鼠下丘脑组织IL-1β、IL-6、TNF-α蛋白相对表达量比较 (n=8,±s)
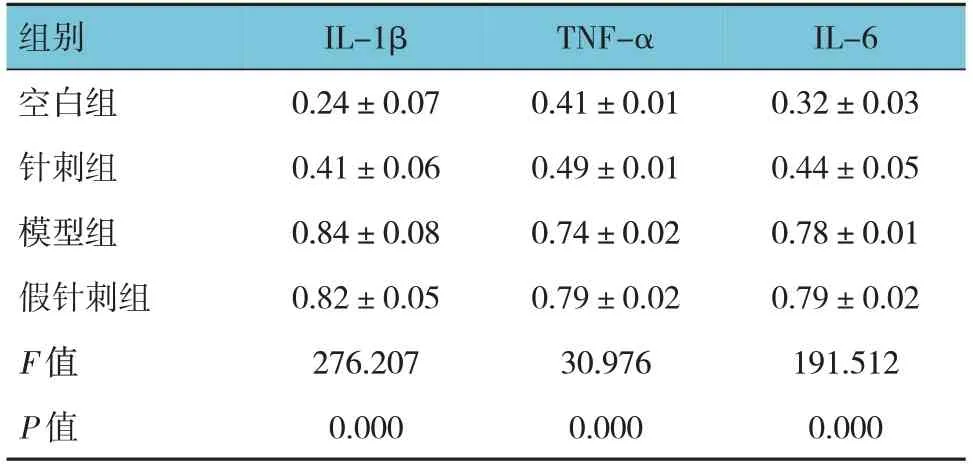
表4 各组小鼠下丘脑组织IL-1β、IL-6、TNF-α蛋白相对表达量比较 (n=8,±s)
组别空白组针刺组模型组假针刺组F 值P 值IL-1β 0.24±0.07 0.41±0.06 0.84±0.08 0.82±0.05 276.207 0.000 TNF-α 0.41±0.01 0.49±0.01 0.74±0.02 0.79±0.02 30.976 0.000 IL-6 0.32±0.03 0.44±0.05 0.78±0.01 0.79±0.02 191.512 0.000
2.5 各组小鼠结肠组织IL-1β、IL-6、TNF-α蛋白相对表达量比较
各组小鼠结肠组织IL-1β、IL-6、TNF-α蛋白相对表达量比较,差异均有统计学意义(P<0.05)。针刺组、模型组、假针刺组高于空白组(P<0.05),针刺组低于模型组、假针刺组(P<0.05)。见表5和图2。
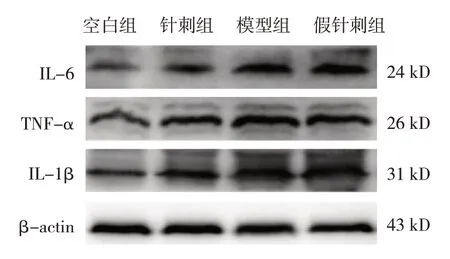
图2 各组小鼠结肠组织IL-1β、IL-6、TNF-α蛋白条带图
表5 各组小鼠结肠组织IL-1β、IL-6、TNF-α蛋白相对表达量比较 (n=8,±s)

表5 各组小鼠结肠组织IL-1β、IL-6、TNF-α蛋白相对表达量比较 (n=8,±s)
组别空白组针刺组模型组假针刺组F 值P 值IL-1β 0.33±0.04 0.42±0.03 0.80±0.01 0.82±0.02 59.055 0.000 TNF-α 0.36±0.07 0.46±0.10 0.82±0.04 0.81±0.07 453.071 0.000 IL-6 0.34±0.10 0.44±0.12 0.73±0.08 0.75±0.06 114.745 0.000
2.6 各组小鼠血清ACTH、CORT蛋白水平比较
各组小鼠血清ACTH、CORT蛋白水平比较,差异均有统计学意义(P<0.05)。模型组、假针刺组ACTH蛋白水平高于空白组(P<0.05),CORT蛋白水平低于空白组(P<0.05);针刺组ACTH蛋白水平低于模型组(P<0.05),CORT蛋白水平高于模型组(P<0.05);针刺组ACTH蛋白水平低于假针刺组(P<0.05),CORT蛋白水平高于假针刺组(P<0.05)。见表6。
表6 各组小鼠血清ACTH、CORT蛋白水平比较(n=8,pg/mL,±s)
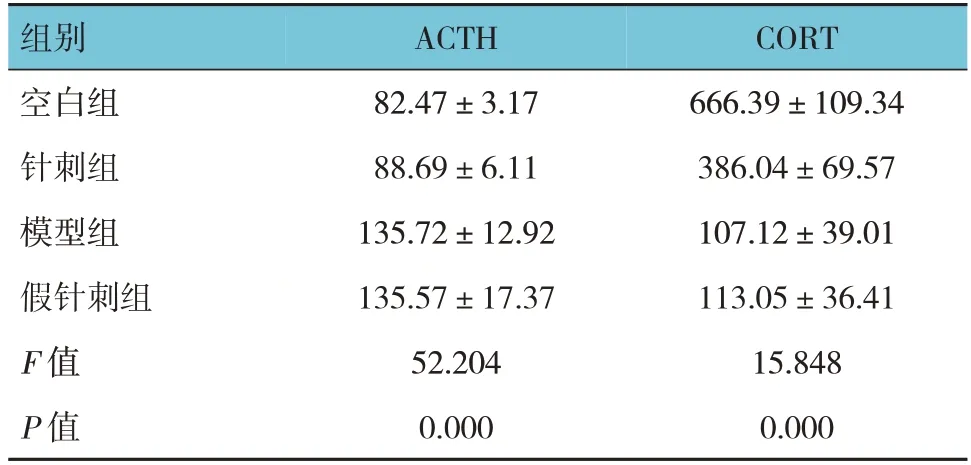
表6 各组小鼠血清ACTH、CORT蛋白水平比较(n=8,pg/mL,±s)
组别空白组针刺组模型组假针刺组F 值P 值ACTH 82.47±3.17 88.69±6.11 135.72±12.92 135.57±17.37 52.204 0.000 CORT 666.39±109.34 386.04±69.57 107.12±39.01 113.05±36.41 15.848 0.000
3 讨论
CRF属于中医“虚劳”范畴,主要病机为脏腑气血阴阳的亏虚[11]。化疗如“药毒”,耗伤机体脾胃气阴,脾胃乃气血生化之源,脾胃虚则气血生化无源,则有疲劳、乏力、纳差等症状,故化疗后引起的CRF基本病机为“虚”,脾胃受损为主,并兼气血阴阳亏虚[12]。中医传统针刺疗法治疗CRF有其独特优势,其可通过毫针刺激穴位,并施以补泻手法,激发经气,起到疏通经络、调节脏腑、运行气血、扶正祛邪的作用。足三里为足阳明胃经合穴,具有补益气血之功;三阴交属足太阴脾经,又与肝经、肾经相交通,有滋阴养脾、补益肝肾之功效;百会为诸阳之会,是人体阳气最强盛的地方,一穴补诸阳;关元、气海可起到激发正气,补益中气之功效[13]。李文涛等[14]研究发现调益三焦针法可缓解肺癌CRF患者的疲劳状态,增强患者免疫功能,改善生活质量;另一项研究证实针刺百会、内关、气海、足三里、三阴交治疗后,乳腺癌康复期患者的疲乏程度明显低于假穴浅刺组,生活质量得到明显提高[9];同时根据另一项Meta分析结果发现,针刺治疗CRF穴位使用频次较多的为足三里、关元、气海、三阴交、合谷、百会穴[15]。因此,本研究选用针刺足三里、三阴交、关元、气海、百会五个穴位,起到补益气血阴阳,滋养脾肾的功效。
本研究通过复制乳腺癌化疗后CRF小鼠模型,结合小鼠一般情况及强迫游泳实验、旷场实验,发现乳腺癌化疗后CRF小鼠行动迟缓、精神萎靡、毛发稀疏、大便稀黏、体重明显下降,强迫游泳不动时间明显延长,旷场内的水平运动得分和垂直运动得分均出现下降,证实荷瘤加化疗治疗的方法可以引起小鼠疲乏症状。针刺治疗后,小鼠精神状态明显好转,强迫游泳不动时间明显缩短,旷场内的水平运动得分和垂直运动得分均升高,提示治疗组小鼠疲乏程度有所减轻。结果证实针刺治疗可改善乳腺癌化疗后CRF小鼠的疲乏症状。
研究表明,CRF的发生与肿瘤本身、针对肿瘤的治疗措施、肿瘤合并症及与这些相关的社会心理等因素有关,但其具体的发病原因和机制尚不完全清楚,可能与炎性介质学说、HPA轴改变等诸多因素有相关性[5,16]。姜萍岚等[17]研究证实肿瘤及其治疗均可以激活促炎细胞因子网络,特别是在放化疗期间会产生IL-6、IL-8、IL-1β、TNF-α、CRP等促炎细胞因子,这些炎症因子可通过破坏的肠道屏障、血脑屏障等各种途径进入大脑,引起中枢炎症反应,破坏HPA轴,减少皮质醇合成和释放,引起疲乏。SCHREPF等[18]发现在肿瘤治疗完成后1年内疲乏症状得到改善的卵巢癌患者血浆中IL-6水平也随之降低。另有研究者发现,TNF-α的表达水平与肺癌CRF有关,疲乏组表达水平高于对照组[19]。本研究结果表明,与正常组小鼠比较,模型组、假针刺组小鼠下丘脑组织和结肠组织中IL-1β、IL-6、TNF-α水平显著升高,经针刺治疗后,上述细胞因子均显著降低,表明乳腺癌化疗后CRF小鼠中肠道和中枢炎症水平较高,而通过针刺治疗可明显抑制下丘脑和结肠的促炎因子分泌,改善中枢和肠道的炎症反应。
HPA轴包括CORT、CRH、ACTH等。有研究表明,HPA轴的改变在疲乏的发生、发展中充当重要角色[20]。一项随机对照试验发现,CRF组患者血清ACTH水平显著高于非疲乏组,且ACTH与CRF呈高度正相关[21];WEINRIB等[22]研究发现,卵巢癌患者血清CRH的变化与CRF呈负相关;MCEWEN等[23]指出,HPA轴可通过调节糖皮质激素而调节促炎症细胞因子的水平。CORT是糖皮质激素,主要受促肾上腺皮质激素调节,同时CORT又可以对促肾上腺皮质激素水平起反馈调节,而抗肿瘤治疗可以扰乱这种反馈调节机能,使皮质醇水平调节紊乱,从而导致CRF的发生[24]。本研究结果表明,与正常组比较,模型组、假针刺组小鼠CORT水平明显降低、ACTH水平明显升高;经针刺治疗后,针刺组CORT水平显著升高,ACTH水平明显下降,表明乳腺癌化疗后CRF小鼠中存在下丘脑相关激素水平紊乱,而通过针刺治疗可明显调节下丘脑相关激素水平变化,改善HPA轴功能紊乱状态。
综上所述,本研究证明针刺可降低乳腺癌化疗后CRF模型小鼠下丘脑、结肠组织中促炎因子水平,改善中枢和肠道的炎症反应,使进入大脑的炎症因子减少,进而提升血清CORT水平,降低ACTH水平,调节HPA轴功能紊乱状态,从而减轻乳腺癌CRF的疲乏症状,这可能是针刺治疗CRF的作用机制之一。同时本研究也存在一定的局限性,对肠-脑轴中生理屏障、全身炎症及中枢其他部分炎症等相关研究并未深入探讨,因此实验后续将在前期研究基础上探讨肠-脑轴更多相关指标的研究,为针刺通过调节肠道微生物-肠-脑轴治疗CRF的作用机制提供更多理论依据。
