清香型白酒大曲中产酯化酶微生物分离筛选及鉴定
2024-05-03刘小改马美荣李洪媛马东硕王小伟
刘小改,马美荣,李洪媛,马东硕,王小伟,张 坤
(北京红星股份有限公司,北京 101400)
中国白酒大曲制曲历史悠久,自古就有“曲乃酒之骨”之说。《书经·说命篇》记载:“若作酒醴,尔惟曲蘖”,曲蘖就是酒曲的起源。大曲综合物系、酶系、菌系于一体,是重要的微生物群落载体[1-2]。清香型大曲包含霉菌、酵母菌、细菌等各类微生物,在白酒酿造过程中起糖化、发酵、生香作用[3]。
乙酸乙酯是清香型白酒中主要呈味物质,对改变酒体的风味组成、赋予酒体浓郁香气及促进酒体丰满协调具有重要作用,其含量高低决定着清香型白酒的风格质量[4-5]。研究资料表明,清香型酒中乙酸乙酯合成主要通过3 种途径:乙醇与乙酸通过化学反应合成;乙醇与乙酸在胞外酯化酶催化作用下合成;在酵母细胞中,乙醇与乙酰辅酶A 在醇酰基转移酶(AATase)催化作用下合成。其中后两者为生物学反应[6-7]。
酯化酶在酶学分类上属于酯酶(Esterase E.C.3.1.1.2)范畴,是由具有酸、醇酯化功能的特定种类微生物发酵产生[8]。研究表明[9],酯酶大量存在于霉菌、酵母菌、细菌的发酵产物中,既可以水解酯类,也可以催化合成低级脂肪酸酯。
白酒酿造过程中霉菌、酵母菌、细菌多个种属微生物均能产生酯化酶,催化乙酸与乙醇合成乙酸乙酯[10]。乔晓梅[11]进行了酯化酶作用实验,发现在乙酸、乙醇化学体系中,添加酯化酶可增加总酯含量,推测乙酸乙酯可由胞外酶催化合成。王旭亮等[12]为了提高清香型白酒品质,以清香型汾酒发酵酒醅为筛选对象,筛选出了优质产酯化酶的菌株。研究表明,产酯酵母在合成乙酸乙酯过程中需要环境体系存在一定量氧气,白酒酿造体系为厌氧环境,酿酒酵母只有在无氧状态下才可发酵生成乙醇[13-14]。在麸曲白酒酿造大生产过程中投粮量大、料醅紧实、间隙溶氧量小,因此,通过产酯酵母代谢合成乙酸乙酯存在一定局限性。
大曲中微生物菌系丰富,微生物种类繁多,本研究的目标是从清香型白酒大曲中分离筛选获得可分泌酯化酶的微生物菌株[15-16],应用于白酒酿造,以期提升白酒中乙酸乙酯含量,改善白酒品质及口感。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 材料
清香型大曲:北京红星股份有限公司提供。
1.1.2 试剂及耗材
乙酸乙酯标准样,北京迪科马科技有限公司;乙酸,北京化工厂;乙醇,北京红星股份有限公司提供;蛋白胨、牛肉膏、琼脂粉,北京奥博星生物技术有限责任公司;氯化钠,北京化工厂;麦芽汁培养基,青岛海博生物技术有限公司;麸皮、豆粕粉、酒糟、酒尾,北京红星股份有限公司提供。
1.1.3 培养基
平板筛选培养基[17]:将下述培养基成分1 与成分2按照4∶1(V/V)混合均匀,121 ℃灭菌20 min。
成分1:蛋白胨0.7 %,牛肉膏0.3 %,氯化钠0.3%,琼脂粉2%。
成分2:将浓度为3 %的聚乙烯醇溶液与三丁酸甘油酯按照9∶1(V/V)充分混合均匀呈乳化液状态。
分离纯化及斜面保藏培养基:
细菌[18]:蛋白胨1%,牛肉膏0.3 %,氯化钠0.5%,琼脂粉2%。
霉菌[19]:麦芽汁培养基。
细菌液体种子培养基[20]:蛋白胨1 %,牛肉膏0.3%,氯化钠0.5%,121 ℃灭菌20 min。
霉菌种曲培养基[21]:麸皮19 g,豆粕粉1 g,蒸馏水20 mL,混合均匀,121 ℃灭菌40 min。
酯化发酵培养基:麸皮∶酒糟∶水按1∶1∶10 比例混合煮沸20 min 后过滤,收集滤液,121 ℃灭菌20 min,接种前加入滤液量10%的酒尾。
麸曲培养基:同霉菌种曲培养基。
1.1.4 仪器设备
GC-2010Pro 气相色谱仪,日本岛津公司;BX51 显微镜,奥林巴斯公司;LA230S 电子天平,赛多利斯公司;CJ-2DFS 净化工作台,天津市泰斯特仪器有限公司;LDZX-50KBS 立式压力蒸汽灭菌器,上海申安医疗器械厂;DHP-9272电热恒温培养箱,上海一恒科学仪器有限公司;HY60S生物摇床,武汉汇诚生物科技有限公司;JJ6000 型电子天平,常熟市双杰测试仪器厂。
1.2 试验方法
1.2.1 大曲中产酯化酶菌株的分离纯化
大曲块粉碎后,称取大曲粉1 g,加入到装有99 mL 生理盐水和少量玻璃珠的锥形瓶中,充分振荡混匀,制成菌悬液。按照10 倍稀释梯度,以无菌水逐级稀释。取10-3、10-4、10-5三个梯度稀释液,各吸取0.2 mL涂布筛选平板培养基,每梯度做3个平行样[20]。培养皿倒置于35 ℃培养箱中培养1~2 d,观察其生长情况。
将周边出现透明圈的菌落挑出,并重新划线接种至分离纯化平板培养基上,于35 ℃培养1~2 d,采用以上平板划线法多次重复纯化,直至分离纯化得到不同形态微生物单纯菌落[22],转接至斜面培养基,于4 ℃冰箱保藏。
1.2.2 细菌种子液培养
将分离纯化得到的细菌菌株接种至液体种子培养基中,37 ℃、150 r/min振荡培养40 h[23]。
1.2.3 霉菌种曲培养将分离纯化得到的霉菌菌株接种至种曲培养基中,32 ℃,静置培养4 d,每日摇瓶2次。
1.2.4 菌株初筛
将培养完成后的细菌种子液以10 %接种量、霉菌种曲以3 %接种量分别接入酯化发酵培养基中,于30 ℃静置培养3 d,每日摇瓶2 次[24]。培养完成后,取100 mL 发酵液,加入100 mL 浓度70%vol乙醇,蒸馏提取100 mL 蒸馏液,使用气相色谱仪测定蒸馏液中乙酸乙酯含量。
1.2.5 微生物麸曲培养
会议要求,要进一步细化落实国务院办公厅关于做好非洲猪瘟等动物疫病防控工作通知的任务分工,完善联防联控工作机制。近期,要组成督查组,赴各地特别是重点省份开展非洲猪瘟防控工作督查,聚焦责任落实、应急处置、生猪调运和餐厨剩余物监管等重点工作。要压实地方的属地管理责任,督促地方各级人民政府对本地区防控工作负总责,切实落实有关防控措施,统筹做好养殖业生产安全和肉品供给保障。
将培养完成后的初筛菌株细菌种子液以10%接种量、霉菌种曲以1 %接种量接入麸曲培养基中,分别于37 ℃、32 ℃静置培养3~5 d,每日翻拌或摇瓶2次。
1.2.6 麸曲酯化力测定
称取5 g 左右麸曲样品,吸取1 mL 乙酸,加入到100 mL 浓度15 %vol 的酒精中,于30 ℃进行酯化反应6 d。酯化反应液经蒸馏提取得到50 mL 蒸馏液,使用气相色谱仪测定蒸馏液中乙酸乙酯含量,计算微生物麸曲酯化力[25]。
色谱条件[26]:DM-WX 毛细管柱;分流比:10∶1;汽化室温度230 ℃;程序升温:初始70 ℃,以10 ℃/min 升温至230 ℃,保持10 min;检测器为FID 检测器,检测器温度240 ℃;载气流速:氮气35 mL/min,氢气40 mL/min,空气400 mL/min。
其中:c——酯化蒸馏液中乙酸乙酯含量,mg/L;
m——细菌麸曲用量,g。
1.2.7 清香型白酒大曲高通量检测及宏基因组测序
清香型大曲高通量检测及宏基因组测序由上海美吉生物医药科技有限公司完成。根据检测结果对大曲中微生物组成及功能贡献进行分析[27],为菌株筛选方向提供理论参考依据。
微生物菌株基因测序由华大基因科技有限公司完成。采用16S rDNA 测序方法对目标菌株进行分子生物学鉴定[28]。
2 结果与分析
2.1 清香型白酒大曲高通量及宏基因组检测分析
分别对5 种不同来源清香型白酒大曲进行高通量检测。由结果分析可知,清香型白酒大曲中真菌(如图1 所示)主要以黄曲霉、酵母菌、复膜孢酵母菌、念珠菌、伊萨酵母菌等微生物为主;细菌(如图2 所示)主要以乳酸菌、糖多孢菌、芽孢杆菌、链霉菌等微生物为主。

图1 清香型白酒大曲真菌群落结构分布图

图2 清香型白酒大曲细菌群落结构分布图
应用宏基因组测序对清香型白酒大曲微生物与功能贡献度进行关联预测分析,结果见图3。
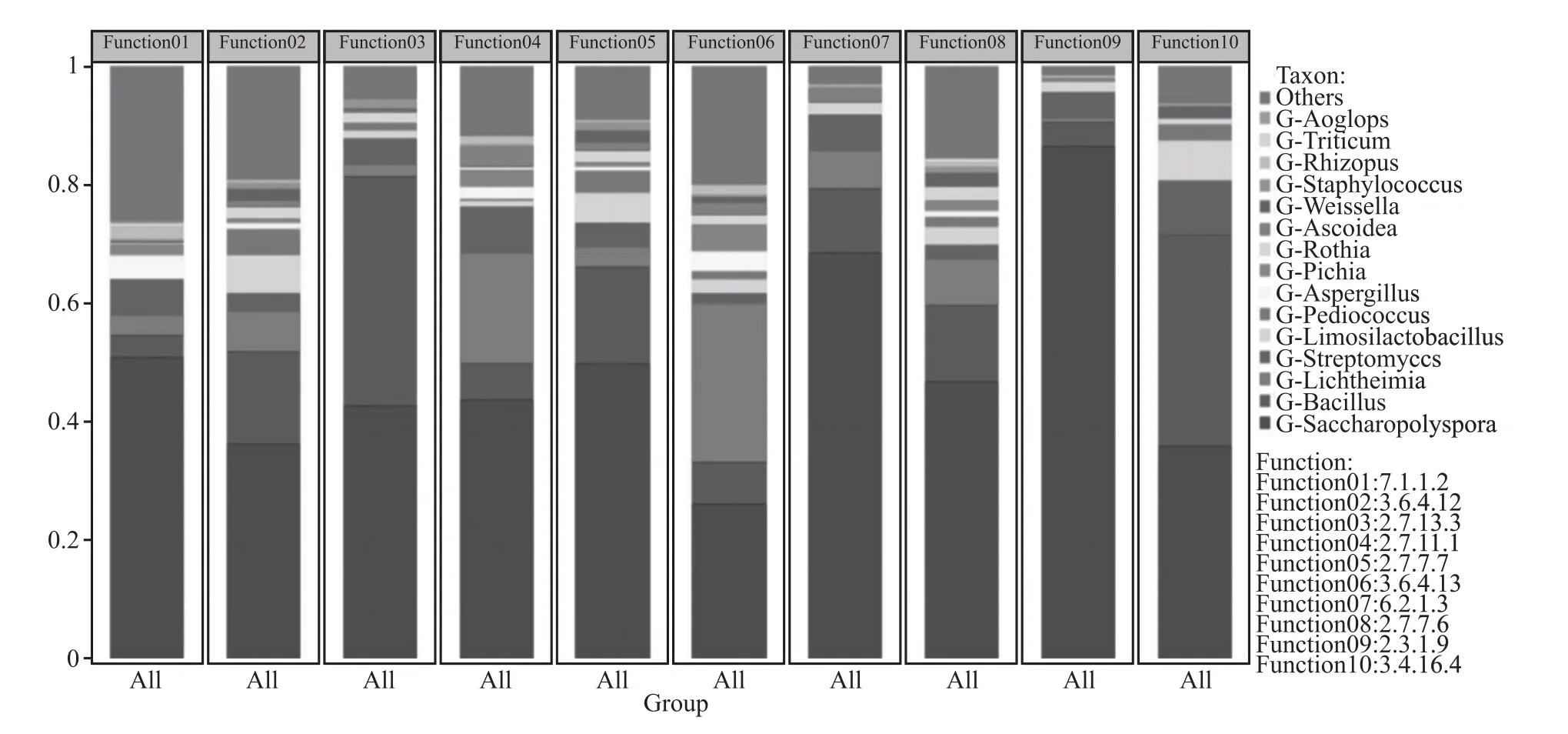
图3 清香型白酒大曲微生物物种与功能贡献
由图3 可知,糖多孢菌属对组氨酸、丝氨酸等多种氨基酸代谢和长碳链脂肪酸酯代谢存在贡献;芽孢杆菌属、横梗霉属、链霉菌属对氨基酸代谢影响较为显著;魏斯氏菌属有助于长碳链脂肪酸-辅酶A 连接酶、乙酰辅酶转移酶、谷氨酸合成酶的产生;毕赤酵母属有助于羧肽酶、谷氨酸合成酶、β-半乳糖苷酶的生成;横梗霉属与根霉属对羧肽酶、β-半乳糖苷酶的产生有促进作用。
2.2 清香型白酒大曲产酯化酶微生物初步筛选
采用稀释平板涂布法结合显微镜观察,最终从大曲粉菌悬液中分离、纯化获得12 株不同种类、形态菌株,包括细菌7 株、霉菌5 株,分别编号为HXX1—HXX7、HXM1—HXM5。
将培养好的菌株接种至酯化发酵培养基中,以空白培养基为对照,培养完成后利用气相色谱法对酯化发酵液提取样品中乙酸乙酯含量进行测定,标准品色谱图及样品分析色谱图分别见图4、图5。
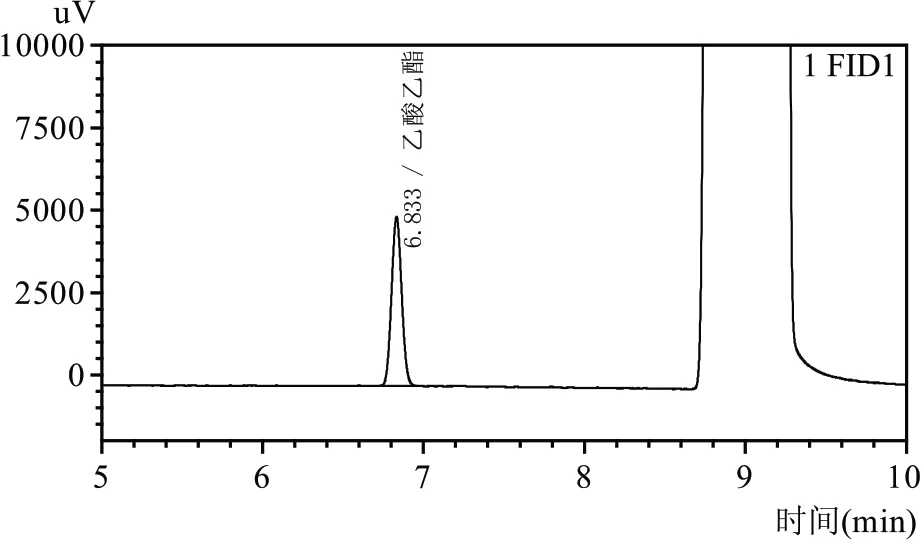
图4 乙酸乙酯标准品色谱图

图5 酯化发酵液分析色谱图
由图5 可以看出,在选定的色谱条件下,乙酸乙酯与其他物质分离效果良好,该色谱方法可以对乙酸乙酯含量进行准确测定。
测定不同菌株发酵提取液中乙酸乙酯含量,结果见表1。

表1 分离菌株酯化发酵液检测结果
由检测结果可知,细菌菌株HXX2、HXX3、HXX7,霉菌菌株HXM3 发酵液中乙酸乙酯含量相对较高,均超过100 mg/L,说明这些菌株可能具备分泌酯化酶的能力,具有酯化作用。对细菌菌株HXX2、HXX3、HXX7,霉菌菌株HXM3、HXM4 进一步开展筛选实验。
2.3 清香型白酒大曲产酯化酶微生物复筛结果
将初筛所得HXX2、HXX3、HXX7、HXM3、HXM4 菌株分别培养成麸曲。以空白反应液为对照,测定各菌株麸曲酯化力,结果见图6。

图6 不同麸曲酯化力检测结果
从图6 可看出,初筛所得的5 株微生物麸曲酯化力差异明显,表明不同微生物产酯化酶能力不同,其中细菌HXX7 麸曲酯化力较高,可达20.6 mg/g,催化合成乙酸乙酯能力较强。
2.4 高产酯化酶细菌菌株形态观察
对筛选所得高产酯化酶微生物菌株HXX7 菌落形态及细胞形态特征进行观察,HXX7 菌落(如图7 所示)呈乳白色,圆形,表面光滑,光泽度差,边缘整齐;通过显微镜观察该菌微观形态,菌体细胞形态为短杆状,经革兰氏染色后菌体呈紫色,为革兰氏阳性细菌。

图7 菌株HXX7的菌落(a)及细胞形态(b)
2.5 高产酯化酶细菌菌株分子生物学鉴定
对细菌菌株HXX7 进行16S rDNA 序列测定,将所测得核酸序列在GenBank 数据库中进行Blast搜索比对,发现菌株HXX7 与枯草芽孢杆菌Bacillus subtilissubsp.inaquosorum strain BGSC 3A28 的16S rDNA 序列相似度为100%,因此确定HXX7 为枯草芽孢杆菌(Bacillus subtilis)。
利用MEGA7.0.26 软件中的NJ 法构建菌株HXX7的系统发育树,结果见图8。

图8 菌株HXX7的系统发育树
3 结论
本研究从清香型白酒大曲中分离筛选得到1株具有产酯化酶能力的细菌菌株HXX7,其麸曲酯化力达20.6 mg/g,可催化乙酸、乙醇合成乙酸乙酯,该菌株应用于白酒酿造生产中,在增加清香型白酒乙酸乙酯含量方面具有良好的应用前景,对清香型白酒生产及酒质提升具有重要意义。
本研究仅初步筛选出了高酯化力微生物菌株,对其在白酒酿造过程中的应用情况评估、确定应用条件及方案以及探究乙酸乙酯含量提高对红星二锅头白酒品质改善的促进作用还需要进一步进行深入研究,最终为生产提供理论依据。
