中药治疗咳嗽变异性哮喘的机制研究进展❋
2024-04-29余梦瑶
余梦瑶,李 芳,苏 琛,雷 勇,罗 霞△
(1.四川省中医药科学院,成都 610041;2. 菌类药材系统研究与开发实验室,成都 610041;3. 中药材品质及创新中药研究四川省重点实验室,成都 610041)
咳嗽变异性哮喘(cough variant asthma,CVA)是一种特殊类型的哮喘,咳嗽是其唯一或主要的临床表现,大多数患者无喘息、气急等症状或体征,但存在与典型哮喘类似的气道高反应(airway hyperresponsiveness,AHR)、嗜酸性粒细胞(eosinophils,EOS)性气道炎症、气道重塑等病理特征。CVA发病率高,身心危害大,疾病负担重。CVA是慢性咳嗽的最主要病因,占成人病例的32.6%[1]、儿童病例的41.95%[2]。按慢性咳嗽流行病学调查结果(成人发病率6.22%,儿童发病率7.67%[3])估算,我国现有CVA患者超3 000万人,其中儿童800万人。30%~40%的成人患者和50%左右的儿童患者将进一步发展为典型哮喘[4]。CVA患者较典型哮喘更为抑郁和焦虑[5]。患者长期用药和反复就医,也极大地增加了社会和家庭经济负担。中药治疗CVA具有明显特色和优势,但由于缺乏对其作用机制的深入研究,限制了其临床推广和新药转化。近年来,中医药学者针对这一问题开展了系列研究,并取得了一定进展。本文综述了中药治疗CVA机制的研究现状,并针对现有研究不足提出3点建议,以期为中药治疗CVA的临床推广和药物开发提供参考。
1 中药治疗CVA的现状与不足
西医推荐以吸入性糖皮质激素联合支气管舒张剂、白三烯受体拮抗剂治疗CVA[6],但存在口咽部不适、感染、激素诱导的全身反应等不良反应[7],且由于给药时间长、操作不便,导致患者依从性较差,影响治疗效果[8]。中药治疗成人[9]和儿童[10]CVA均取得了良好的效果,安全性较高,患者依从性好,日益受到重视。中医认为,CVA病位在肺,与肝、脾、肾相关,其病理因素可归纳为风、燥、痰、瘀、虚[11],病因病机主要包括风邪袭肺、寒邪干肺、燥邪伤肺、痰饮伏肺、脏腑功能失调等[12],临床基于脏腑病位多从肺肝、肺脾、肺肾、鼻咽论治,基于病理因素多从风痰、阴虚、痰湿、气逆论治[13]。《中医儿科临床诊疗指南·小儿咳嗽变异性哮喘(制订)》将小儿CVA分为风寒袭肺型、风热犯肺型、痰邪蕴肺型、肺脾肾虚型4型,在治疗上提倡以消风、止咳、固本为基本原则,按发作期、缓解期、稳定期3期分治[14]。尽管中药在CVA临床治疗上取得了良好的收益,但对其作用机制阐释不明确,限制了其进一步推广应用和新药转化。
2 中药治疗CVA的作用机制
近年来,中医药学者主要从改善气道炎症、减轻AHR、改善气道重塑、降低咳嗽敏感性、保护肺损伤、增加糖皮质激素敏感性等方面对中药有效成分、中成药、方剂治疗CVA的作用机制开展了研究,见表 1。同时,针对中药多成分、多靶点的作用特征,一些学者应用网络药理学方法尝试进一步阐释中药治疗CVA的作用机制网络,也取得了一定进展。
2.1 改善气道炎症
气道炎症是CVA最重要的病理机制。中药改善CVA气道炎症的作用主要包括减少炎性细胞浸润、调节辅助性T细胞(T helper,Th)1/Th2与Th17/调节性T细胞(regulatory T cells,Treg)平衡、调节神经源性炎症等方面,主要涉及NF-κB和Notch两条信号通路。

表1 中药治疗咳嗽变异性哮喘的作用机制研究总结
2.1.1 减少炎性细胞浸润 CVA患者呼吸道EOS[65]及中性粒细胞[66]增多,与症状强度及治疗效果密切相关。苏黄止咳胶囊[24]、抗支糖浆[25]、桑梅止咳颗粒[46]等药物能够减少外周血、肺泡灌洗液(bronchoalveolar lavage fluid,BALF)或肺组织中炎性细胞,特别是EOS的数量和比例,降低EOS等炎性细胞在支气管附近等部位的浸润,从而减轻气道炎症,缓解CVA症状。
2.1.2 调节Th1/Th2平衡 基于对典型哮喘的病理机制认识,推测Th1/Th2失衡在CVA中也普遍存在。过度应答的Th2或2型天然淋巴细胞(group 2 innate lymphoid cell,ILC2)分泌白细胞介素(interleukin,IL)-4、IL-5、IL-13等细胞因子,并进一步引起EOS增多、黏液高分泌、AHR、免疫球蛋白(immunoglobulin,Ig)E生成等病理变化[67]。Cao等[68]发现CVA患者痰液蛋白组学分析与典型哮喘患者大体类似,仅有少量差异,证明上述推测具有较强的合理性。
调节Th1/Th2免疫平衡,是多数中药治疗CVA的主要机制之一。Li等[45]报道,寒喘祖帕颗粒能够降低CVA模型豚鼠血清中Th2细胞因子IL-4、IL-5含量,增加Th1细胞因子干扰素(interferon,IFN)-γ含量,降低Th2特异性转录因子GATA结合蛋白(GATA binding protein,GATA)3 mRNA和蛋白表达,增加Th1特异性转录因子T-bet mRNA和蛋白表达,从而调节Th1/Th2失衡,改善CVA症状。秦钰等[56]发现,麻黄定喘汤能够显著减少CVA模型小鼠BALF中IL-4、IL-5、IL-13含量,增加IFN-γ含量,从而调节IL-4/IFN-γ失衡,减轻CVA小鼠肺组织炎性浸润。Jiao等[17]研究发现,柚皮苷可减少CVA模型豚鼠辣椒素引咳次数,减轻AHR,其机制与减少BALF中IL-4、IL-5、IL-13含量有关。
2.1.3 调节Th17/Treg平衡 Th17/Treg失衡也是哮喘的重要病理机制。Shi等[69]研究发现,在中度至重度哮喘患者中,Th17细胞比例和血浆IL-17含量显著增加,而Treg细胞比例和血浆IL-10含量显著减少。
研究表明,部分中药可调节CVA的Th17/Treg平衡。三拗汤能够下调肺组织IL-17A、IL-17F mRNA表达,减少脾脏Th17细胞比例,降低Th17/Treg比值[59]。抗支糖浆能够降低CVA豚鼠模型BALF和血清中IL-17含量,增加IL-10含量,同时能够降低肺组织Th17特异性转录因子RORγt mRNA和蛋白表达水平,增加肺组织Treg特异性转录因子Foxp3 mRNA和蛋白表达水平[28]。
2.1.4 调节神经源性炎症 神经源性炎症在CVA发病中的作用也不容忽视。受到瞬时受体电位香草酸亚型(transient receptor potential vanilloid,TRPV)1信号刺激的神经末梢及气道结构细胞、免疫炎症细胞等,均可产生神经生长因子(nerve growth factor,NGF)[70]。NGF一方面可作用于炎性细胞,促进炎性递质的释放,另一方面可诱导神经末梢释放降钙素基因相关肽(calcium gene related peptide,CGRP)、P物质(substance p,SP)、神经激肽(neurokinin,NK)等,进一步加重炎症发展,同时引起气道平滑肌收缩。
部分中药能够调节CVA模型动物的神经源性炎症。王鹏丽[55]研究发现,三拗汤加全蝎、僵蚕可显著降低CVA模型小鼠BALF中NGF、CGRP含量。麻杏石甘汤能够减少CVA模型大鼠肺组织中CGRP、SP含量,减少肺组织中神经激肽1受体(neurokinin-1 receptor,NK-1R)表达[60]。黄龙止咳口服液能够显著降低CVA模型大鼠BALF中NGF含量,减少肺组织中NGF、CGRP的蛋白表达[30]。
2.1.5 相关信号通路 核因子(nuclear factor,NF)-κB信号通路在中药改善CVA气道炎症中研究最为广泛[71]。侯丹等[46]研究表明,桑梅止咳颗粒能够增加CVA模型大鼠肺组织NF-κB抑制因子(NF-κB inhibitor,IκB)α蛋白表达,降低NF-κB p65蛋白表达,从而通过NF-κB信号通路抑制炎症反应,降低血清IL-4、IL-5、IL-10含量,减少外周血炎性细胞数量,降低肺组织病理评分,发挥治疗CVA的作用。温肺疏风方能降低CVA小鼠肺组织Toll样受体(toll-like receptor,TLR)4、NF-κB p65、p38 丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、胞外信号调控激酶(extracellular-signal regulated kinase,ERK)1/2、c-Jun N末端激酶(c-Jun N-terminal kinase,JNK) mRNA表达,降低肺组织TLR4、p-NF-κB p65、p-p38MAPK、p-ERK1/2、p-JNK蛋白表达,说明其作用机制涉及TLR4-NF-κB-MAPK信号通路[61]。黄龙止咳口服液可降低肺组织TLR4、髓系分化因子(myeloid differentiation factor,MyD)88、p-NF-κB p65蛋白表达,提示其作用机制与TLR4-MyD88-NF-κB信号通路有关[29]。
Notch信号通路对调节Th细胞分化有重要作用,对调节Th1/Th2、Th17/Treg失衡也具有重要意义。Hua等[15]研究发现,大黄素能够降低肺组织Notch受体(notch receptor,Notch)1、Notch 2、Notch 3及Notch配体Delta样配体(delta like ligand,DLL)4的表达,降低血清和BALF中IgE、IgG1/IgG2a含量,减少肺组织炎性细胞浸润,降低血清和BALF中IL-5,IL-17含量,表明大黄素能够通过抑制Notch信号通路发挥调节作用。加味六安煎能够降低肺组织Jagged配体(jagged ligand,Jagged)1、Notch1、Notch蛋白胞内结构域(intracellular domain of the notch protein,NICD)蛋白表达,增加DLL1蛋白表达,提示其改善气道炎症作用也与Notch信号通路有关[35]。
2.2 减轻AHR
AHR是CVA的一种重要病理表现。炎症和外源刺激物诱导气道平滑肌细胞增殖和收缩致使气道狭窄,导致AHR。平滑肌细胞还参与炎症过程,进一步加剧AHR进展和气道重塑[72]。
中药可降低支气管收缩药物激发后气道阻力,改善AHR。阎玥等[47]发现,应用紫诃朴喘颗粒后,在乙酰甲胆碱浓度为50 mg/mL时,低剂量组气道阻力显著降低,其他各给药组均有下降趋势。寒喘祖帕颗粒能够显著降低CVA模型豚鼠受乙酰甲胆碱诱导的气道阻力变化[45]。采用大鼠离体气管环、气管平滑肌细胞研究发现,柚皮苷及其苷元能够舒缓气管环收缩,其机制可能为通过促进开放大电导钙激活钾通道,引起质膜超极化和减少Ca2+流入,从而舒缓气管平滑肌。
2.3 改善气道重塑
气道重塑是CVA病程进一步严重发展的重要标志,涉及气道平滑肌的收缩性增加、炎性表型及其胞外基质组成变化。血管生成和黏膜新生血管、胞外基质和胶原沉积是气道重塑的关键因素[73]。
中药能够干预CVA的气道重塑过程。加味芎蝎散能够显著改善CVA模型大鼠的气道重塑,降低CVA大鼠模型支气管面积、支气管平滑肌面积和支气管平滑肌厚度[40],其作用机制包括:增强气道平滑肌中自噬蛋白Beclin1、微管相关蛋白1轻链(microtubule associated protein 1 light chain,LC)3的表达,增加平滑肌细胞自噬[41];增强细胞间连接蛋白上皮型钙黏附蛋白(epithelial cadherin,E-cadherin)、带状闭合蛋白(Zonula occludens,ZO)-1、紧密连接蛋白(Claudin)3的表达,缓解气管黏膜上皮细胞损伤[42];增加平滑肌细胞α-平滑肌肌动蛋白(smooth muscle actin,SMA)和钙调理蛋白(Calponin)表达,抑制其向“分泌表型”转化[43];抑制平滑肌增殖,降低肺组织和平滑肌组织基质金属蛋白酶(matrix metalloproteinases,MMP)-9、基质金属蛋白酶抑制因子(tissue inhibitor of metalloproteinases,TIMP)-1表达,减少细胞外基质(extracellular matrix,ECM)沉积[40];降低肺间质分化抗原簇(cluster of differentiation,CD)31、IL-8、CXC趋化因子受体(CXC chemokine receptor,CXCR)1表达,基于IL-8-CXCR1通路抑制细胞迁移和血管新生[44]。张宁宁等[34]报道,CVA模型豚鼠灌胃加味六安煎后肺组织胶原沉积面积显著减小,肺组织和BALF中转化生长因子(transforming growth factor,TGF)-β、MMP-9 mRNA表达显著降低,提示加味六安煎可通过调节TGF-β、MMP-9表达减轻气道胶原沉积,进而改善气道重塑。
TGF-β/Smad通路可通过调节气道平滑肌细胞的增殖、分泌、细胞周期等促进平滑肌增生肥大和表型转化,促进气道重塑的发生[74]。而丝氨酸/苏氨酸激酶AKT和ERK蛋白作为信号通路下游分子,可以通过TGF-β通路的分子信号,影响胶原沉积和纤维化的形成,促进气道重塑过程。孙洮玉等[16]研究发现,川芎嗪能够显著降低CVA模型大鼠支气管面积、支气管平滑肌面积和支气管平滑肌厚度,减少胶原沉积率,同时显著减少模型动物支气管平滑肌TGF-β、AKT、ERK蛋白表达,表明川芎嗪能够通过调节TGF-β/Smad和AKT/ERK信号通路抑制平滑肌增殖、改善气道重塑。
2.4 降低咳嗽敏感性
CVA气道炎症可诱导TRPV1表达增加,形成咳嗽高敏感性,而TRPV1的表达增加可诱导释放多种神经肽,加重气道神经源性炎症,进一步增加咳嗽敏感性。Wang等[54]研究发现,CVA模型小鼠BALF中NGF和神经肽CGRP及神经源性炎性介质前列腺素(prostaglandin,PG)E2显著增加,同时,肺组织和延脑组织中瞬时受体电位锚蛋白(transient receptor potential ankyrin,TRPA)1、TRPV1、TRPV5 mRNA和蛋白表达显著增加,而三拗汤配伍全蝎、僵蚕处理后,BALF中NGF、CGRP、PGE2含量显著下降,TRPA1、TRPV1、TRPV5 mRNA和蛋白表达水平降低,提示三拗汤配伍全蝎、僵蚕能够降低咳嗽敏感性,改善CVA症状。
2.5 保护肺损伤
CVA持续的肺部炎症可导致肺损伤,中药可有效干预这一过程。Qin等[21]研究发现,苏黄止咳胶囊能够减轻CVA模型大鼠肺组织损伤,其作用机制为:苏黄止咳胶囊通过抑制TRPV-1表达,减少其介导的Ca2+集聚诱导的蛋白激酶Cε(protein kinase Cε,PKCε)转位和活化,从而降低CVA模型大鼠肺组织葡萄糖调控蛋白(glucose-regulated protein,GRP)78、活化转录因子(activating transcription factor,ATF)6、X盒结合蛋白(X-box binding protein,XBP)-1蛋白表达,降低RNA依赖性蛋白激酶样内质网激酶(RNA-dependent protein kinase-like ER kinase,PERK)、肌醇必需酶(inositol-requiring enzyme,IRE)1α、真核翻译起始因子(eukaryotic initiation factor,eIF)2α磷酸化水平,减轻CVA模型大鼠肺组织内质网应激,同时苏黄止咳胶囊也能够干扰NOD样受体热蛋白结构域(NOD-like receptor pyrin domain containing,NLRP)3炎症小体的组装,抑制其活化,减少Caspase-1表达和活化,降低IL-1β分泌,上述作用与硫氧还蛋白互作蛋白(thioredoxin-interacting protein,TXNIP)的诱导和PKR介导的受体互作蛋白(receptor-interacting protein,RIP)1-RIP3-动力蛋白相关蛋白(dynamin-related protein,Drp)1通路相关,而苏黄止咳胶囊对内质网应激的抑制作用是降低NLRP3炎症小体活性的先决条件。
2.6 增加糖皮质激素敏感性
吸入性糖皮质激素是治疗CVA的主要手段,但有部分患者因糖皮质激素不敏感,导致治疗效果欠佳。Lyu等[22]发现,苏黄止咳胶囊能够增加卵白蛋白(ovalbumin,OVA)联合香烟烟气导致的CVA模型豚鼠肺组织中糖皮质激素受体(glucocorticoid receptor,GR)表达,同时减少与糖皮质激素敏感性呈负相关的p38 MAPK磷酸化水平,上调具有促进p38 MAPK脱磷酸化作用的丝裂素活化蛋白激酶磷酸酶(mitogen-activated protein kinase phosphatase,MKP)-1的mRNA表达水平,从而提升苏黄止咳胶囊与布地奈德联合使用的临床疗效。
2.7 网络药理学研究
网络药理学能够揭示药物与治疗对象之间的分子关联网络,更好地阐释药物的整体作用机制[75]。一些学者就中药治疗CVA的网络药理学机制开展了初步研究。综合已有研究来看,治疗CVA中药的关键化学成分集中于槲皮素、山柰酚、木犀草素等化合物,核心靶点集中于AKT1、IL-6、JUN原癌基因、肿瘤坏死因子(tumor necrosis factor,TNF)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、血管内皮生长因子(vascular endothelial growth factor,VEGF)A等蛋白,信号通路集中于磷脂酰肌醇3-激酶(phosphoinositide-3 kinase,PI3K)-AKT、TNF、TLR、IL-17等通路,见表2。
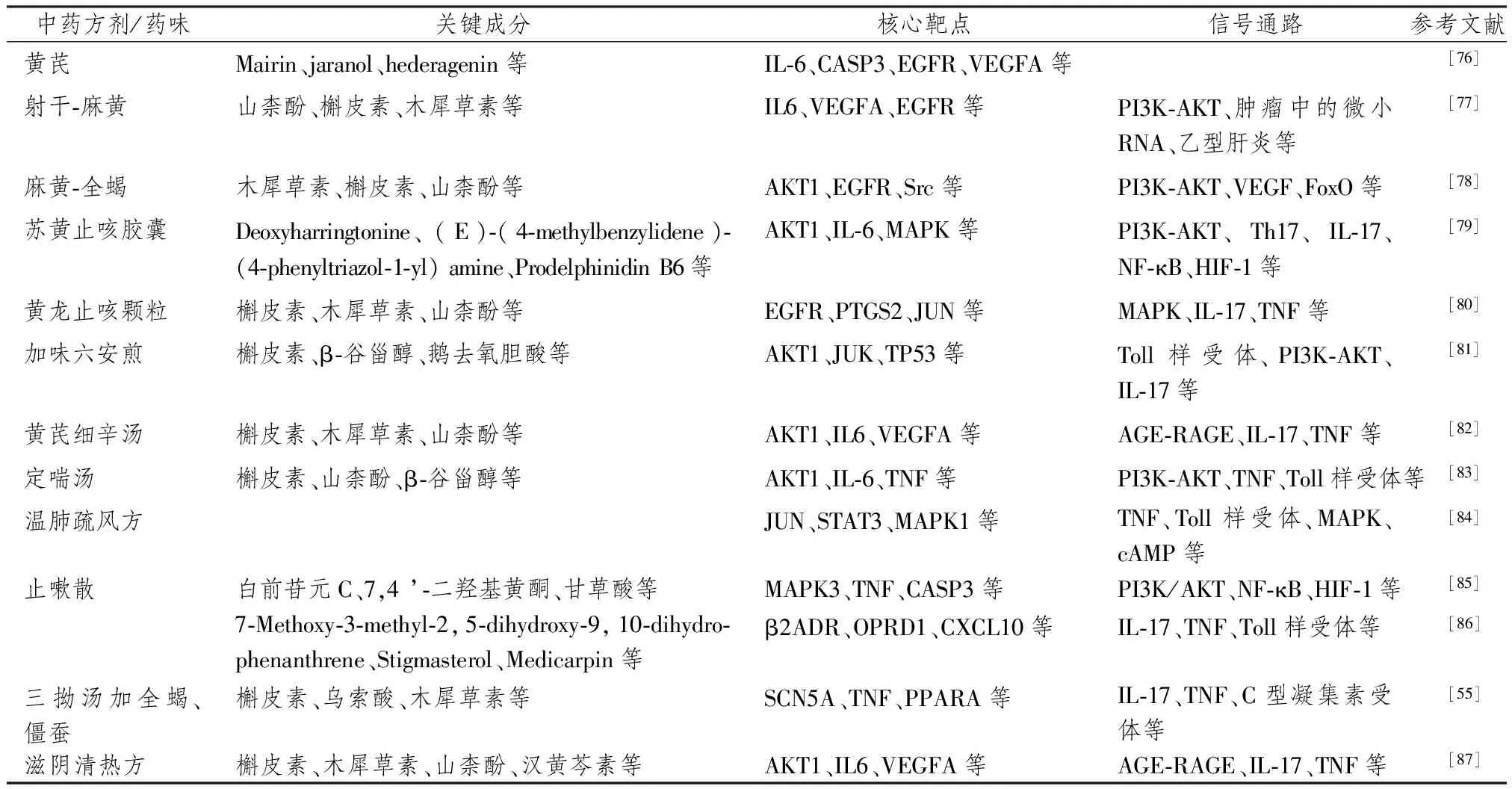
表2 中药治疗咳嗽变异性哮喘的网络药理学研究总结
Xia等[82]采用网络药理学方法研究了黄芪细辛汤治疗CVA的作用机制,筛选出黄芪细辛汤的48个活性物质和217个目标基因,并进一步获得与CVA相关的候选基因132个,构建了药物-成分-靶标网络和蛋白质-蛋白质相互作用网络,GO功能富集分析显示,黄芪细辛汤作用于毒性物质反馈、细菌来源分子反馈等生物过程,蛋白异二聚化、细胞因子受体结合等分子功能,以及膜筏、膜微区等细胞组分,KEGG通路富集分析显示,黄芪细辛汤作用于晚期糖基化终末产物 (advanced glycation end product,AGE)-糖基化终末产物受体(receptor for dvanced glycation end product,RAGE)、IL-17、TNF等信号通路。乔伊娜等[78]发现麻黄-全蝎作用于CVA的有效成分有23个、靶点67个,关键成分有:木犀草素、槲皮素、山柰酚等,核心靶点涉及丝氨酸/苏氨酸蛋白激酶、表皮生长因子等,GO功能生物过程富集分析显示其主要涉及细胞凋亡、炎症反应、磷酸化等生物过程,KEGG通路富集分析共得到39条通路,主要通路有PI3K-AKT信号通路、VEGF信号通路等。
3 结语
CVA作为一种发病率高、身心危害大、社会负担重的慢性疾病,中医药在其防治中能够发挥自身的特色和优势。近年来,中药治疗CVA的相关研究在一定程度上阐释了中药对气道炎症、气道重塑、咳嗽敏感性等方面的作用机制,这些研究成果为中药的临床应用推广和创新药物转化提供了一定的支撑,但以下方面仍待进一步完善。
3.1 完善符合临床特点的病证结合动物模型
目前研究采用的多为OVA诱导的大鼠、小鼠、豚鼠CVA模型,仅能模拟部分疾病症状,但不能反映CVA风邪袭肺、寒邪干肺、燥邪伤肺、痰饮伏肺等中医病因病机,因此难以明确不同中医治法针对不同病因病机的差异化作用机制。通过构建符合临床特点的病证结合动物模型,不仅有利于揭示不同方药的作用机制,还有利于更好地理解中医治法的现代生物学内涵。
3.2 完善针对CVA不同病程的中药作用机制研究
现有研究多集中于中药对CVA发作期的作用机制,针对缓解期、稳定期方药的作用机制研究较少。而根据不同病程进行辨证治疗是中医药的特色和优势,因此,进一步完善中药对CVA缓解期、稳定期的作用机制研究,对进一步推动中医临床应用和创新药物转化有重大意义。
3.3 完善中药治疗CVA的“功效-物质-靶标”系统诠释和深度研究
现有中药治疗CVA的作用机制研究中,多数有效物质和作用靶标尚未充分明确,虽然近年来在网络药理学等前沿学科的支持下,部分中药的有效成分(组分)、作用靶标及其相互作用网络研究取得了一定的进展,但仍有待进一步系统验证。因此,在现有研究方法和基础上,进一步综合应用网络药理学、多组学技术等前沿技术与方法,深入开展中药治疗CVA的“功效-物质-靶标”研究,对深化创新药物研发以及理解中医药传统理论大有裨益。
