发酵大弹涂鱼饲料乳酸菌的筛选鉴定及其发酵条件优化
2024-04-29袁勇军
■ 杨 露 袁勇军
(浙江万里学院生物与环境学院,浙江宁波 315100)
大弹涂鱼是分布于沿海滩涂的广温、广盐、两栖的经济鱼类,具有高蛋白、低脂肪、高维生素含量的特点,肉质鲜美,深受消费者喜爱,市场需求量大[1]。目前,江苏、广西、福建和浙江等省都开展了大弹涂鱼养殖[2]。近年来,大弹涂鱼养殖规模不断扩大,病害防治的问题日益突出[3],尤其是鱼体免疫力低下导致的体表溃烂出血、细菌感染,养殖效益不稳定[4]。
传统鱼类养殖中,常采用抗生素类药物来防治疾病、促进生长、节约营养成分,但大部分抗生素类药物会在水环境中累积,长期使用会加重水体负担,对鱼机体健康造成危害[5]。我国于2020 年1 月1 日起兽药中禁止使用除中草药外的所有促生长类药物添加剂品种,2020 年7 月1 日起饲料生产企业停止生产含有促生长类药物饲料添加剂(中草药类除外)的商品饲料。因此,寻找抗生素的替代物是渔业养殖的必然要求和发展趋势。
乳酸菌是一类能从发酵性碳水化合物中产生大量乳酸的革兰氏阳性细菌的统称,对宿主具有多种有益作用,如可增强鱼类机体免疫力[6],帮助肠道消化[7],抵御病原菌[8],改善水质[9],促进生长和繁殖[10],具有极大的抗生素替代品潜力[11]。目前,对乳酸菌的应用研究集中在猪、牛和羊等畜禽动物,在鱼类上的应用相对较少[12],许多从恒温动物分离出来的乳酸菌在水产动物消化道内存活时间短、稳定性差、对肠道菌群调控能力弱,难以发挥其真正的益生效果[13]。本研究将从大弹涂鱼肠道内分离筛选出适应性广、生物活性强、发酵能力强的乳酸菌,将乳酸菌应用于大弹涂鱼饲料发酵并研究其发酵条件,为功能性大弹涂鱼饲料的开发和应用提供理论依据,并丰富乳酸菌在水产领域的应用研究。
1 材料和方法
1.1 主要材料与试剂
1.1.1 试验用鱼
从宁波市江北区水产品批发市场购买鲜活健康的大弹涂鱼,选取体重在30~40 g/尾、鱼体表面无伤痕和寄生虫者。
1.1.2 试剂和培养基
MRS培养基和LB培养基(杭州微生物试剂有限公司)、琼脂粉(国药集团化学试剂有限公司)、PBS缓冲液(0.01 mol/L,北京索莱宝科技有限公司)、盐酸(化学纯,国药集团化学试剂有限公司)、氢氧化钠(化学纯,国药集团化学试剂有限公司)、胆盐(生物试剂,北京奥博星生物技术有限责任公司)、基础饲粮(漳州健康水族用品有限公司,原料主要包括鱼粉、南极磷虾粉、豆粕等)。
1.2 主要仪器与设备
QL-861 涡旋仪(海门市其林贝尔仪器制造有限公司),ZHWY-2112B 大容量全温度恒温培养振荡箱(金坛市盛蓝仪器制造有限公司),5810R 台式冷冻离心机(德国艾本德公司),Nikon 80i 荧光显微镜(日本尼康公司),SpectraMax M3 酶标仪(美国分子仪器公司)。
1.3 乳酸菌的分离纯化及初步鉴定
所有操作在超净台进行,保持无菌状态。先用75%的酒精对鱼体表面进行消毒,剪开肠道,用生理盐水冲洗杂质,碾碎后加入PBS 缓冲液进行均质,取上清液在8 000 r/min 下离心2 min,取沉淀用PBS 缓冲液稀释,冰箱4 ℃保存。
在50 mL三角瓶中加入20 mL MRS液体培养基,加入0.4 mL肠道分离的菌液,瓶口使用透气封口膜包裹,分别在28、32、37 ℃条件下静置培养24 h,将所得菌液培养液稀释到合适的倍数,涂布于MRS-CaCO3平板,挑取具有明显钙溶圈的菌落,重复划线三次以上,至菌落形态一致。观察分离纯化的菌落形态,进行革兰氏染色,参照凌代文《乳酸细菌分类鉴定及实验方法》[14]进行双氧水试验、氧化酶试纸试验。
1.4 优势乳酸菌的筛选
1.4.1 产酸能力测定
将经过初步鉴定的乳酸菌菌株用MRS 液体培养基扩大培养,置于37 ℃恒温摇床中培养48 h,用pH仪对发酵液进行测定。
1.4.2 抑菌能力测定
选取副溶血性弧菌和哈维氏弧菌作为指示菌,将200 μL 副溶血性弧菌和哈维氏弧菌接种于10 mL LB液体培养基中,置于28 ℃恒温震荡培养24 h,得到2×105CFU/mL 浓度的菌悬液。在MRS 固体培养基上注入0.2 mL菌悬液,用涂布器涂布均匀。在培养基表面垂直摆放牛津杯,轻轻加压,使其与培养基表面接触无空隙。在杯中加入初筛乳酸菌菌液,37 ℃静置培养24 h,观察结果。以牛津杯周围没有肉眼可见细菌生长区域为抑菌圈,用游标卡尺测量抑菌圈的直径。
1.4.3 耐胆盐能力测定
在MRS液体培养基中分别加入0.1%、0.2%、0.3%浓度的胆盐,将培养24 h 后的菌液按3.0%接种量接种,37 ℃处理3 h,以不添加胆盐的MRS 液体培养基为空白组。处理完毕后,对每组菌液进行梯度稀释,取3 个合适的稀释度,取200 µL 涂布于MRS 固体培养基,37 ℃培养24 h 后计数菌落数,记录结果,试验结束后计算乳酸菌的存活率。
存活率(%)=Y1/Y×100
式中:Y1——为处理组中乳酸菌存活菌数(个);
Y——空白对照组中乳酸菌存活菌数(个)。
1.4.4 耐酸能力测定
用1 mol/L 的HCl 将MRS 液体培养基的pH 分别调节成3.0、4.0、5.0、6.0、7.0,将菌株按3.0%的接种量接种,37 ℃处理3 h,以不调节pH 的MRS 液体培养基为空白组。处理完毕后,按1.4.3 中的方法进行平板菌落计数,计算乳酸菌的存活率。
1.4.5 发酵饲料性能的测定
将不同种类、不同配比的乳酸菌分别按3.0%添加量加入饲料底物中,放入带单向气阀的发酵袋中,控制发酵过程中水分含量为60%,发酵温度为37 ℃,发酵时间控制在3 d,发酵结束后,放入40 ℃烘箱烘干3 d,对粗蛋白、干物质回收率进行测定评分,选出最优菌种和配比。
1.4.6 优势乳酸菌的生物学鉴定
由华大基因公司进行检测。采用通用引物扩增16S rRNA,正向引物27F,反相引物1 492R。3 µL PCR产物进行1.0%的琼脂糖凝胶检测,观察条带性状。PCR 产物纯化按照磁珠纯化标准操作流程操作,利用磁珠能够吸附或者释放带电荷物质的原理,在高盐低pH 溶液吸附DNA,在低盐高pH 溶液释放DNA,从而达到分离提纯DNA 产物的目的。将纯化后的PCR 产物进行上机检测,测序结果进行NCBI-BLAST 比对以及进化树构建。
1.4.7 生长曲线测定
将试验筛选出来的优势乳酸菌株按3.0%的比例接种于MRS 液体培养基,37 ℃静置培养24 h,设3 个平行,每隔2 h 取样,测定其OD600值,记录数据,绘制生长曲线。
1.5 发酵工艺优化
参考孙中超[15]的方法,将乳酸菌发酵菌液、无菌水按比例加入基础饲粮中,放入单向气阀发酵袋中,混合均匀,排出多余空气后用封口机封口,在适宜温度下发酵相应天数,发酵结束后,放入40 ℃烘箱烘干3 d,得到发酵饲料,置于4 ℃冰箱保藏存放。
单因素试验:乳酸菌接种量(1%、2%、3%、4%)、发酵温度(17、27、37、47 ℃)、初始含水量(50%、60%、70%、80%)和发酵时间(1、3、5、7 d)对饲料粗蛋白含量的影响。
正交试验:在单因素试验的基础上,接种量(A)、发酵温度(B)、初始含水量(C)和发酵时间(D)作为影响因素,以发酵饲料粗蛋白含量为评价指标,设计L(934)正交试验,确定乳酸菌发酵饲料的最佳工艺。
1.6 饲料感官评价
对发酵饲料进行颜色、气味、质地的感官评价,参照GB/T 10220—2012《感官分析 方法学总论》、GB/T 21172—2007《感官分析 食品颜色评价的总则和检验方法》,并结合预试验制定了乳酸菌发酵饲料感官评定标准,如表1所示:

表1 乳酸菌发酵饲料感官评定标准
1.7 数据处理和分析
采用Excel 软件对数据进行分析处理,方法中除正交试验外,每个试验重复3 次,数据用“平均数±标准差”表示,用软件SPSS 19.0进行数据分析。
2 结果与分析
2.1 乳酸菌的分离纯化及初步鉴定
统计在不同温度培养条件下初筛、复筛得到的乳酸菌数,结果如表2 所示。从表2 可知,在37 ℃条件下分离筛选得到的乳酸菌更多,选用37 ℃作为本研究中乳酸菌的培养温度。
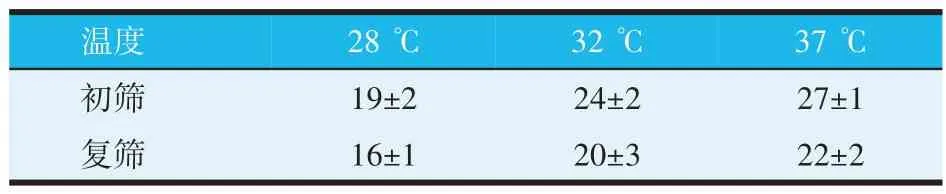
表2 不同培养温度下筛选所得乳酸菌数(个)
最终筛选出22 株菌,菌落形态呈现出不透明的乳白色圆形、表面光滑较圆、中间微隆起,同时在MRS-CaCO3固体培养基上有明显钙溶圈。22 株乳酸菌的革兰氏染色结果为阳性、3%双氧水和氧化酶试纸试验均显示阴性,符合乳酸菌的生理生化特点,初步鉴定为乳酸菌。
2.2 优势乳酸菌的筛选
2.2.1 不同菌株产酸能力
乳酸菌是一类可以代谢乳糖产生乳酸,从而降低发酵产品pH 的一类微生物。乳酸菌在饲料发酵过程中的一大作用就是产酸,保证发酵环境的低pH,从而能够有效抑制其他微生物的生长繁殖,特别是一些有害微生物。乳酸菌的产酸能力是筛选发酵乳酸菌的重要特性。
选取pH 为4.6 以下的菌株为产酸能力较好的菌株,从表3 可知,菌株Bp1、Bp9、Bp15、Bp17、Bp19、Bp20有较好的产酸能力。
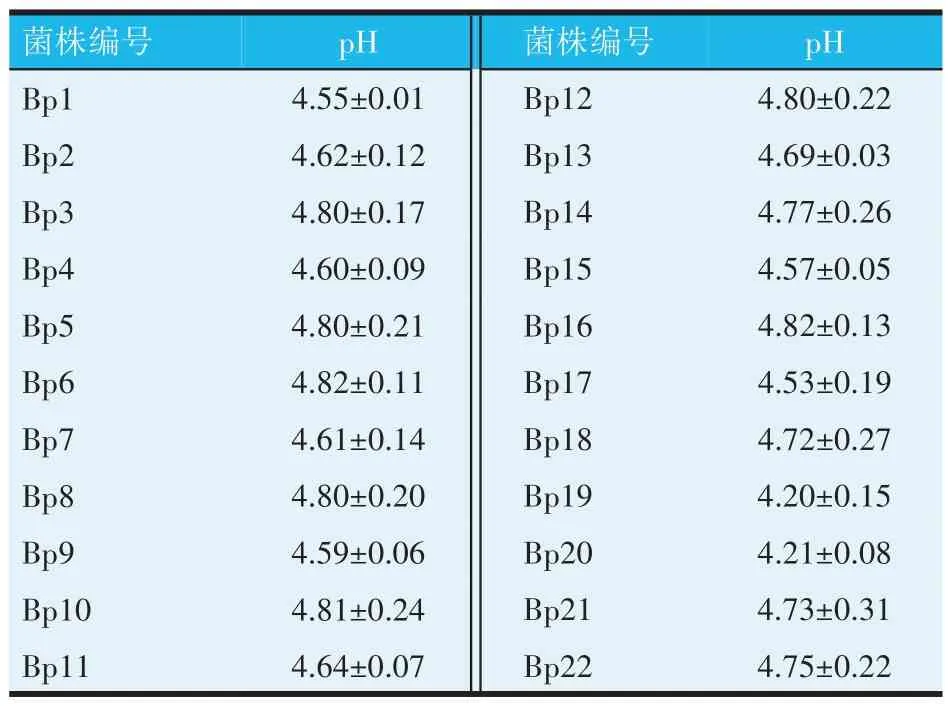
表3 22株乳酸菌产酸能力
2.2.2 不同菌株的抑菌能力
大弹涂鱼作为一种常见的海水鱼,容易遭受弧菌的侵害,通过口或伤口感染,可致使大弹涂鱼肌肉溃烂化脓以及内脏器官的严重病变,或引起败血症而导致病鱼死亡。以常见的海水鱼致病菌副溶血性弧菌和哈维氏弧菌为指示菌,比较抑菌圈的直径大小,通过图1 我们可以看出菌株Bp1、Bp17、Bp19、Bp20、Bp22 具有较好的抑菌能力,其抑菌圈直径明显大于15 mm。
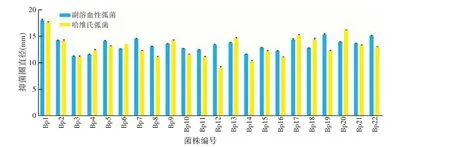
图1 22株乳酸菌对副溶血性弧菌和哈维氏弧菌的抑菌能力
综合产酸能力和抑菌能力,最终选择菌株Bp1、Bp17、Bp19、Bp20进行下一步筛选。
2.2.3 不同菌株的耐胆盐能力
乳酸菌在鱼体内发挥益生作用的前提是其可在鱼体肠道中存活并定植,而乳酸菌要到达并定植于肠道,必须对胆盐有一定的耐受性。如图2 所示4 株乳酸菌在不同浓度胆盐下的存活率,从图中可以看出,不同浓度胆盐对4 株菌的存活率均有影响,胆盐浓度越高,乳酸菌存活率越低,0.3%胆盐处理后,4 株菌的存活率均为0。菌株Bp1 和Bp20 耐胆盐能力相对较高,经过0.1%胆盐处理,存活率均在13%以上,经过0.2%胆盐处理,存活率均在5%以上。

图2 4株乳酸菌对不同浓度胆盐的耐受力
2.2.4 不同菌株耐酸性能力
饲料发酵过程中由于微生物的作用,产生大量有机酸,使得pH 逐渐降低。为了适应发酵的酸性环境,筛选出的优良菌株应具备较好的耐酸性。如图3 所示的4株乳酸菌在不同酸性条件下的存活率,在pH≥6时,4 株乳酸菌存活率均在95%以上,当pH<6 时,存活率均在25%以下,菌株Bp1 和Bp20 显示出较好的耐酸性。
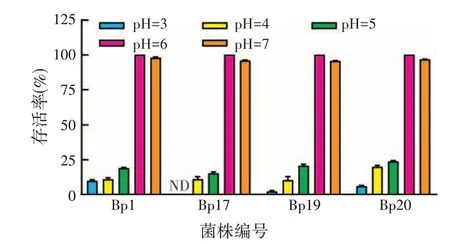
图3 4株乳酸菌对不同pH的耐受力
综合耐胆盐能力和耐酸能力,最终选择菌株Bp1和Bp20进行下一步的饲料发酵试验。
2.2.5 不同菌株发酵饲料的能力
发酵后饲料的粗蛋白、干物质回收率是判断饲料质量高低的重要指标,其中,A 组加入Bp1 乳酸菌,B组加入Bp20 乳酸菌,C 组加入(Bp1∶Bp20)1∶1 混合菌液,D 组加入2∶1 混合菌液,E 组加入1∶2 混合菌液。从图4 中可以看出,A 组加入3.0% Bp1 菌液的饲料粗蛋白含量和干物质回收率分别为34.2% 和82.9%,均高于其他4 组,B 组加入3.0% Bp20 菌液的饲料粗蛋白含量和干物质回收率分别为27.3%和76.8%,均低于其他4 组;比较C、D 两组,随着Bp1 菌液比例的增加,粗蛋白含量由31.3%变为33.2%,干物质含量由78.1%变为80.5%,结果逐渐接近A 组;比较C、E 两组,随着Bp20 菌液比例的增加,粗蛋白含量由31.3%变为29.1%,干物质含量由71.8%变为73.9%,结果逐渐接近B 组。综上,A 组饲料发酵效果更好、质量更高,仅接种菌株Bp1 更适合用于发酵大弹涂鱼饲料。

图4 5组发酵饲料的粗蛋白和干物质回收率
2.2.6 优势乳酸菌的基因鉴定结果
测得菌株Bp1琼脂糖凝胶条带长度在1 700 bp左右,符合乳酸菌的特性,同时,经过图5 进化树同源性分析,能够确定该菌为发酵黏液乳杆菌。

图5 Bp1进化树构建图
2.2.7 生长曲线测定结果
从图6 中可以看出,试验所选的优势乳酸菌初始OD600值0.3左右,在8 h后进入对数生长期,OD600值快速上升,12 h 后生长达到高峰,进入生长稳定期。在饲料发酵过程中,我们应选用对数生长期的活跃乳酸菌进行发酵,即10~13 h内的菌液。

图6 菌株Bp1的生长曲线
2.3 发酵工艺优化
通过单因素试验,得到结果如图7所示。由图7(A)所知,接种量在3%左右时,饲料粗蛋白含量最高,高达41.50%,接种量大于3%,粗蛋白含量开始减少;由图7(B)所知,随着温度的加,粗蛋白含量缓慢增加,37 ℃左右时,到达最高值37.96%,随后饲料粗蛋白含量直线下降;由图7(C)所知,随着含水量的递增,粗蛋白含量先增加后降低,饲料底物初始含水量在60%左右时,饲料粗蛋白含量最高,达到38.90%;由图7(D)所知,发酵时间在5 d左右时,饲料粗蛋白含量最高,为35.96%,随着发酵时间的持续增加,蛋白质含量下降,趋近于30%。

图7 4个单因素试验结果折线图
通过正交试验,得到结果如表4所示。从表4中可以看出,A1 的影响反映在第1、2、3 号试验中,A2 的影响反映在第4、5、6号试验中,A3的影响反映在第7、8、9号试验中。A 因素的1 水平所对应的试验指标之和为KA1=y1+y2+y3=36.83+35.92+29.14=101.89,kA1=KA1/3=33.96;A 因素的2 水平所对应的试验指标之和为KA2=y4+y5+y6=27.05+36.61+21=94.66,kA2=KA2/3=31.55;A因素的3 水平所对应的试验指标之和为KA3=y7+y8+y9=25.87+24.83+29.77=80.47,kA3=KA3/3=26.82;kA1>kA2>kA3说明A 因素对试验结果有影响,A1 为A 因素的优水平,即发酵饲料最优的菌种接种量为2.0%。

表4 试验结果分析
同理可得,发酵饲料最优的发酵温度为37 ℃、最优含水量为60%、最优发酵天数为3 d。在最优工艺条件下,进行饲料发酵验证试验,得到饲料pH 为5.6,粗蛋白含量为(37.04±0.32)%,结果指标均优于9组试验组。
2.4 饲料感官评价
根据饲料评分表,对正交试验里的9 组处理组以及最佳发酵工艺下的第10 组饲料进行评分,结果如表5 所示,1、5 组实验组的感官评分较高,印证了D 因素对发酵饲料影响最大,第7 组试验组感官评分最低,其A、D 两个因素均处于水平3,不适合用于发酵鱼饲料。在最优工艺条件下,经过发酵的鱼饲料颜色为红褐色,质地松散而不粘连,有淡淡的酸酒香味,说明通过乳酸菌的发酵提高了饲料风味和感官指标。
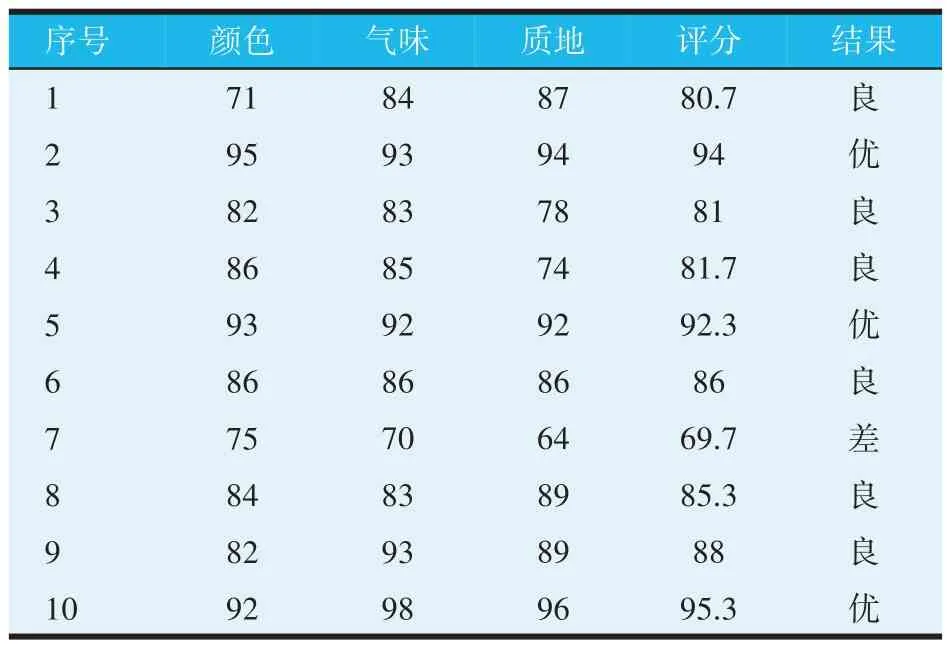
表5 乳酸菌发酵饲料感官评定结果
3 讨论
乳酸菌发酵饲料是以乳酸菌发酵为核心,将饲料原料中的抗营养因子和大分子物质进行转化和分解,产生适口性好、富含大量活性乳酸菌及其代谢产物的微生态饲料[16]。目前,乳酸菌发酵饲料分为两类:一是液态发酵饲料,是将谷物原料、维生素、矿物质等和水按比例混合发酵,加入酸化剂使pH 降至3.5 左右,防止霉菌等有害菌生长;二是固态发酵饲料,是将营养丰富的全价饲料或谷物原料部分、乳酸菌和水按比例混合发酵[17]。固态发酵饲料优点是饲料中含有多种有益菌,能提高饲料利用率[18]。本研究所筛选乳酸菌具有较好的产酸性能和发酵性能,通过固体发酵的方式,降低饲料pH,提高饲料的粗蛋白含量,能够较好减少饲料中有害菌的生长,为鱼体提供更多营养。Jiang 等[19]利用枯草芽孢杆菌和嗜酸乳杆菌混合发酵玉米蛋白粉,发现发酵后中性洗涤纤维含量显著降低,粗蛋白、氨基酸和小肽含量显著升高。Wang 等[20]使用由地衣芽孢杆菌、酵母菌和乳酸菌组合成的复合益生菌固态发酵菜籽粕,发酵后可溶性蛋白含量、乳酸含量和总氨基酸含量显著升高。上述研究结论均与本研究相似。
Silva 等[21]研究表明饲料的风味能够影响动物对饲料的选择和进食,从而影响动物的生长发育,类似地,Kondo 等[22]研究了饲料适口性对动物采食行为的影响,发现饲料的适口性是影响动物的采食量的主要因素之一。在发酵的过程中,会产生一系列芳香族化合物,从而改善饲料风味,提高适口性[23]。吴正可等[24]使用嗜酸乳杆菌、枯草芽孢杆菌和酿酒酵母菌固态发酵菜籽粕,发酵后的菜籽粕呈蓬松状,颜色为黄褐色,有浓郁的酸香味。Liu 等[25]用乳酸菌发酵液吸附和发酵稻草饲料,发酵后的稻草饲料不仅具有独特的酸香味,适口性也得到了改善。本研究中,经过发酵的鱼饲料颜色为红褐色,质地松散而不粘连,有淡淡的酸酒香味,与原饲料相比,风味更佳。
4 结论
本研究从大弹涂鱼肠道分离筛选出22 株乳酸菌,通过对产酸能力、抑菌能力、耐胆盐能力、耐酸能力、发酵饲料性能进行综合评价,得到一株发酵性能较好的乳酸菌菌株Bp1。通过16S rRNA鉴定,确定该菌为发酵粘液乳杆菌,目前在水产饲料中应用较少,具有较好的发展前景和应用潜力。通过正交试验,确定了发酵大弹涂鱼饲料的最佳工艺,菌种接种量为2.0%,发酵温度为37 ℃、含水量为60%、发酵天数为3 d,在最优工艺条件下,得到发酵饲料粗蛋白含量为(37.04±0.32)%,饲料pH 为5.6;与基础饲料相比,该发酵饲料具有更高的粗蛋白含量,可为鱼体提供更好的营养价值,pH 更低,能够抑制大部分有害病原菌,更有利于大弹涂鱼的绿色养殖。
