饲料中添加蚕豆对吉富罗非鱼肝脏组织结构、抗氧化能力、脂肪代谢及糖代谢的影响
2024-04-29韦木莲曹俊明
■ 彭 凯 符 兵,2 彭 振 李 玲 韦木莲 黄 文 曹俊明,2 陈 冰*
(1.广东省农业科学院动物科学研究所,农业农村部华南动物营养与饲料重点实验室,广东省畜禽育种与营养研究重点实验室,广东广州 510640;2.广东海洋大学,广东湛江 524088;3.茂名市农业科技推广中心,广东茂名 525000;4.佛山市农业科学研究所,广东佛山 528145)
吉富罗非鱼(tilapia,Oreochromis niloticus),具有生长快、繁殖力强、食性杂、易驯化等特点,且背宽肉厚,出肉率高,富含多种不饱和脂肪酸,是我国南方养殖主要的经济鱼种之一。研究和生产表明,蚕豆(faba bean,Vicia fabaL.)可显著提高罗非鱼肉质硬度、弹性、咀嚼性等质构特性和肌肉耐折力等物理特性,降低肌肉粗脂肪[1-3],促进淡水鱼肌肉“脆化”[4]。但未经处理或加工的蚕豆含有胰蛋白抑制剂、溶血素、蚕豆凝集素、植酸等抗营养因子[5],会在脆化过程中致使鱼体出现肿身、脂肪积蓄及变性、肝脏肿大、肝细胞膜损伤等问题[6-7],而经高温膨化后的蚕豆抗营养因子含量大大降低[8-9]。有关蚕豆对鱼类脂质代谢的影响已在草鱼上报道[6,10],但蚕豆对罗非鱼肝脏糖代谢影响鲜有报道。因此,本试验以吉富罗非鱼为研究对象,研究饲料中添加不同水平的蚕豆对吉富罗非鱼肝脏组织结构、抗氧化能力以及糖脂代谢相关指标的影响,进一步探讨蚕豆作用于罗非鱼肝脏糖脂代谢的机理,以期为蚕豆及其膨化饲料在罗非鱼脆化过程的高效养殖提供理论依据。
1 材料与方法
1.1 试验饲料
以含豆粕和菜粕的饲料作为基础饲料,在基础饲料上分别添加0(C0,对照组)、15%(C15 组)、30%(C30 组)和60%(C60 组)的蚕豆,制成4 种等氮等脂试验饲料。试验用蚕豆购于湖北合盈合作社,营养成分(干物质基础):蛋白质28.5%、脂肪0.8%、水分11.1%、灰分3.4%、淀粉43.0%、蛋氨酸0.2%、赖氨酸2.0%。饲料组成及营养水平见表1。所有饲料原料经粉碎并通过60目标准筛,混合均匀后通过T52水产饲料膨化机制成粒径为3 mm 的膨化饲料(膨化温度为110 ℃),喷油后经55 ℃烘干,置于4 ℃保存备用。
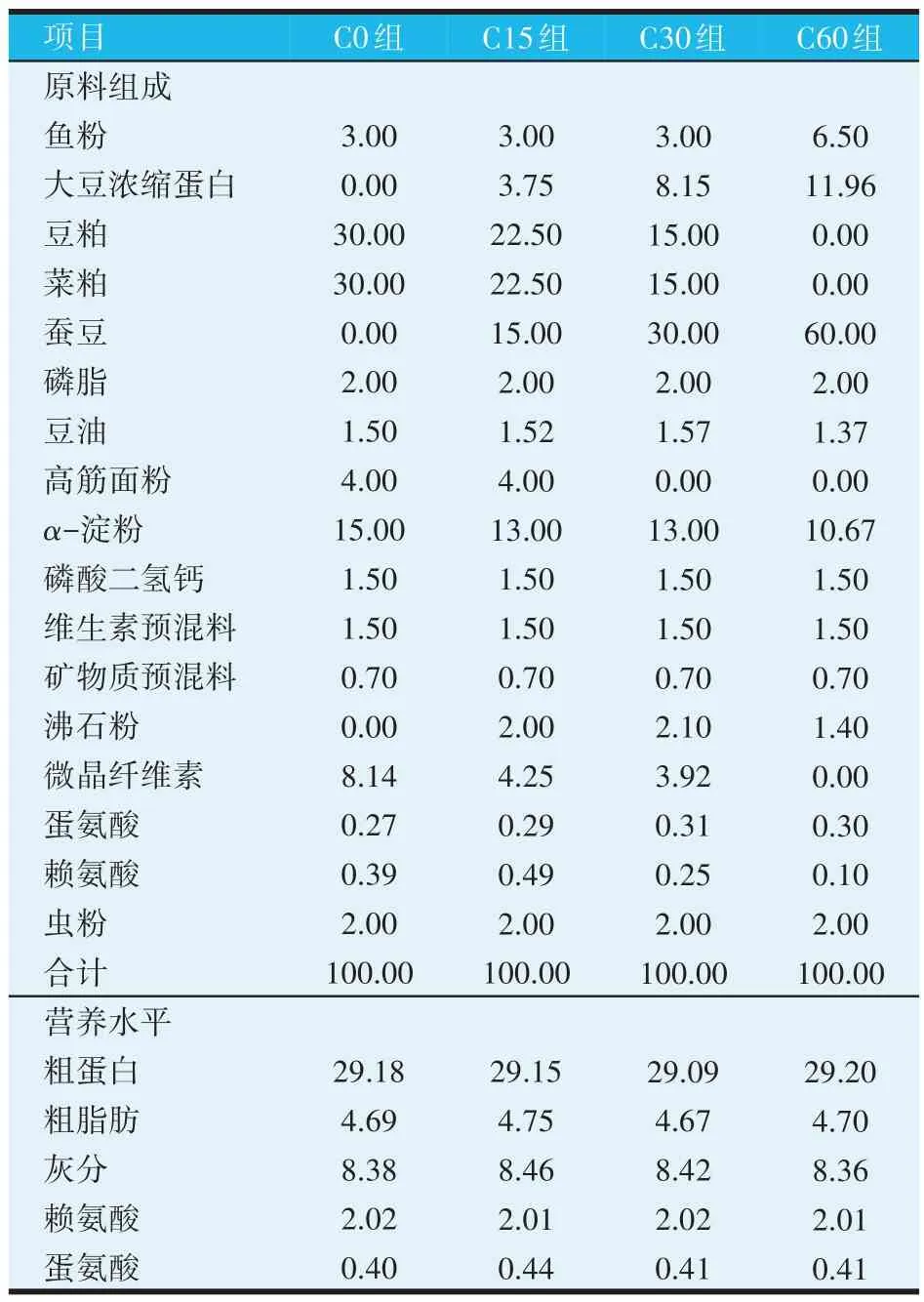
表1 试验饲料组成及营养水平(干物质基础,%)
1.2 试验用鱼及试验设计
吉富罗非鱼由广东罗非鱼良种场提供,在暂养池驯养1 周后,选取健康、活泼、初始体重为(500.23±0.34) g 的吉富罗非鱼600 尾,随机分为4 组,每组3 个重复,每个重复50 尾鱼,饲养试验在广东省农业科学院国家科技园区白云基地池塘网箱中进行,网箱规格为1.5 m×1.5 m×2 m。每天分别在08:30 和17:00 投喂1次,采用表观饱食投喂。养殖期间24 h供氧,溶氧量>6.0 mg/L,氨氮<0.05 mg/L,亚硝酸盐<0.01 mg/L,温度26~33 ℃。每天记录试验鱼死亡数量、饲料投喂量及水质情况。试验期100 d。
1.3 样本采集
每个重复取3 尾鱼,经MS-22 麻醉后,用2 mL无菌注射器从吉富罗非鱼尾静脉采血,4 ℃静置2 h,3 800 r/min离心10 min,取上清液于-80 ℃保存,用于生理生化测定。取0.5 cm×0.5 cm×0.5 cm 规格的肝脏组织固定于4%甲醛溶液,用于组织切片。取约10 g 的肝脏组织于-80 ℃保存,用于生理生化指标测定。
1.4 测定方法
1.4.1 肝脏组织切片
肝脏组织在4%多聚甲醛中固定24 h 后,按照乙醇梯度脱水、二甲苯透明组织块、包埋、切片、脱蜡、染色、分化、切片脱水复染、封片步骤制作组织切片,用光学显微镜扫描肝脏组织,观察并记录特性。
1.4.2 生理生化指标的测定
血清生化指标采用日立7600 全自动生化分析仪(株式会社日立高新技术公司)测定,指标包括血糖(GLU)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、胆固醇(CHOL)、低密度脂蛋白胆固醇(LDL-C)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)等。
肝脏样本解冻后,以生理盐水1:9体积比进行稀释,获得肝脏组织匀浆,4 ℃,2 500 r/min离心10 min,仔细收集上清液,测定丙酮酸激酶(PK,比色法)、脂蛋白脂酶(LPL,比色法)和肝脂酶(HL,比色法)活性;以提取液1:10 体积比进行稀释,获得肝脏组织匀浆,4 ℃、8 000 r/min离心10 min,仔细收集上清液,测定果糖磷酸激酶(PFK,分光光度法)、磷酸烯醇式丙酮酸羧激酶(PEPCK,分光光度法)和己糖激酶(HK,分光光度法)活性,具体操作方法及计算方法参照南京建成生物工程研究所有限公司试剂盒说明书;以磷酸盐缓冲液(PBS)1:9 体积比进行稀释,获得肝脏组织匀浆,4 ℃、2 800 r/min 离心20 min,仔细收集上清液,测定脂肪酸合成酶(FAS,干粉法),具体操作方法及计算方法参照南京建成生物工程研究所有限公司Elisa试剂盒说明书。
血清和肝脏过氧化氢酶(CAT,钼酸铵法)和丙二醛(MDA,硫代巴比妥酸法)活性的测定采用南京建成生物工程研究所有限公司试剂盒。
1.5 数据处理
采用SPSS 21 统计软件中单因素方差分析(oneway ANOVA)和Duncan’s 均值多重比较法对试验结果的差异显著性进行分析处理。先对数据进行方差齐性检验,若不满足方差齐性,则采用dunnett-t3检验法进行多重比较。试验结果用“平均值±标准误(Mean±SE)”表示,显著性水平为0.05。
2 结果与分析
2.1 饲料中添加蚕豆对吉富罗非鱼肝脏组织结构的影响
由图1 可知,对照组肝细胞排列紧密,未见明显色素巨噬细胞中心,胰腺细胞形态正常,肝细胞未见肿胀。C15 组和C30 组肝细胞排列紧密,少量肝细胞胞浆疏松或呈空泡状(红色箭头),胰腺细胞形态正常,肝胰脏内可见少量色素巨噬细胞中心(黑色箭头)。C60 组肝细胞排列紧密,少量肝细胞胞浆疏松或呈空泡状(红色箭头),胰腺细胞形态正常,肝胰脏内可见多处色素巨噬细胞中心(黑色箭头)。
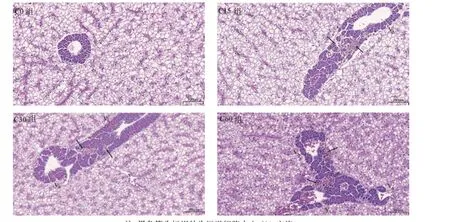
图1 饲料中添加蚕豆对吉富罗非鱼肝脏组织结构的影响(H.E.染色,200×)
2.2 饲料中添加蚕豆对吉富罗非鱼血清糖代谢和脂肪代谢相关指标的影响
由表2可知,与C0组相比,C30组和C60组GLU含量显著降低(P<0.05),C60 组TG 含量显著降低(P<0.05),HDL-C 含量显著升高(P<0.05)。C15、C30组和C60组AST和MDA含量显著高于C0组(P<0.05)。各组间ALT、CHOL 和LDL-C 含量无显著差异(P>0.05)。C15、C30组和C60组CAT含量显著低于C0组(P<0.05)。
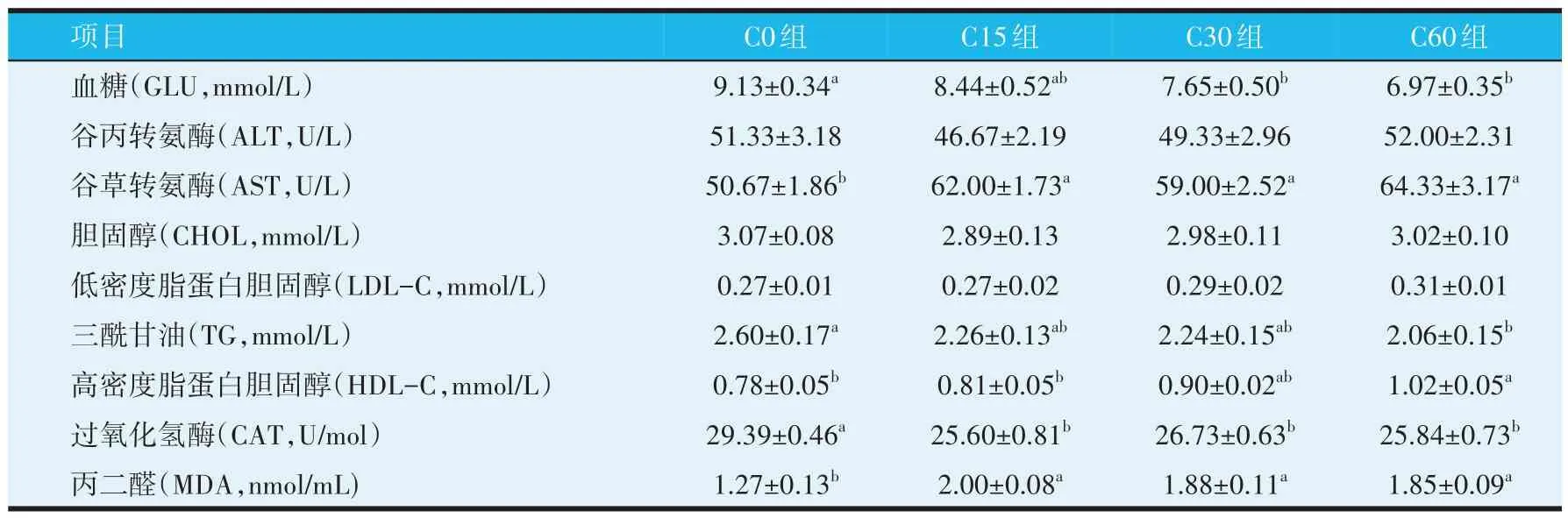
表2 饲料中添加蚕豆对吉富罗非鱼血清生化指标的影响
2.3 饲料中添加蚕豆对罗非鱼肝脏糖代谢和脂类代谢相关指标的影响
2.3.1 饲料中添加蚕豆对罗非鱼肝脏糖代谢关键酶活性的影响
由表3 可知,与C0 组相比,C15、C30 组和C60 组PK 和HK 活性显著升高(P<0.05),C15、C30 组和C60组PEPCK 活性显著降低(P<0.05)。各组间PFK 活性无显著差异(P>0.05)。
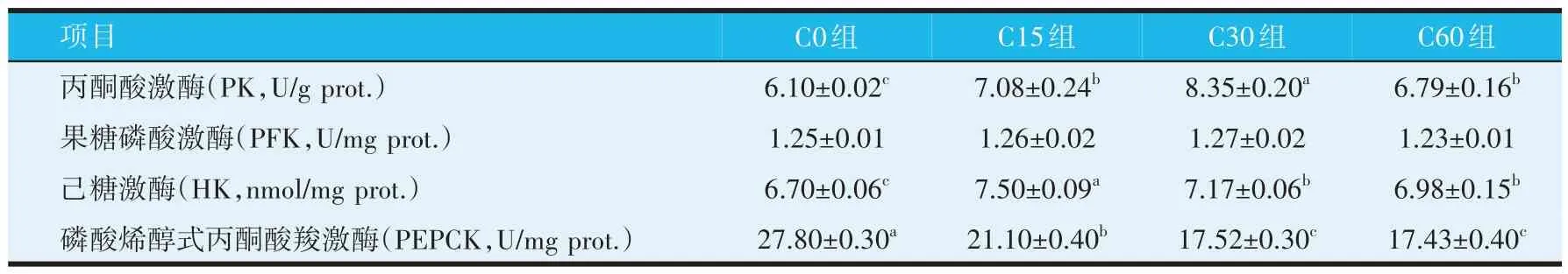
表3 饲料中添加蚕豆对罗非鱼肝脏糖代谢关键酶活性的影响
2.3.2 饲料中添加蚕豆对罗非鱼肝脏脂代谢相关指标的影响
由表4 可知,与C0 组相比,C60 组脂肪酸合成酶和过氧化氢酶活性显著降低(P<0.05)。各组间丙二醛含量、脂蛋白脂酶和肝脂酶活性无显著差异(P>0.05)。
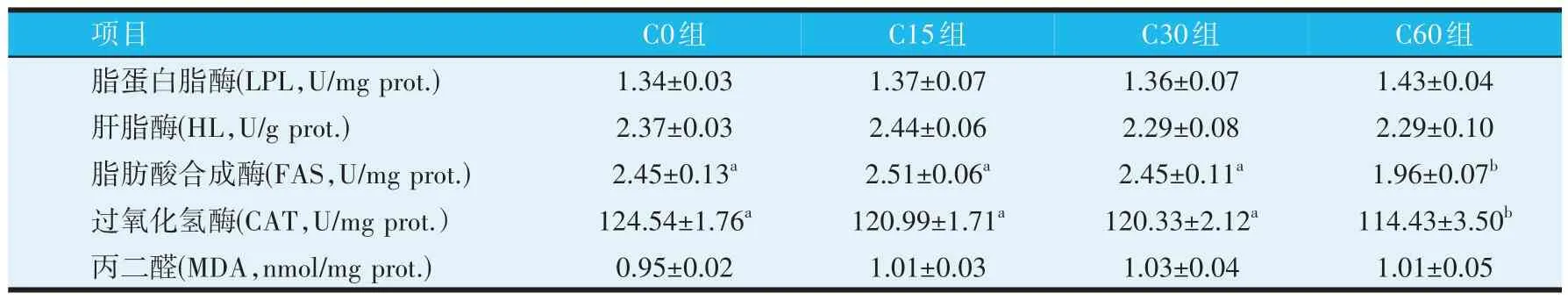
表4 饲料中添加蚕豆对罗非鱼肝脏脂肪代谢相关指标的影响
3 讨论
3.1 投喂蚕豆对吉富罗非鱼肝脏组织结构的影响
当肝脏吸收和利用的能量不均衡时,TG 会在肝脏内蓄积,形成脂肪肝。有研究报道,变性后的肝脏外观肿大发黄,具有油腻感[6,11],可通过透射电镜、油红O 染色和H.E.染色等技术观察到蚕豆组草鱼肝细胞明显肿胀,细胞内出现明显自噬小体、脂滴和空泡。本试验肝脏H.E.染色结果与上述研究结果类似,各蚕豆组肝细胞均出现空泡和巨噬细胞中心。当肝脏发生损伤后,肝脏中固有的枯否细胞在大量增殖的同时,也会募集循环中的单核细胞衍生为巨噬细胞[12]。巨噬细胞中心的形成表明蚕豆诱导肝脏出现了炎症反应,并伴随着一氧化氮(NO)和活性氧(ROS)等细胞毒性介质的产生[13]。此外,有研究发现,空泡可能是细胞器结构损坏和失去糖原物质的肝细胞、脂滴或是正在溶解的脂滴构成[14]。蛋白质组学研究显示,大量与脂肪代谢相关的蛋白质和酶在脂滴上表达,说明细胞内脂滴在调节细胞内脂肪代谢和平衡起重要作用[5],空泡的形成可能意味着肝脏脂肪代谢发生了紊乱。
3.2 投喂蚕豆对吉富罗非鱼糖代谢的影响
在糖代谢中,糖酵解和糖异生两者相互作用,维持着血糖内稳态。调节鱼类糖酵解的关键酶为HK、PFK、PK、葡萄糖激酶(GK)等,调节糖异生的关键酶为PEPCK 、葡萄糖-6-磷酸酶(G-6-Pase)等[15]。
鱼类对糖的吸收、代谢能力较差,糖的摄入量会直接影响着鱼体内糖原的合成及肝功能。而罗非鱼属杂食性,对糖的耐受力较高[16-17]。有研究认为,糖水平在31%~37%时,能诱导草鱼HK、GK 和PK 等活性的提高[15]。吴宏玉[18]发现,罗非鱼肝脏PFK 活性在摄入20%~40%的淀粉后无显著变化。陈俊行[19]的研究也表明,淀粉水平在33.8%时,罗非鱼肝脏糖酵解pfkma和gck基因相对表达量与对照组差异不显著。本试验发现,C15(23.5%淀粉水平)、C30 组(25.9%淀粉水平)和C60 组(36.5%淀粉水平)肝脏HK 和PK 活性均高于对照组,血清GLU 含量均低于对照组,说明饲料中添加15%、30%和60%蚕豆均可促进罗非鱼肝脏糖酵解途径。一方面可能归因于蚕豆虽经高温膨化处理,但仍存在较高浓度的多酚类物质,下调了肝脏中葡萄糖分解利用相关基因的表达以及糖酵解通路相关酶的活性[20-21]。另一方面也可能是各蚕豆组不同数量巨噬细胞的形成,消耗了葡萄糖,导致C30组和C60组GLU 含量显著降低。研究发现,促炎性巨噬细胞的形成需要以葡萄糖为底物进行糖酵解,并会产生NO 和ROS 等细胞毒性介质[22-23],这也与各蚕豆添加组抗氧化能力的降低和MDA 的升高相符。本试验中,糖异生关键酶PEPCK 活性随蚕豆添加水平的升高而降低,这与李建[24]、梅玲玉等[25]在斜带石斑鱼(Epinephelus coioides)、异育银鲫(Carassius auratus gibelio)上的结果类似,蚕豆可能抑制罗非鱼肝脏的糖异生途径。
3.3 投喂蚕豆对吉富罗非鱼脂肪代谢的影响
肝脏作为蛋白质、脂质和碳水化合物代谢与储存的主要场所,在维持代谢稳态中起着重要作用。研究表明,HDL-C 能将动脉中的CHOL 转至肝脏,并降低LDL-C 的氧化作用[11]。本试验发现,在等脂的情况下,各蚕豆组血清中HDL-C 活性均高于对照组,TG含量均低于对照组且在C60 组显著降低。说明经膨化处理的蚕豆会诱导加速吉富罗非鱼血脂代谢,加快TG 的分解,这可能是蚕豆中的热稳性活性物质激活了脂肪酸的β-氧化通路,也可能是C60 组FAS 活性显著降低所致。FAS 是脂肪酸合成的主要调节酶,能够催化乙酰辅酶A 和丙二酰辅酶A 生成长链脂肪酸[26]。
本试验结果表明,饲喂蚕豆会降低罗非鱼肝脏和血清中CAT 活性。这与陈度煌[7]、靳雅琦等[27]的研究结果一致。CAT 在血红素的催化下可将H2O2高效地转化为水和氧气,并清除超氧自由基[28]。血清中AST和ALT 活性可作为评价肝脏功能和肝脏受损的重要指标,其活性的升高标志着肝细胞膜受到破坏,肝功能损伤[29-30]。本试验中各蚕豆组AST 活性的升高意味着添加蚕豆诱导肝脏发生了氧化应激,造成了氧化损伤。MDA含量能直接反映组织过氧化水平[31],添加蚕豆各组血清和肝脏中MDA 含量的升高以及巨噬细胞中心的形成正好进一步验证了这一点。
4 结论
饲料中添加30%和60%的蚕豆显著提高了吉富罗非鱼肝脏的糖酵解能力,添加60%的蚕豆显著降低了吉富罗非鱼肝脏的脂肪代谢能力、血清和肝脏的抗氧化能力,添加15%、30%和60%的蚕豆均会损伤吉富罗非鱼的肝脏组织结构。
