利用一碳资源生产单细胞蛋白在饲料中的应用研究进展
2024-04-29辛嘉英张卫丹徐景懿夏春谷
■ 贺 姣 辛嘉英,* 张卫丹 徐景懿 夏春谷
(1.哈尔滨商业大学食品科学与工程重点实验室,哈尔滨商业大学,黑龙江哈尔滨 150076;2.中国科学院兰州物理化学研究所羰基合成与选择氧化国家重点实验室,甘肃兰州 730000)
近年来,受到人口快速增长的影响,预计到2056年,人口将达到100 亿,全球粮食需求将增长50%~80%,其中人们对蛋白质的需求量逐渐增加,而海产品是人们获取蛋白质的主要来源。水产养殖过程中对饲料中蛋白质含量要求较高,从而导致蛋白饲料资源短缺[1]。目前动物饲料中蛋白质来源主要是鱼粉和豆粕,虽然鱼粉营养价值高且易消化吸收,但生产成本高,长期广泛使用将导致蛋白饲料供应不足[2]。与此同时,在过去20 年中,全球大气中CO2和CH4的总浓度分别增加了12.07%和5.90%,因此,需要开发新型的蛋白质生产方法,既可以保障蛋白质安全供应又可以为温室气体减排做出贡献[3]。
CH4和其他一碳化合物[CO2、CO、甲醇(CH3OH)和甲酸盐]被认为是不影响粮食安全的下一代微生物碳原料的可持续候选者[4],可以作为藻类、酵母、真菌和细菌等微生物生长过程中利用的底物生产单细胞蛋白(Single cell protein,SCP)。SCP 不仅蛋白质含量高,而且含有糖类、脂肪、维生素、矿物质以及重要氨基酸,具有很高的营养价值[4]。由一碳化合物生物合成的SCP 与传统的饲料原料(如豆粕)相比,具有显著的碳中和效益,能高质量的替代蛋白质,且土地使用和水消耗少。由于其具有丰富的营养,高消化率和氨基酸平衡性好而被主要应用于动物饲料,特别是在水产饲料中应用居多,因为其营养成分和鱼粉相似,在未来可以成为鱼粉的替代品。但受成本经济的限制,目前还没有实现大规模生产,通过利用合成生物学和基因工程手段改良微生物性状,进一步强化底物利用效率,有助于实现SCP 工业化生产。乙醇梭菌蛋白(Clostridium autoethanogenum protein,CAP)实现首次大规模生产并被我国农业农村部批准成为新型饲料蛋白源,并在水产饲料中投入使用[3]。
文章介绍了某些微生物利用一碳资源发酵生产SCP 的研究进展,包括一碳资源的生物代谢途径、各种菌体SCP 的生产及在饲料中的应用,最后分析SCP商业化生产面临的挑战及未来可能解决的途径,进一步为提升SCP的应用价值提供支持。
1 一碳气体及微生物利用原理
1.1 一碳资源
随着世界人口的持续增加,同时人们对食物消费模式的改变,对高质量和营养丰富的食品的需求不断增长,尤其对蛋白质的需求正在增加,然而,依靠动物和乳制品生产来满足日益增长的蛋白质需求最终是不可持续的[5-6]。虽然近年来畜牧业不断扩大生产来满足人们对肉类蛋白的需求,但在生产过程中会排放温室气体,给当下“双碳”任务带来巨大挑战。而植物蛋白生产不仅效率低下,而且会产生大量废物,消耗土地和水资源,而且耗能高[7-8]。因此,现在越来越多的方法和技术在不断被挖掘,特别是一碳资源的利用受到越来越多人的关注。一碳资源主要包括CH3OH、CH4、CO2和CO 等。CH3OH 是一种关键的溶剂和生物燃料产品,通过CH4的氧化和CO2的还原进行生物生产,因其具有易储存和易运输等特性,成为极具应用潜力的原料,目前全球90%以上的CH3OH 来源于天然气制备[9]。热力学上,CH4可以在室温条件下自发地氧化形成CH3OH。CH4是一种无味、无色、可燃的气体,来源广泛,天然气是CH4最主要的来源,传统上主要用于供热、发电或作为运输燃料,其温室效应是CO2的26 倍[10]。大气中CO2浓度日益增高导致的全球气候变暖,也急需寻求CO2控制、捕获以及利用方式。相比于控制CO2排放与捕获,CO2转化与利用既能降低温室效应,又能缓解由于化石燃料枯竭导致的资源危机。这些气体直接排放或燃烧不但会污染环境还会造成资源浪费,因此,通过工业生物技术将这些气体转化为饲料蛋白质和其他产品是首选的技术手段。
1.2 一碳资源的生物转化途径
近年来,利用微生物将CH4和CO2作为底物转化为增值产品越来越吸引人们的注意力,如聚β-羟基丁酸酯(PHB)、SCP、细胞外多糖、脂质等,其中SCP的生产在当前蛋白紧缺和环境污染问题中发挥重要作用[11]。
1.2.1 CH4的氧化和同化途径
CH4是最简单的碳氢化合物之一,也是由各种自然和人为来源产生的温室气体[12],对全球变暖有重大贡献。开发将CH4转化为高附加值产品的方法日益成为CH4资源利用的重要研究方向。甲烷氧化菌(Methane oxidizing bacteria,MOB)是甲烷营养菌的一个分支,是革兰氏阴性细菌,以CH4或CH3OH作为唯一的碳源和能源进行生长[13]。MOB是一种系统发育多样的甲烷营养菌,根据DNA量、细胞膜组成和碳同化的代谢途径,主要分为Ⅰ型和Ⅱ型,分别隶属于γ-变形菌和α-变形菌[14-15]。MOB的一个典型特征是具有甲烷单加氧酶(Methane monooxygenase,MMO)[16]。MMO 启动CH4氧化过程,并以两种主要形式存在。颗粒性甲烷单加氧酶(Particulate methane monooxygenase,pMMO)是一种铜依赖性酶,具有高CH4亲和力,但周转率较慢[17],在MOB中几乎无处不在。可溶性甲烷单加氧酶(sMMO)在其活性中心使用铁,并且仅在一些MOB中发现。
在MMO 催化下MOB 将CH4氧化为CH3OH,在甲醇脱氢酶(Methanol dehydrogenase,MDH)的作用下以及周质吡咯喹啉醌(Pyrroloquinoline quineone,PQQ)作为辅因子进一步转化为甲醛(HCHO),而HCHO 是一种有毒的中间体,在Ⅰ型MOB 中HCHO 进入单磷酸核酮糖途径(RuMP)进行同化[18];存在四氢叶酸(H4F)和四氢甲烷蝶呤(H4MPT)介导的HCHO 向甲酸(HCOOH)的 转 化[19]。在H4F 介 导 的HCHO 生 成HCOOH 的途径中,预计HCHO 会与H4F 自发缩合形成亚甲基H4F,然后亚甲基H4F 进一步氧化为HCOOH。在H4MPT 介导的途径中,HCHO 与蝶呤缩合,然后经过一系列反应生成HCOOH(见图1)。Ⅱ型MOB 利用HCOOH 进入丝氨酸循环。HCOOH 在甲酸脱氢酶(Formate dehydrogenase,FDH)的催化下氧化为CO2进一步进入卡尔文循环(CBB)。
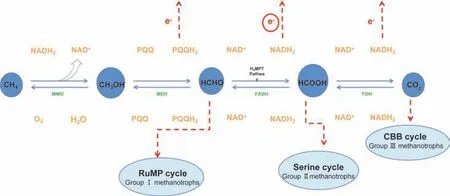
图1 甲烷的代谢途径
1.2.2 CH3OH的代谢途径
最近,CH3OH 作为替代煤炭和石油的替代碳源受到了广泛关注。在工业上,CH3OH 是由“合成气”(CO 和H2)或大气中CO2与H2的还原转化制备的。由于CH3OH 是一种廉价的非食品基质,它已成为生物技术和化学工艺的一种很有前途的原料。在自然环境中,CH3OH 是通过MOB 对CH4的氧化以及分别含有甲酯和甲氧基的植物果胶和木质素的分解产生的[20]。
CH3OH 在甲基营养酵母中的代谢概述如图2 所示。CH3OH 首先被醇氧化酶(Alkyl oxidase,AOD)氧化,形成HCHO 和过氧化氢,这两种物质都是剧毒化合物。HCHO 是一种中心中间体,位于同化和异化途径之间的分支点[21]。一部分HCHO 通过二羟基丙酮合酶(Dihydroxyacetone synthase,DAS)固定在5-磷酸木酮糖(Xu5P)上,形成二羟基丙酮(Dihydroxyacetone,DHA)和3-磷酸甘油醛(3-Phosphoglyceraldehyde,G3P),用于合成细胞成分和再生Xu5P。AOD 和DAS与分解过氧化氢的过氧化氢酶(Catalase,CTA)一起位于过氧化物酶体中。DHA 和G3P 在胞质溶胶中被进一步同化。DHA 被二羟基丙酮激酶(Dihydroxyacetone kinase,DHAK)磷酸化,随后,磷酸二羟基丙酮(Dihydroxyacetone phosphate,DHAP)和G3P形成1,6-二磷酸果糖(1,6-Bisphosphate fructose,FBP),然后用于Xu5P 的再生和细胞成分的生物合成。另一部分HCHO通过胞质异化途径进一步氧化为CO2。
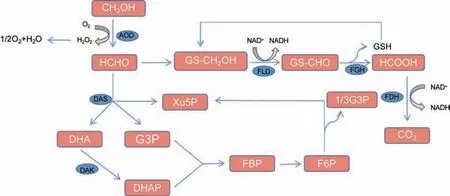
图2 甲醇的生物转化途径
1.2.3 HCHO、HCOOH的代谢途径
HCHO 通过不同的途径被吸收到细胞生物量中。Ⅰ型甲烷营养菌是γ-变形菌,它们通过RuMP 和部分丝氨酸循环吸收HCHO(图3a)。RuMP 有三个部分:融合、切割和重排。在聚合步骤中,HCHO 通过磷酸己糖合成酶(Hexose phosphate synthetase, HPS)与5-磷酸核酮糖(Ribulose 5-phosphate, R5P)缩合为6-磷酸己酮糖(6-Phosphohexanone, H6P)。所得产物随后通过磷酸己糖异构酶(Hexose phosphoisomerase, PHI)转化为6-磷酸果糖(Fructose 6-phosphate, F6P)[22]。F6P 转化为FBP,FBP 裂解为DHAP,然后通过果糖二磷酸醛缩酶转化为G3P。RuMP 循环最后一步是R5P通过几个可能的系列反应再生以闭合循环[23]。
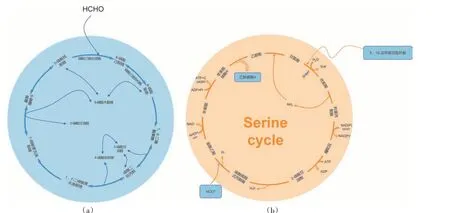
图3 基于甲醛参与的代谢途径
Ⅱ型甲烷营养菌是α-变形菌,它们可以通过乙醛酸分流偶联的丝氨酸循环吸收HCHO(图3b)。HCOOH 经多步催化反应生成活性中间体5,10-亚甲基四氢叶酸(5,10-methylene-THF)在第一步通过丝氨酸羟甲基转移酶(Serine hydroxymethyltransferase,SHMT)与甘氨酸缩合形成丝氨酸,甘氨酸在随后的丝氨酸循环中再生。丝氨酸通过丝氨酸-乙醛酸氨基转移酶(Serine-glyoxylate aminotransferase, SGAT)与乙醛酸的转氨基作用转化为羟基丙酮酸[24]。羟基丙酮酸通过羟基丙酮酸还原酶还原为甘油酸,然后通过甘油酸2-激酶转化为2-磷酸甘油酸。2-磷酸甘油酸通过烯醇化酶转化为磷酸烯醇式丙酮酸(Phosphoenolpyruvate, PEP),磷酸烯醇丙酮酸羧化酶催化草酰乙酸的合成。将草酰乙酸转化为苹果酸,随后通过苹果酸脱氢酶和苹果酸激酶分别用于形成苹果酰辅酶A,苹果酰辅酶A 裂解酶将苹果酰辅酶A 裂解为乙酰辅酶A 和乙醛酸[19]。在最后一步中,甘氨酸通过SGAT从乙醛酸中再生,甘氨酸在丝氨酸循环中是与5,10-methylene-THF缩合的主要受体。
多种原核生物和真核生物可以利用一碳化合物进行生长,原核生物甲基营养体可以利用多种一碳化合物,而真核生物甲基营养体只能使用CH3OH 作为碳源[20]。天然甲酸盐同化途径开始于将甲酸盐与四氢叶酸(Tetrahydrofolate,THF)缩合以产生10-甲酰基四氢叶酸(10-Formy-THF),然后还原为5,10-methylene-THF[25]。在之前的研究中,我们提出了几种合成途径,可以将5,10-methylene-THF 转化为中心代谢中间体,从而在模式微生物中维持甲酸盐的生长[25-27]。其中两种有前景的途径是还原甘氨酸途径和丝氨酸-苏氨酸循环(图4)。还原性甘氨酸途径是短的、线性的,与中枢代谢的重叠有限。在该途径中,可逆的甘氨酸切割系统将5,10-methylene-THF 与CO2和NH3缩合以产生甘氨酸,甘氨酸与另外的5,10-methylene-THF 进一步缩合以产生丝氨酸。丝氨酸被脱氨基为丙酮酸盐,丙酮酸盐可以维持生物量的生产。另一方面,丝氨酸-苏氨酸循环较长,呈环状,与内源性代谢显著重叠。在这个循环中,甘氨酸与5,10-methylene-THF 缩合产生丝氨酸,丝氨酸脱氨基为丙酮酸盐,然后羧化为草酰乙酸盐,并进一步代谢为苏氨酸。苏氨酸被切割以再生甘氨酸,同时产生乙酰辅酶A作为生物质前体[28]。
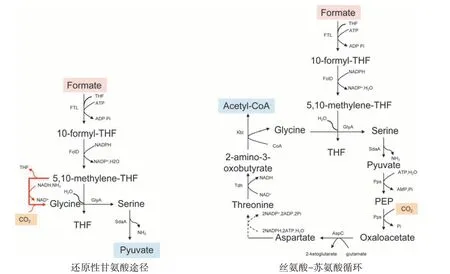
图4 基于甲酸参与的代谢途径
1.2.4 CO2的固定途径
大气中的CO2浓度在过去50年中急剧增加,大自然进化出了多种复杂的二氧化碳固定途径[29]。到目前为止,CO2可以通过三种途径固定为有机碳:自养、异养和混合营养代谢。自养代谢可以进一步细分为两种途径:光自养和化学自养。光自养代谢利用光作为能源,通过光合作用将无机CO2转化为碳水化合物。在光合作用的第一阶段,能量储存和运输分子ATP 和NADPH 是通过光依赖反应形成的,然后使用ATP 和NADPH 通过不依赖光的反应将CO2固定到葡萄糖中。这是由核酮糖-1,5-二磷酸羧化酶/加氧酶(Ribitulose-1,5-bisphosphate carboxylase/oxygenase,RuBisCO)催化的,作为CBB 循环的一部分(见图5)。CBB 循环(又称还原性磷酸戊糖循环)由不可逆的RuBisCO 催化反应组成,其中一分子1,5 二磷酸核酮糖(1,5 Ribose bisphosphate,RuBP)、CO2和水产生两分子3-磷酸甘油酸(3-Phosphoglycerate,PGA)。RuBisCO利用了光合作用产生的能量通过光呼吸催化RuBP的竞争性氧化[30]。
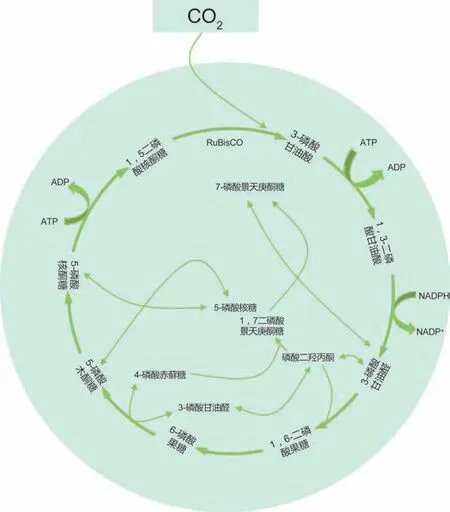
图5 还原性磷酸戊糖循环途径
1.2.5 CO的同化途径
CO 是大气中除CO2外含量最高的空气污染物,大量的CO 来源于自然和人类活动中的排放,由于工业废气和合成气被认为是最廉价和最灵活的CO 来源之一,多年来,使用这些气体生产化学品和生物燃料的生物CO 转化已被广泛研究。乙醇梭菌通过Wood-Ljungdahl 途径利用炼钢废气中的CO 为碳源,氨为氮源,经发酵将CO 转化为乙醇的过程中会同时产生G3P[31]。
2 微生物利用一碳资源生产SCP
2.1 MOB利用CH4生产SCP
MOB 是以甲烷或甲醇作为唯一的碳源和能源进行生长,MOB 可以使用包括废气在内的多种原料生产SCP。经研究表明,连续培养是目前高产SCP 的培养方式,在生产过程中需要考虑温度、pH 以及培养基的组成,此外,抗微生物化合物的存在也应该考虑,因为它们可以抑制它们的生长,从而抑制蛋白质的产生。如果基质中含有大量具有类似抗菌效果的化合物,则在使用前有必要进行预处理。据报道,高压灭菌是实现这一目标的一种简单方法,但根据具体化合物的不同而有所不同[32]。MOB培养液经离心、干燥和成型等单元操作后得到产品(如图6 所示)。值得注意的是一旦微生物达到足够的生物量,就必须分离SCP。这些分离过程包括各种提取和纯化步骤,这些步骤可能会增加时间、能源使用和生产成本,并可能降低可持续性。一旦SCP 被分离出来,就可以将其转化为成分,这一步骤的复杂性和成本取决于所需的纯度或应用。为了从生物质中获得蛋白质,有必要浓缩生产生物,并通过脱水干燥去除其中含有蛋白质的水性介质。蛋白质分离也可以根据其分散性、密度或大小进行。这些工艺是必要的,但可能成本高昂,从而增加了所获得产品的最终成本[33]。
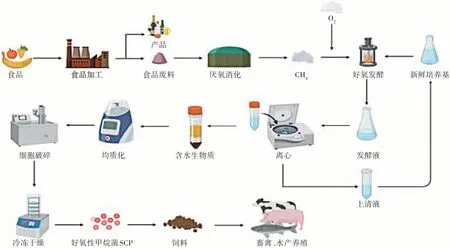
图6 甲烷氧化菌SCP生产工艺流程
2.2 甲醇酵母SCP的生产
20 世纪70 年代初,人们对使用CH3OH 作为碳源生产SCP 进行了深入研究,建立了一种高细胞密度培养方法。甲醇酵母是重要的甲基营养酵母,将CH3OH作为碳源进行培养,培养一个周期以后经离心、脱水干燥即可得到SCP[4]。酵母SCP 与传统蛋白质来源如植物或动物获得的蛋白质相比较具有更高含量的蛋白质,甲醇酵母的蛋白质质量通常与肉类和大豆的蛋白质相似或更高,并且高于牛奶蛋白质。甲醇酵母蛋白生物量具有良好的氨基酸平衡和丰富的B 族维生素,比植物性饲料更适合饲养家禽。经济分析表明从CH3OH 大规模生产SCP 在经济上不可行,去除核酸等工序增加了生产成本[34]。
2.3 微藻利用CO2生产SCP
藻类是一大类具有较强生存能力的物种。它可以生活在各种栖息地,包括极端沙漠、冻土和火山水,藻类根据大小可分为大型藻类和微型藻类。微藻是自然界中光合效率最高的一类生物。其光合效率可以达到10%~20%,远高于大多数陆地植物[35]。利用微藻生产SCP 一般是微藻培养液进行离心收集细胞,将收集到的细胞进行细胞破碎得到细胞裂解物,之后进行脱水干燥即可得到微藻SCP[4]。微藻蛋白质含量和氨基酸图谱在很大程度上取决于物种和生产条件。
据报道,微藻生物量的粗蛋白含量在30%~80%之间变化。当谈到营养价值时,微藻的氨基酸图谱与世界卫生组织/粮农组织定义的一种平衡良好的蛋白质的参考图谱相匹配[36]。尽管微藻生物量具有高蛋白质含量和良好的氨基酸组成,但作为SCP 的直接使用受到其消化率的限制。具有坚硬的纤维素细胞壁的消化能力相对较差,因此,需要寻找有效的生物质预处理步骤,为微藻生物质作为食品和饲料蛋白质来源的应用铺平道路。 与此同时,微藻的风味通常被描述为鱼腥味,微藻引起的强烈的颜色和风味是限制微藻生物质在食品领域应用的主要挑战之一。喷雾干燥微胶囊化是一种新兴的掩盖微藻不良风味的方法[37]。从经济方面来考虑会增加生产成本,大规模应用目前受到成本的限制。
2.4 CAP的生产
乙醇梭菌最早是在1994 年比利时科学家从兔子肠道里分离出来,可以利用CO 产生乙醇的厌氧菌。起初人们都只关注气体生物发酵合成乙醇,而忽视了乙醇分离蒸馏过程中还有一种“麻烦的黏稠的物质”,经饲料所检测发现这种黏稠物质主要是蛋白质[38]。CAP 是以工业尾气中的CO 为碳源,氨为氮源,经细菌发酵生产的一种新型微生物蛋白。在含氨水的新鲜培养基中进行厌氧发酵,蒸馏去除乙醇得到乙醇梭菌发酵液,调节pH 和温度进行离心得到菌体蛋白,进一步进行脱水干燥得到CAP[4]。饲料所研究团队为了进一步了解这种蛋白的功能特性、营养价值、加工适宜性等做了系统研究[39]。研究发现CAP 的蛋白质含量高达85%,含有大量必需氨基酸和维生素,18 种氨基酸占蛋白质比例达到94%,为单纯蛋白质,与FM 的氨基酸结构相似。中国农科院饲料所与北京首朗生物技术有限公司经多年联合攻关[40],提高了反应速度(22 s 合成),实现了万吨级的生产,实现了饲料原料新产品从中试向大规模生产的产业化之路,饲料所也在“不经意间”推动了CAP 从未知菌体到饲料产业的广泛应用。此外,CAP 的生产将减少工业废气的排放和空气污染[31]。
3 应用
SCP 营养价值高,易消化吸收,所含氨基酸种类繁多[41]。氨基酸谱是评估SCP 营养的重要性指标。特别是必需氨基酸组成,必需氨基酸是在人类和动物体内不能产生,需从食物中获得。包括苏氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸、组氨酸、赖氨酸和精氨酸,每一种氨基酸在生长、受损组织的修复和免疫系统的正常运行中都起着重要作用。近年来,提高动物饲料中赖氨酸的比例已经成为许多研究人员关注的焦点,在动物饲料中充分添加赖氨酸可以改善血液凝集,增强免疫力[42]。多种研究表明,来源于几种微生物的SCP 由必需氨基酸和非必需氨基酸组成[43],见表1。

表1 利用一碳资源产SCP产品与FM氨基酸的比较[10](%)
3.1 甲烷氧化菌SCP在饲料中的应用
甲烷氧化菌SCP 具有较高的蛋白质完整性,并且具有显著的微量营养特征,含有大量的B 族维生素、矿物质和必需脂肪酸[44]。它的氨基酸图谱与FM 相似,并且不存在抗营养因子,甲烷氧化菌SCP比FM 具有更高的色氨酸含量和更低的赖氨酸含量,并且与大豆粉相比,它的氨基酸含量更高,含有更多的色氨酸和蛋氨酸。这意味着它们被视为水产饲料中可持续蛋白质的最高潜在候选者之一[45]。Ruiz 等[46]对虹鳟幼鱼进行了一项全面研究,通过利用MOB获得的SCP饲喂虹鳟幼鱼,观察其健康状况、肠道微生物群的组成和多样性以及在细菌病原体面前的抗病性等相关的几个参数来评估最佳FM 替代水平。研究结果表明,11.25%甲烷氧化菌SCP 可以取代高达75%的FM而不会影响生长和饲料效率。Zheng 等[47]对大菱鲆幼鱼生长、机体成分、抗氧化能力、氨基酸转运蛋白和蛋白质代谢进行研究。利用MOB 生产的SCP 代替FM对大菱鲆幼鱼饲喂0(对照)、15%、30%,45%、60%、80%和100%。结果表明,不同饲粮处理的鱼的存活率无显著差异。此外,甲烷氧化菌SCP 替代FM 蛋白的0、15%和30%饲粮组的特定生长率、饲料效率比和肉产量也无显著差异。这与之前Biswas 等[48]对大西洋鲑鱼和日本黄尾鱼的研究一致,其中36%和30%的饲料FM 蛋白可以被甲烷氧化菌SCP 取代,而不会对生长性能产生负面影响。
3.2 甲醇酵母SCP在饲料中的应用
豆粕虽然具有平衡的营养成分、高消化率,但由于其存在抗营养因子而限制了在虾和鱼饲料中的应用[49]。用酵母代替豆粕可以进行更好的比较,因为与代替FM 时相比,饮食的营养成分变化较少,与豆粕相比不具有其中的抗营养素。利用甲醇酵母生产的SCP 具有良好的营养特性,蛋白质水平高,供应稳定,价格合理而成为新的替代饲料成分。在饲料中添加甲醇酵母SCP 已被证明可以提高水生动物的生长性能并调节免疫反应和代谢[50]。大量研究表明,酵母可作为多种水生动物饲粮中的合理蛋白质来源,包括太平洋白虾、凡纳滨对虾、澳大利亚红爪小龙虾、幼年海鲈鱼和加拿大鳕鱼等[51]。
Guo等[52]研究评估甲醇酵母SCP在太平洋白虾的实际饲粮中作为FM 或豆粕替代品的利用率,使用分级水平(0、60、120、180 g/kg 和240 g/kg)的甲醇酵母SCP 代替FM 和豆粕,结果表明,在最终生物量、存活率、蛋白质保留率和饲料转化率方面没有显著差异;然而,在FM 替换系列中显示了最终体重和体重增加的有限差异。宋志峰等[53]发现用甲醇酵母SCP 替代豆粕等传统蛋白饲喂仔猪可以改善其生长性能、饲料转化率、促进仔猪营养物质消化、改善其肠道菌群健康等。Håkenåsen 等[54]研究了在断奶后的前两周,饲喂甲醇酵母SCP 对仔猪胃肠功能发育和健康的影响。断奶诱导对照组仔猪的几种免疫功能下调,而在甲醇酵母SCP 饲喂的仔猪中则不那么明显。结果表明,饲喂甲醇酵母SCP 可以改善断奶肠道稳态,使仔猪更健壮。
3.3 微藻SCP在饲料中的应用
利用微藻生产的SCP 蛋白质含量高,氨基酸种类差异小,可以替代FM 成为水产饲料中优质蛋白来源[55]。曹威荣[56]研究在饲料中添加微藻对尼罗罗非鱼幼鱼的生长性能及体成分的影响,在基础饲料中分别添加不同微藻蛋白,添加 7.5%和15%螺旋藻蛋白、7.5%和15%栅藻蛋白以及不添加任何微藻蛋白作为对照,结果表明,饲料中添加15%螺旋藻蛋白,尼罗罗非鱼幼鱼的增重率和特定生长率最高,且显著高于对照,鱼体粗蛋白质含量增加。饲料中添加栅藻,尼罗罗非鱼幼鱼的增重率和特定生长率均没有显著变化。全峰等[57]研究饲料中添加复合微藻蛋白对半滑舌鳎生长、体色及消化酶的影响。结果表明与对照组相比幼鱼的增重率、特定生长率、蛋白质效率显著提高。Mirzaie 等[58]研究确定螺旋藻蛋白在高温肉鸡中的潜在应用,试验结果表明,通过在肉鸡饲粮中补充螺旋藻蛋白,可以在生化水平上减轻环境温度高造成的不利影响,包括酶抗氧化系统受损、应激激素和脂质水平升高。Carvalho 等[59]通过给公牛饲喂富含二十二碳六烯酸(Docosahexaenoic acid,DHA)微藻SCP,观察其性能、胰岛素敏感性及肉质的影响。结果表明微藻SCP的添加可以提高DHA的含量,不会改变公牛的生长或胴体特性,增加了牛肉中的n-3 脂肪酸和n-3∶n-6比例。
3.4 CAP在饲料中的应用
CAP 的生产是环保和可再生的。CAP 含有高含量的粗蛋白和大量的脂质、碳水化合物和维生素[60]。作为一种细菌蛋白,CAP 与植物蛋白相比含有更少的抗营养因子,并且其生物胺含量低于动物蛋白[61]。已经研究了膳食CAP 在一些鱼类和虾物种中的应用[62]。Wu 等[63]研究用CAP 替代饲粮FM 对盘鲍的影响。分别为0、25%、50%、75%和100%的5 种含CAP 饲粮饲喂鲍鱼110 d。结果表明,与对照组相比,CAP 完全替代饲粮FM 对鲍鱼生长没有显著影响,并且研究发现当添加25% CAP 饲粮饲喂鲍鱼时其粗蛋白含量、硬度、羟脯氨酸含量、pH 等显著升高,有利于鲍鱼的生长。Yang 等[31]研究探讨了用CAP 代替FM 对大嘴鲈鱼生长、饲料利用和肠道组织学的影响。分别添加50、100、150、200 g/kg 和250 g/kg CAP 代替FM,对照组添加350 g/kg FM,分别饲喂大口鲈鱼8 周,结果表明用150 g/kg CAP 替代FM 对大嘴鲈鱼的生长、饲料利用和肠道组织无不良影响。Chen 等[64]用平均初始体重(6.03±0.09) g 的黑鲷进行了为期70 d 的饲养试验,以评估饲粮中用CAP 部分替代FM 的效果。采用CAP 分 级 水 平0、4.85%、9.70%、14.55%、19.40%、38.80%和58.20%替代FM,与其他饲料的鱼相比,饲喂CAP 58.20%饲料的鱼表现出显著较低的喂养率,显著提高的蛋白质效率比和饲料效率比。由此可得CAP 是一种安全有效的替代蛋白质来源,在黑鲷饲粮中可替代FM 达58.20%,对生长性能、抗氧化能力和消化酶活性无不良影响。
4 商业化生产SCP的局限性及解决途径
在19 世纪70 年代,SCP 的生产实现工业化生产并短暂地出现在市场中,但由于生产成本高,感官偏见、监管挑战、食品技术的不发达和安全问题没有实现大规模生产[65]。目前,美国KnipBio 公司利用甲醇作为原料生产的SCP 商业化产品KnipBio Meal 应用于水产饲料中。丹麦Unibio 公司利用甲烷作为原料生产的SCP 商业化产品Uniprotein®应用于仔猪饲料、马铃薯粉、鱼粉蛋白等[66]。此外,SCP 的下游加工可能是资本密集型的,涉及细胞生物量浓缩、提取和可能的蛋白质纯化的一系列过程需要大量资源。例如,来自细菌来源的蛋白质需要纯化以去除细胞生物量中的核酸含量,因为这可能会对健康产生严重不利影响。同时,藻类和真菌衍生的SCP 需要进行一些下游加工,以提高蛋白质的生物利用率。这些生物体的细胞壁很厚,动物无法消化,因此需要去除细胞壁以提高蛋白质效率。在某些情况下,获得纯化底物和原料生物使用的特定底物的升级、增值成本也可能相对较高,尤其是对于化学异养生物,因此限制了大量SCP生产的商业化[67]。据了解,目前可以实现工业化生产的项目是首席科学家、中国农科院饲料所研究员薛敏研究的在人工的条件下,以CO 和氮源大规模生物合成的CAP[68]。最近的研究发展,如快速基因组测序、多组学数据生成和分析、计算机建模、吞吐量的提高和生物基础的自动化[69],将加快通过基因修饰提高SCP 产量。同时当将原料转化为中间原料时,可以应用微生物工程,这些原料可以用作生产SCP 的微生物的碳源。在这一领域,合成生物学工具已经被使用或显示出巨大的潜力。中间原料可能以具有成本效益和可持续的方式生产,而这些中间原料又可以被相应的SCP 微生物用作低成本的碳源,用于积累生物质,并生产营养和功能化合物[70]。
5 展望
近年来,CO、CO2、CH4、CH3OH等一碳气体排放量日益增加,从而造成温室效应日益严重。目前甲醇酵母、化能自养菌和光合自养菌等微生物利用CO、CO2和CH4等一碳资源生物合成的SCP 生产效率更高,可持续,不需要使用任何耕地和农药,同时去除工业废气和废料,减轻饲料资源短缺的压力。SCP 具有高蛋白质含量、高消化率、氨基酸组成平衡、低碳排放以及至少在一定水平下支持最佳生长性能和健康的特点,有望成为水产饲料中有前途的FM 替代品。因此,在粮食短缺和碳减排的双重需求下,开发利用一碳资源生产SCP 是一项很有前途的技术,可以提供营养丰富且可持续的蛋白质资源,以满足未来水产养殖生产的扩张。虽然实现商业规模化生产仍具有挑战性,但未来可以通过微生物工程、基因修饰等途径提高SCP 的产量,进一步实现利用一碳资源大规模商业化生产。
