一株拮抗菌产生的抗菌物质的分离纯化与初步鉴定
2024-04-29夏尚远薛东红周启升孙凤霞夏尚飞刘训理
■ 夏尚远 薛东红 周启升 孙凤霞 夏尚飞 刘训理*
(1.枣庄市农业综合执法支队,山东枣庄 277100;2.山东农业大学,山东泰安 271000;3.山东交通职业学院,山东泰安 271000;4.新泰市畜牧兽医事业发展服务中心,山东泰安 271000;5.枣庄职业学院,山东枣庄 277100)
仔猪细菌性腹泻是养猪场常见性疾病,该病主要是由致病性大肠杆菌引起的一类传染性疾病,其感染后的仔猪临床疾病主要有黄痢(早发性大肠杆菌病)和白痢(迟发性大肠杆菌病)。仔猪黄白痢不仅造成仔猪成活率降低,断奶体重下降,还会引起大面积传播,两种疾病均居仔猪疫病之首[1-2]。据统计,当同窝仔猪中有一只仔猪感染黄痢,同窝的感染率超过90%,致死率可达50%[3]。大肠杆菌引发的疾病严重制约着规模养殖场生产发展,给畜牧业造成的损失巨大。
为防治该类疾病,部分养殖场长期、不合理使用抗菌性药物,造成了大肠杆菌耐药性不断增加,滥用药导致的细菌耐药性也成为全球关注的焦点,引起了世界卫生组织、世界动物卫生组织和联合国粮农组织等国际性组织的高度关注[4-5]。杨跃飞[6]通过对动物病料中分离到的353 株大肠杆菌进行耐药性研究分析表明,97.2%分离菌株对一种或以上抗菌药物耐药,72.2%对3种或以上药物耐药。为有效遏制动物源细菌耐药、整治兽药残留超标,2021年农业农村部出台了《全国兽用抗菌药使用减量化行动方案(2021—2025)》,明确要求相关教学科研单位、减抗达标养殖场(户)等开展安全高效低残留兽用抗菌药替代产品筛选评价工作。因此,如何采取有效措施预防和控制仔猪腹泻已成为养殖业的一项亟待解决的课题[7]。
目前饲料中添加抗菌肽已经成为预防和控制仔猪腹泻的研究热点,抗菌肽可通过膜穿孔作用影响致病大肠杆菌正常代谢,继而造成致病菌的死亡[8],同时还可提高动物机体免疫力,预防和减少疫病发生,提高畜禽的生产性能,改善畜禽产品品质[9]。短短芽孢杆菌是一种革兰氏阳性菌,能够产生多种抗菌物质。王洁等[10]研究发现,短短芽孢杆菌JH3 产生的抗菌蛋白能较好地抑制植物病害真菌。Li 等[11]从短短芽孢杆菌NO.G1 中分离到能够有效防治蔬菜的病原霉菌的几丁质内切酶。本课题组从泰山林地土壤中分离获得一株短短芽孢杆菌XDH,其产生的抗菌物质对动物源致病大肠杆菌、鸡白痢沙门氏菌等多种致病菌具有较强的抑制效果[12-13]。短短芽孢杆菌抗菌物质的分离纯化以及抗菌物质对致病大肠杆菌等的作用相关研究的报道尚少。本试验对XDH 菌株产生的抗菌物质进行了分离纯化,初步鉴定为一种新型抗菌肽,具有良好的稳定性和安全性,该菌株及其产生的抗菌物质有望作为饲料添加剂应用于畜牧业。
1 材料与方法
1.1 材料
1.1.1 菌株
拮抗菌:短短芽孢杆菌(Brevibacillus brevis)XDH,GenBank登录号:DQ279738。
指示菌:致病性大肠杆菌(Escherichia coli)、鸡白痢沙门氏菌(Salmonella pullorosis)。
1.1.2 培养基
固体培养基(PDA):葡萄糖20.0 g,牛肉膏5.0 g,土豆200 g,(NH4)2SO41.0 g,MgSO41.0 g,KH2PO40.6 g,CaCO33.0 g,琼脂30 g,纯化水1 000 mL,pH 7.0~7.5。
种子培养基:牛肉膏5.0 g,蛋白胨10.0 g,NaCl 5.0 g,纯化水1 000 mL。
发酵培养基:黄豆饼粉28.4 g,淀粉6 g,葡萄糖15.6 g,MgSO44 g,CaCO32 g,纯化水1 000 mL,pH 7.0~7.5。
1.1.3 培养条件
菌种培养:将拮抗菌划线接种于固体培养基(PDA)上,温度为30 ℃,培养时间18 h。
种子培养:刮取上述固体培养基(PDA)培养好的菌体2 环,接种于装有50 mL 液体种子培养基的250 mL三角瓶中,温度为30 ℃,培养时间为20 h,摇床转速为200 r/min。
发酵培养:将上述培养好的种子液取1 mL 接种于装有50 mL 液体发酵培养基的250 mL 三角瓶中,培养温度30 ℃,培养时间48 h,摇床转速200 r/min。
1.1.4 主要仪器设备
电子天平BP1211S1/10J;TH-混合梯度器;台式记录仪LM17-1A;自动部分收集器BSZ-100;KQ-600B型超声波清洗器;-86 ℃超低温冰箱P2-CT90/L;蛋白分离纯化系统 AKTA explore10;冷冻干燥机Modulyod。
1.1.5 主要试验材料
离子交换层析填料:CM Sepharose FF;分子筛填 料:Sephadex G25;色 谱 柱Sinochrom ODS-BP 柱(250 mm×10 mm,5 µm)。
1.2 试验方法
1.2.1 抗菌物质生物活性检测和效价测定
抗菌物质生物活性检测和效价测定采用杯碟法[14]。
1.2.2 抗菌物质的分离纯化
1.2.2.1 硫酸铵盐析
XDH 菌株发酵液100 ℃灭菌10 min,低速大容量离心机4 200 r/min,离心30 min,取上清液,加固体硫酸铵至饱和度为40%,25 ℃静置过夜,4 200 r/min 离心20 min,收集沉淀,用纯化水充分溶解,12 000 r/min离心20 min,收集上清液,双层滤纸过滤,4 ℃保存备用。
1.2.2.2 CM Sepharose FF离子交换柱层析
上样:将15 mL 上述双层滤纸过滤后的样品加在凝胶表面,用柱床体积的2~3 倍的纯化水充分淋洗,配合核酸蛋白检测仪和LM17 型记录仪,根据洗脱曲线收集洗脱液,调节流速60 mL/h。
洗脱:用TH-混合梯度器调节产生0~1.0 mol/L的NaCl进行洗脱,流速70 mL/h。
洗脱液的收集与生测:收集各洗脱峰,检测每个峰的抑菌活性,确定有效层析峰,采用牛津杯法进行抗菌物质活性的跟踪,收集有效峰并脱盐。
1.2.2.3 Sephadex G25柱层析
上样与上述离子交换柱层析方法相同。收集洗脱过程中产生的每个峰,将有效峰冷冻干燥,收集干物保存。核酸蛋白检测仪波长为280 nm,洗脱速度为60 mL/h。
1.2.3 抗菌物质的高效液相色谱与活性组分的结构分析
1.2.3.1 抗菌物质的高效液相色谱与活性组分样品的制备
将Sinochrom ODS-BP 色谱柱接入AKTA Explore10,先以100 mL 乙腈为流动相冲洗柱子,再以摸索出的100 mL最佳流动相冲洗色谱柱。
将上述抗菌物质粗品用流动相溶解配成浓度为35 mg/mL 的溶液,以0.45 µm 微孔过滤器过滤,然后上样,检测波长为高效液相色谱中最灵敏的波长,分别收集各有效层析峰,冷冻干燥,然后通过HPLC 检测各样品纯度。
1.2.3.2 抗菌物质活性组分的一级结构分析
采用电喷雾电离质谱法(ESI-MS)对抗菌物质分离效果好、纯度高的组分进行分子量的测定,并辅助二级喷雾质谱,获得其中的稳定片段信息。鞘气为氮气,电喷雾电压为4 kV,毛细管电压为12 V,正离子扫描模式,扫描范围m/z 50~600。
1.2.4 抗菌物质的对大肠杆菌和鸡白痢沙门氏菌的最小抑菌浓度(MIC)和最小杀菌浓度(MBC)测定
对经过CM Sepharose FF 离子交换层析、Sephadex G25凝胶层析获得的抗菌物质测定其对大肠杆菌和鸡白痢沙门氏菌的MIC和MBC。
采用常量肉汤稀释法,用肉胨培养基稀释抗菌物质(二倍稀释),将病原细菌接种于含不同浓度抗菌物质的培养基中,使细菌的终浓度为105CFU/mL。设只含抗菌物质而不接种细菌和只接种细菌而不含抗菌物质的对照管。30 ℃培养18~24 h,观察结果,以无细菌生长(清亮管)的最低浓度为MIC,将最低抑菌浓度以上无细菌生长的清亮管进行活菌计数,平皿培养基中细菌少于5 个菌落者,为MBC,试验设置2 个重复,结果取其平均值。
2 结果与分析
2.1 抗菌物质的分离纯化
2.1.1 抗菌物质的CM Sepharose FF离子交换层析结果XDH 菌株发酵液经硫酸铵盐析,上清滤液经CM Sepharose FF 离子交换层析,其层析色谱图见图1,水淋洗后得到两个色谱峰,抗菌物质生物活性检测结果表明皆无抗菌活性。在0~1 mol/L的NaCl梯度洗脱过程中,分离得到1 个色谱峰,生测结果表明具有抗菌活性,收集该色谱峰进行分子筛层析。
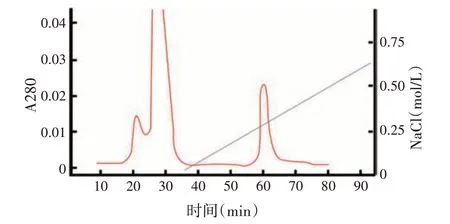
图1 抗菌物质的离子交换层析结果
2.1.2 抗菌物质的Sephadex G25柱层析结果
将上述获得的有效色谱峰溶液进行Sephadex G25 分子筛层析,其色谱图见图2,获得两个色谱峰,生测结果表明第一个色谱峰具有抗菌活性,收集该活性峰。

图2 抗菌物质的G25分子筛层析结果
2.2 抗菌物质的高效液相色谱与活性组分的结构分析
2.2.1 抗菌物质的高效液相色谱结果
通过AKTA explore10 蛋白分离纯化系统对抗菌物质进一步纯化,其纯化条件为:色谱柱Sinochrom ODS-BP 柱,流速为2.0 mL/min,样品配制浓度为35 mg/mL,检测波长为210 nm,一次进样量为1 mL,以乙腈∶0.1%TFA 水溶液比例为36∶64(v/v)作为流动相,对抗菌物质有效组分进行制备,其制备色谱如图3。获得A、B、C 三个有效组分,其保留时间分别为36.571、41.236、59.874 min。对其中分离效果较好的B 组分取样并进行浓缩、HPLC 纯度分析,分析图谱见图4。结果显示B 组分无杂质峰出现,其纯度为98.6%。
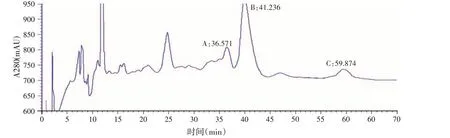
图3 抗菌物质的制备HPLC图谱
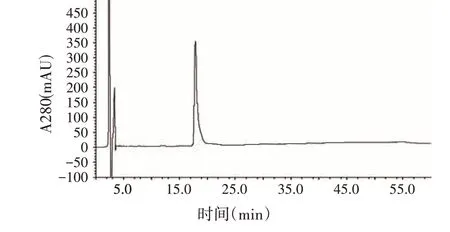
图4 B组分的HPLC图谱
2.2.2 抗菌物质B组分的一级结构质谱分析结果
对抗菌物质B 组分进行结构鉴定,其质谱图见图5、图6。一级质谱解析结果表明,该组分的分子量为1 570.9 Da,结合二级质谱图对一级结构进行推测,该组分的一级结构为:Ser-Ile/Leu-Tyr-Lys/Gln-Leu/Ile-Thr-Cys-Lys/Gln-Phe-469.54,其C 末端含有一分子量为469.54 Da的未知组分。

图5 抗菌物质B组分的一级质谱图
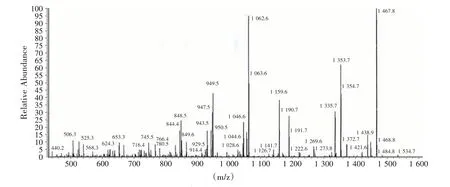
图6 抗菌物质B组分的二级质谱图
经NCBI Pubchem Substance 数据库检索,未发现与B 组分(分子量1 570.9 Da)分子量相同的活性物质,也未发现与B 组分一级结构中前3 个氨基酸相同结构的活性物质,因此,推测该组分可能为一新的肽类抗菌活性物质。
2.3 抗菌物质的对大肠杆菌和鸡白痢沙门氏菌的MIC和MBC
抗菌物质对大肠杆菌、鸡白痢沙门氏菌的MIC和MBC测定结果如表1所示。抗菌物质对大肠杆菌的MIC、MBC 分别为2.34 µg/mL 和4.69 µg/mL,对鸡白痢沙门氏菌的MIC、MBC分别为0.63 µg/mL和1.25 µg/mL。

表1 抗菌物质对大肠杆菌、鸡白痢沙门氏菌的MIC和MBC(µg/mL)
3 讨论
随着生活水平的提高,人们越来越关注动物产品的质量安全,因此,开发绿色、生态、环保型兽药以及饲料添加剂已是畜牧业研发的热点和重点[15]。与传统抗生素相比,抗菌肽的作用机制是独特的,不易引起病原微生物产生耐药性以及损害或破坏高等动物的正常细胞[16]。在耐药性不断增加的情况下,抗菌肽凭借广谱抑菌性、对人畜无毒副作用、良好的溶解性以及热稳定性等特点已被鉴定并优化为开发新型抗菌药物的框架[17]。
短短芽孢杆菌XDH 是本课题组从泰山土壤中分离获得的一株对大肠杆菌、鸡白痢沙门氏菌等多种动物致病菌产生拮抗作用的菌株,该菌株产生的抗菌物质具有热稳定性好、抗菌谱广、耐酸性强等特点,由于抗菌物质在分离纯化过程中不仅会有损失而且可能会失活,为此,分离纯化过程中采用杯碟法和高效液相检测相辅助的方法对活性物质进行跟踪,并对纯化步骤进行优化。通过CM Sepharose FF、Sephadex G25、AKTA Explore10 等方法对抗菌物质分离纯化,获得A、B、C 三个有效组分,其保留时间分别为36.571、41.236、59.874 min,对其中分离效果较好的B组分取样并进行浓缩,经HPLC 纯度分析显示B 组分无杂质峰出现,其纯度为98.6%,为初步了解B组分的结构,对其质谱解析,结果显示B 组分的分子量为1 570.9,该组分的一级结构为:Ser-Ile/Leu-Tyr-Lys/Gln-Leu/Ile-Thr-Cys-Lys/Gln-Phe-469.54,其C 末端含有一分子量为469.54 Da 的未知组分,经美国NCBI Pubchem Substance 数据库检索推测极有可能为一新的多肽类抗菌物质。关于XDH 菌株产生的抗菌物质的准确结构还有待继续研究。
4 结论
短短芽孢杆菌XDH 对动物源致病大肠杆菌、鸡白痢沙门氏菌等多种致病菌具有较强的抑制效果。本试验采用CM Sepharose FF、Sephadex G25 层析技术对其产生的抗菌物质进行了分离纯化,纯化后的抗菌物质对大肠杆菌、鸡白痢沙门氏菌的MIC、MBC 分别 为2.34L、4.69 µg/mL 和0.63、1.25 µg/mL。采 用AKTA Explore10 层析系统对抗菌物质进一步分离纯化,获得A、B、C三个活性组分,其中,活性组分B的质谱解析结果显示,其分子量为1 570.9 Da,推断为一新的多肽类抗菌物质。XDH 菌株及其产生的抗菌物质有望作为饲料添加剂广泛应用于畜牧业。
