黄粉虫在鱼类养殖中的应用研究进展
2024-04-29周东来李庆荣廖森泰邢东旭
■ 符 兵 周东来 陈 冰 李庆荣 彭 凯 廖森泰 邢东旭*
(1.广东省农业科学院蚕业与农产品加工研究所,广东省农产品加工重点实验室,广东广州 510610;2.广东省农业科学院动物科学研究所,农业农村部华南动物营养与饲料重点试验室,广东省畜禽育种与营养研究重点试验室,广东广州 510640)
由于全球渔业资源的日渐枯竭以及鱼粉需求量的日益增加,且2023 年6 月初鱼粉生产大国秘鲁“限捕令”的发布,导致鱼粉(fish meal,FM)和豆粕(soybean meal,SBM)资源愈发短缺、价格长期居高不下,优质饲料蛋白源的供应受限,制约了水产养殖业的发展,急需寻求FM 和SBM 的高效替代品。而黄粉虫(Tenebrio molitor,TM)作为欧盟首个批准的昆虫类食物新资源,具有营养均衡、易饲养、低成本等特点,在优质蛋白的替代上极具发展潜力。文章综述了黄粉虫的营养价值,以及其对鱼类生长性能、肌肉品质、免疫抗氧化及肠肝健康的影响,以期为新型水产动物饲料的研发提供参考资料。
1 黄粉虫的价值
TM 俗称“面包虫”,隶属于鞘翅目(Coleoptera)、拟步甲科(Tenebrionidae)、粉甲属(Tenebrionini),属于完全变态昆虫,其生长发育过程分为卵、幼虫、蛹和成虫四个阶段[1]。作为一种优质动物性蛋白原料,TM 富含蛋白质(48.8%~56.3%)和脂肪(27.3%~32.9%)[2-3],随着发育的进行,其蛋白质含量逐渐升高,脂肪含量逐渐降低。TM 蛋白质组成中,必需氨基酸含量约占总氨基酸的2/5,与联合国粮农组织(FAO)颁布的优良蛋白标准十分接近,赖氨酸、精氨酸、脯氨酸含量较高,但色氨酸、蛋氨酸+胱氨酸含量稍低[4];脂肪酸组成中,不饱和脂肪酸含量占脂肪酸总量的70%以上,亚油酸含量占脂肪酸总量的1/3,TM 榨出的油脂可用作潜在的油料资源[3,5]。同时,黄粉虫粉(Tenebrio molitormeal,TMM)还含有许多矿物质及维生素,其中钙、磷、镁、锌、硒的含量高于牛肉、猪肉和羊肉等动物性食品[6];维生素C 含量达99.0 mg/kg、烟酸含量达46.5 mg/kg、维生素B6含量达6.9 mg/kg[7]。
此外,TM 幼虫虫壁、虫蜕、蛹壳和成虫中均含大量的甲壳素(分别约为4.4%、18.4%、13.8% 和11.3%)[8]。甲壳素是自然界中唯一发现的阳离子碱性多糖,脱乙酰基后再经氧化降解可得到壳聚糖[8]。壳聚糖具有增强免疫力、抗氧化[9]、抗炎[10]、抗肿瘤、抗衰老等功效[11],广泛应用于医药、食品、化妆品、农业和工业等行业。黄酮是一类多酚类物质,在TM 中的提取量可达12.01 mg/g[6],其功效与壳聚糖类似。抗菌肽则是一种碱性多肽物质,存在于TM的血淋巴中,具有良好的热稳定性、水溶性和广谱抗菌性[12-13],能抑制细胞壁的形成,改变细胞膜的通透性,从而达到抑菌的效果。
2 黄粉虫对鱼类生长性能的影响
由于鱼种食性的差异,不同鱼摄食TMM 后表现出不同的生长性能。总体而言,添加4.0%~40.0%TMM替代FM 或SBM 不会对鱼类的生长性能造成负面影响,甚至会促进其生长[14-15]。也有研究表明[16],用以TMM为单一蛋白源(TMM添加量为40.2%和57.0%)的饲料饲喂草鱼,蛋白源和蛋白水平的交互作用会显著降低草鱼的生长和FI,同时会促进其厌食神经肽(proopiomelanocortin,POMC 和cocaine- and amphetamineregulated peptide,CART)的分泌以及厌食基因pomc的表达。而随着TMM 添加量的增加,饲料中甲壳素含量也逐渐升高,鱼体摄入过量的甲壳素会降低肠道对营养物质的消化吸收能力,造成生长减缓;同时会诱导机体的脂质代谢异常,致使HSI 升高等。黄粉虫对鱼类生长性能的影响见表1。
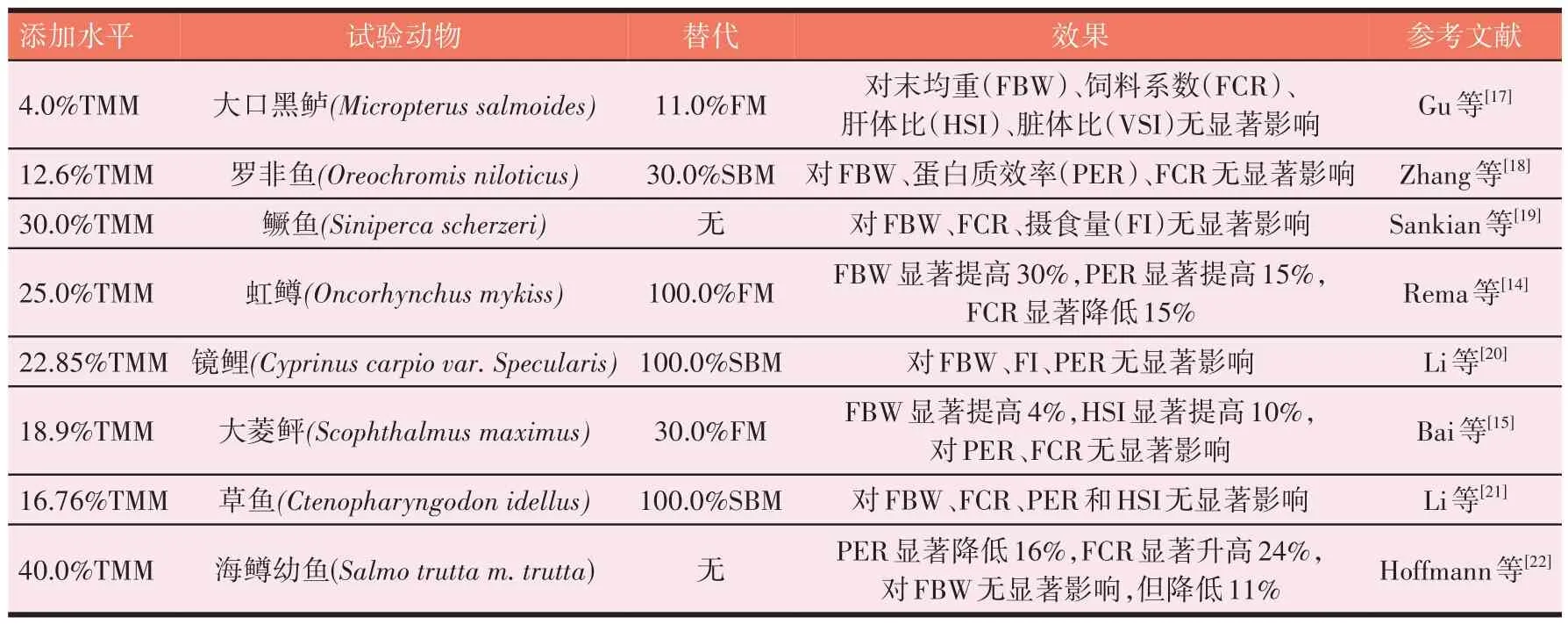
表1 黄粉虫对鱼类生长性能的影响
3 黄粉虫对鱼类肌肉品质的影响
肌肉的常规营养成分是评价鱼肉品质的重要标准,水分含量与鱼肉的机械强度呈负相关关系。脂肪含量与肉的嫩度、风味和多汁性密切相关[23]。研究认为,鱼肉中脂肪含量的降低会增加肌束之间的相互摩擦,降低肌肉嫩度,提高肌肉硬度[24]。Li 等[20]研究发现,TMM 替代60%SBM 会显著增加镜鲤的粗脂肪含量。但是,Zhang 等[18]在罗非鱼上的研究结果表明,TMM 替代45%SBM 会显著降低罗非鱼的粗脂肪含量。以上差异可能是饲料的营养组成和鱼种不同造成的。
测定肌肉质构特性是评价肉类品质的最常见的方法之一。对于大部分消费者而言,质构特性(口感)比营养价值具有更强的说服性[25]。质构特性主要包括硬度、弹性、咀嚼性、胶着性、胶黏性和内聚性[26]。一般认为,肌肉硬度的增加与粗脂肪含量的降低密切相关,与肌纤维密度的增加呈正相关,与肌纤维直径呈负相关,而咀嚼性由硬度、黏合性和弹性共同决定[27-28]。研究表明,TMM 替代15%和45%SBM 均能显著增加镜鲤肌肉纤维密度,降低肌纤维直径,提高肌肉硬度和咀嚼性[20]。TMM 替代45%SBM 对罗非鱼肌纤维直径虽无显著影响,但能显著增加低直径(小于100 µm)肌纤维的分布比例、肌肉硬度和胶黏性[18]。不同于蚕豆脆化鱼的肉质,TMM 适量替代SBM 或FM能显著提升鱼肉的质构特性,而过量替代却无“脆化”效果,其原因需要进一步研究。
氨基酸的种类与组成比例是鱼肉营养价值评定的指标之一,肌肉的游离氨基酸组成影响着鱼肉的风味。甘氨酸、丙氨酸、天冬氨酸和谷氨酸为主要的呈味氨基酸,其中天冬氨酸和谷氨酸呈鲜味,甘氨酸和丙氨酸呈甘甜味[29]。研究发现,TMM能显著增加镜鲤肌肉中甘氨酸和羟脯氨酸含量[20]。而Zhang 等[18]研究结果表明,TMM 对罗非鱼肌肉鲜甜味氨基酸和风味氨基酸含量无显著影响,在鳜鱼上也得到类似的结果[19]。这种差异很可能与饲料中的氨基酸含量不同以及TMM 的添加量不同有关。值得注意的是,草鱼肌肉组氨酸含量在TMM100% 替代FM 后显著降低[21],而鱼肉中游离的组氨酸经微生物的组胺脱羧酶作用产生组胺,组胺过多沉积会使鱼肉发生变质[30]。由此可以推断,添加适量的TMM 可以延长活鱼的运输和鱼肉的贮藏时间。此外,添加30%TMM 会增加鳜鱼肌肉中棕榈酸、油酸和亚油酸的含量,提高EPA和DHA 在总脂肪酸中的比例[19]。TMM 替代30%SBM能显著增加罗非鱼肌肉单不饱和脂肪酸(Monounsaturated fatty acid,MUFA)含量[18]。研究表明,棕榈酸是合成长链脂肪酸的前体物质,MUFA 具有降低血糖、降血脂、降胆固醇等功效,而EPA 和DHA 在促进生长发育、提高免疫能力以及调节脂类代谢等方面发挥重要的作用[29]。说明适宜的TMM 替代量能显著提升鱼肉的营养价值。
4 黄粉虫对鱼类免疫和抗氧化指标的影响
鱼的体液免疫是鱼免疫的重要组成部分,而血清和各组织的免疫参数可以反映鱼的免疫功能[31]。碱性磷酸酶(alkaline phosphatase,AKP)已被证实可通过抑制中性粒细胞的产生和炎症反应[32],对机体具有免疫调节作用。溶菌酶(lysozyme,LZM)由中性粒细胞和巨噬细胞产生,分泌到血液和黏液中,发挥抗病毒、抗菌和抗炎等作用[33]。Bai 等[15]研究结果表明,TMM 替代30%SBM 可显著提高大菱鲆前肠、中肠和后肠AKP 的活性,对前肠和中肠LZM 活性无显著影响。Gu 等[17]在大口黑鲈幼鱼上也发现,TMM 替代11%的FM 能提高血清中AKP 的活性,同时增加了肠道中非特异性抗性蛋白Toll 样受体2(TLR2)的表达,TLR2 的激活可以刺激抗体抗性防御系统产生白细胞介素10(IL-10)和生长转化因子(TGF-β),以及趋化性细胞因子来调节稳态[34]。此外,补体是鱼类抗微生物感染的重要组成部分,参与靶细胞裂解和生物体启动后的调节反应,而补体3(C3)和补体4(C4)是补体系统的主要组成部分。血清中C3 和C4 水平的增加可改善免疫调节,中和毒素并阻断炎症反应[35]。Zhang等[36]研究发现,TMM替代30%FM能显著增加大黄鱼(Pseudosciaena crocea)血清中C3 水平。以上研究结果说明添加适量的TMM 能显著降低机体发生炎症反应的概率,增强机体的免疫能力,而添加过高的TMM可能会诱导机体的炎症反应。
在正常生理状态下,动物机体内的自由基含量处于动态平衡的状态,一旦受到外界环境刺激或机体自身变化,鱼体内活性氧(reactive oxygen species,ROS)产生量短时间内迅速增多或者机体对ROS 的清除能力下降,此时就会出现氧化应激[37]。氧化应激可以通过影响抗氧化相关酶的活性来扰乱肝脏和血液的抗氧化防御机制,而生物体内主要的抗氧化酶有还原型谷胱甘肽(GSH-Px)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD),其中SOD 能够清除氧自由基,GSH-Px可将过氧化物还原为羟基化合物,CAT 能将过氧化氢(H2O2)分解为水和O2,从而使细胞免受氧化应激损伤[38]。研究表明,TMM 替代11%~55%FM 会显著提高大口黑鲈肠道中GSH、谷胱甘肽过氧化物酶(GPX)和SOD 的活性,这可能是TMM 显著上调了肠道中关键转录因子核因子2(Nrf2)在体内的相对表达,进而激活了Nrf2信号通路,从而在基因和酶活性水平上调控下游GPX、GSH 和CAT 的表达[17]。Nrf2 信号通路已被证实通过调节鱼类和哺乳动物中抗氧化酶基因的表达来保护细胞免受氧化应激[39]。在大菱鲆[15]、鳜鱼[19]、镜鲤[20]上也得到了类似的结果。而张乐等[40]发现,TMM 替代15%~45%SBM 会显著增加尼罗罗非鱼肠道中SOD含量和总抗氧化能力,显著降低肝脏的抗氧化能力,当TMM 替代量达45%时,会显著上调肝脏中Nrf2和Klf9基因的表达,造成ROS 在肝脏的积累。这说明罗非鱼肠道对于TMM的耐受性要强于肝脏。
5 黄粉虫替代对鱼类肠道和肝脏健康的影响
肠道组织学分析是评估肠道健康的直接方法。一般认为,肠绒毛的高度和厚度与营养物质的消化吸收能力呈正相关关系,而肠肌层厚度的变窄可能意味着肠道的炎症反应[41-42]。TMM 替代超过30%SBM,会显著降低尼罗罗非鱼肠道绒毛高度和肌层厚度,能直观反映肠道屏障的上皮电阻也出现降低的现象[40]。而在大黄鱼中,TMM 替代超过15%FM 能显著增加其肠绒毛高度和宽度[36]。海鳟[22]的研究结果与之类似,肠肌层厚度在添加TMM 后显著增加,不过同时会降低其淀粉酶和脂肪酶的活性。鱼体内的消化酶活性与饵料中营养成分的含量与组成密不可分,其活性在一定程度上反映了生物对饲料和营养物质的消化吸收程度[43]。以上差异的出现主要归因于不同鱼对TMM的耐受力不同。也有研究发现[44],饲喂添加黑水虻虫粉(Hermetia illucensmeal,HIM)的饲料后大西洋鲑鱼(Salmo salar)肠道会出现脂滴的积累。有学者认为这是乳糜微粒的脂蛋白涂层的磷脂合成不足所致[45]。但不可否认的是,随着试验时间的推进,TMM和HIM均会逐渐加重对肠道组织的损伤。
肠道菌群可影响宿主的生理、营养、免疫和代谢功能,又能调控宿主的正常生理功能,对鱼类的健康状况起着至关重要的作用[46]。研究表明[36],大黄鱼各TMM 替代组肠道中的OTU 数目均高于对照组,其中45%替代组比对照组高出38.6%,各组优势菌门分别为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)。芽孢杆菌(Bacillus Cohn)具有益生菌特性,能产生乙酸、乳酸和细菌素等次级代谢产物,有助于改善鱼类肠道和机体健康[47]。研究发现,添加TMM 对海鳟肠道芽孢杆菌的相对丰度无显著影响[48],添加15%TMM 会显著增加西伯利亚鲟(Acipenser baerii)肠道的芽孢杆菌相对丰度[49],在大黄鱼中也发现,TMM 替代45%FM 会增加类芽孢杆菌和拉式梭状芽孢杆菌的相对丰度,但在金头鲷(Sparus aurata)和褐鳟(Salmo trutta)中,TMM 替代50%FM 会降低芽孢杆菌的相对丰度[50]。此外,饲料中添加10%TMM 会降低海鳟肠道肉食杆菌属(Carnobacterium)和乳杆菌属(Lactobacillus)的相对丰度[48],肉食杆菌属和乳杆菌属都属于乳酸菌,其代谢过程可产生抑制鱼类病原体生长的物质。肉食杆菌和乳杆菌属相对丰度的降低可能会造成肠道内病原体的增殖和肠道菌群失衡,增加鱼体患病风险。但大黄鱼上的研究结果表明[36],TMM 替代30%FM 会增加乳酸杆菌的相对丰度,替代45%FM 能降低邻单胞菌属的相对丰度。而以上肠道菌群相对丰度的变化一方面归因于TMM 中含有大量的甲壳素。研究证实,甲壳素是调节肠道微生物组成的重要因子,能降低大肠杆菌、假单胞菌、芽孢杆菌等的数量,可充当肠道的“益生元”[51]。另一方面是由于TMM 中的抗菌肽(α-螺旋肽、富含半胱氨酸的肽、富含脯氨酸的肽和富含甘氨酸的蛋白质)具有广泛抗菌性[52]。这说明TMM 会选择性地改善肠道菌群组成,维持肠道环境稳定。
肝脏作为脂质和蛋白质代谢与再分配的主要场所,在维持代谢稳态中起着不可或缺的作用。肝脏组织学分析能直观反映病理状态。Bai 等[15]在大菱鲆中发现,脱脂TMM 替代75%FM 不会造成肝脏组织的炎症反应,但会显著降低其肝细胞直径,而Su 等[53]研究结果表明,TMM 替代超过50%FM 会导致大口黑鲈肝脏组织炎症细胞的浸润。这种差异可能是TMM 处理方式、替代量不同以及不同鱼种体内脂质代谢过程不同造成的。血清中的谷草转氨酶(AST)和谷丙转氨酶(ALT)活性的变化可直接反映肝脏功能是否受损[54],其活性的升高标志着肝细胞膜受到破坏,肝功能受到损伤。Hoffmann 等[22]研究发现,海鳟血清中ALT含量在摄入TMM后显著升高,AST含量也呈现上升的趋势。在鳜鱼[19]上也得到类似的研究结果。而大口黑鲈的研究结果表明,ALT和AST含量会随TMM替代量的增加呈现先降后升的趋势[17]。这归因于TMM 替代水平较低时,机体免疫能力得到一定提升(TLR 和Nrf2 信号通路的激活、IL-10、TGF-β以及趋化性细胞因子表达的上调),减轻了肝组织的炎症反应。有学者也认为,血清中AST和ALT 含量的升高并不是鱼体不健康的表现,而是TMM 替代FM 后促进氨基酸代谢的结果[55]。
6 小结与展望
大量研究结果表明,黄粉虫可作为鱼粉和豆粕的良好替代品。添加适量的黄粉虫粉对鱼类的生长性能无显著影响,能提高机体的免疫和抗氧化能力、提升肌肉营养价值以及保护肠道屏障和维护肝脏健康。然而需要注意的是,黄粉虫富含油脂,过高的添加量会导致或加速饲料的酸败,最终对鱼体造成毒害和损伤。目前关于脱脂黄粉虫对鱼类影响的研究较少,后续的工作也可将重点放在脱脂黄粉虫以及甲壳素、黄酮和多糖等活性物质在鱼类新型饲料应用的研究上。此外,黄粉虫虫沙在水产饲料上的应用也不失一个良好的研究方向。
