血浆同型半胱氨酸与动脉粥样硬化早期进展的相关分析
2024-04-29王阳,张潇,师瑞,李扬
王 阳, 张 潇, 师 瑞, 李 扬
卒中是中国成人致死、致残的首位病因,其中脑梗死约占全部脑卒中的65%[1]。大动脉粥样硬化性脑梗死是脑梗死中最常见的类型,而颈动脉粥样硬化是全身动脉硬化的代表部位。尽管有一些有效的预防颈动脉粥样硬化的方法,但控制或逆转其早期进展为动脉粥样硬化的意义重大。颈动脉粥样硬化早期阶段的检测包括超声测定的颈动脉内膜中层厚度(carotid intima-media thickness,CIMT)和颈动脉斑块[2]。CIMT 是动脉壁内2 层厚度的总和,内膜-中膜厚度以中膜厚度为主,随着动脉粥样硬化的进展,中膜厚度所占比例逐渐减少,动脉粥样斑块形成,导致管腔狭窄。
动脉粥样硬化的危险因素主要有高龄、高血压、吸烟、高低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)[3,4]。既往很多研究探讨动脉粥样硬化与同型半胱氨酸(homocysteine,Hcy)的关系,由于纳入的人群主要来自发达地区,且平均Hcy浓度正常或略高于正常浓度[5-8],所以高同型半胱氨酸血症(hyperhomocysteinemia,HHcy)是否是动脉粥样硬化的危险因素,降低Hcy 是否延缓或逆转动脉粥样硬化仍存在争议。
本研究的目的是通过分析我国陕西省汉中市柳林镇500 例 ≥ 40 岁患者人口统计学资料、颈动脉超声结果及血液指标,以明确Hcy 与动脉粥样硬化早期进展的关系。
1 材料与方法
1.1 研究对象
参与者为2017—2020 年陕西省汉中市柳林镇范家营村、曹河坝村、周家滩村参加陕西省脑卒中高危人群筛查和干预项目的人群,年龄均≥40 岁。排除标准为既往有甲状腺、肾脏、胃肠道疾病或癌症;外地迁入不足3年;年龄>80岁。
1.2 研究方法
1.2.1 研究流程 第1 次调查前1 周,通过宣传彩页、电话和微信告知村民项目方案及日程安排。对于同意参加项目的村民,由汉中市中心医院2 名主治医师进行面对面的结构化问诊。签署知情同意书后,参与者接受颈动脉超声检查和血液化验。3年后对上述参与者再问诊、检查1 次。进行统计分析的研究对象包括完成问诊、颈动脉超声检查和血液化验的研究对象。
1.2.2 颈动脉超声检查 颈动脉超声由汉中市中心医院1 位经验丰富的超声诊断医师操作。所参与者均行2 次颈动脉彩色多普勒超声检查(飞利浦IE33 超声诊断仪,线阵探头)。对于CIMT 的测量,使用动脉测量系统的自动边缘检测程序确定左、右颈总动脉(common carotid artery,CCA)远端1 cm的内侧管壁和外侧管壁[9]。CIMT 定义为无斑块的颈总动脉管腔-内膜界面与中膜-外膜界面之间的距离。根据Mannheim 颈动脉内膜-中膜厚度共识,CIMT≥1.0 mm 定义为CIMT 增厚[2]。双侧统计3 个区域的斑块数量:CCA远端1 cm、颈动脉球和颈内动脉(internal carotid artery,ICA)近端1 cm。斑块被定义为病灶突出,其厚度大于周围内膜-中膜厚度(intima-media thickness,IMT)的50% 或IMT≥1.5 mm[2]。根据2003 年超声诊断专家共识,在二维及彩色多普勒超声下颈动脉狭窄程度分为正常(无狭窄)、<50%、50%~69%、70%~99%、接近闭塞和完全闭塞[10]。超声采集颈总、颈内动脉可探及的最大狭窄。
1.2.3 生化检测 所有研究对象均空腹8 h后经肘静脉采血,采用超速离心机(KH80 自动脱盖离心机)分离血清,采用罗氏Modular P800 型全自动生化分析仪通过酶循环法检测血清Hcy 水平。使用罗氏cobas c702 全自动生化分析仪(型号cobas c702)测定血清总胆固醇(total cholesterol,TC)、甘油三酯(triacylglycerol,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)。
1.2.4 统计学方法 本研究中定量资料以中位数(四分位间距)[M(P25,P75)]描述,采用Mann-WhitneyU检验,定性资料以频数和百分比描述。两组间比较酌情采用χ2检验或Fisher 精确检验,采用Logistic 回归进行多因素分析。在分析HHcy 的参与者时,应用单变量分析来选择两组参与者特征中潜在的混杂因素,然后将单变量分析中的显著变量纳入多变量模型,结果以调整后的比值比(OR)和95%置信区间(95%CI)表示。采用SPSS 22.0 进行统计分析。所有检验均为双尾检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 入组流程
3个村共有537例村民年龄≥40岁,因患有肾脏、甲状腺、胃肠道和癌症疾病排除12 例,外地迁入未满3 年排除7 例,年龄>80 岁8 例,首次有510 例参与研究。3年后再次研究时有2例期间死亡,2例失访,1 例新发甲状腺癌、1 例新发肺癌、1 例新发胃癌排除,1 例拒绝检查,最后501 例参与研究。统计分析时1 例超声结果不合格剔除,最终500 例纳入分析(见图1)。
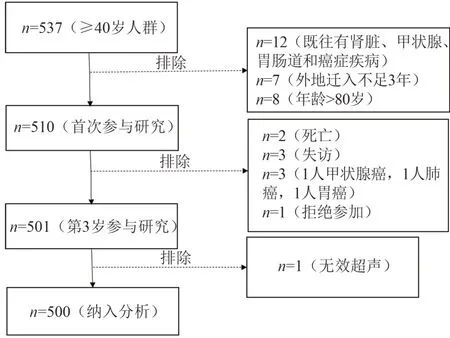
图1 调查研究流程图
2.2 CIMT 增厚与未增厚、新增斑块与未新增斑块、新发颈动脉狭窄与未新发组间人口学特征比较
经过3 年的随访,卒中筛查500 例中有176例CIMT 增厚,占总数的35.2%。经多因素分析,高龄、吸烟和高LDL-C 为CIMT 增厚的独立危险因素。CIMT 增厚组初查Hcy 为19.35 μmol/L,未增厚组初查Hcy 为17.45 μmol/L,单因素分析二者差异有统计学意义(P=0.004),经多因素分析二者差异无统计学意义(95%CI0.99~1.03,P=0.291)(见表1)。参加卒中筛查项目的500例中有252例新发斑块,占比为50.4%。经多因素分析,高龄、高血压、高LDL-C为斑块形成的独立危险因素。新增斑块组初查Hcy 为18.95 μmol/L,无新增组初查Hcy为17.4 μmol/L,单因素分析二者有统计学差异(P=0.01),经多因素分析二者差异差异无统计学意义(95%CI0.99~1.03,P=0.191)(见表2)。卒中筛查500例中231例新增颈部动脉狭窄,占比46.2%。经多因素分析,高龄、高LDL-C、TC 升高是新发颈部动脉狭窄的独立危险因素(见表3)。新发颈部动脉狭窄组初查Hcy为19.8 μmol/L,未新发组初查Hcy为17.2 μmol/L,单因素分析二者差异有统计学意义(P<0.001),经多因素分析二者差异无统计学意义(95%CI0.99~1.04,P=0.056)(见表4)。
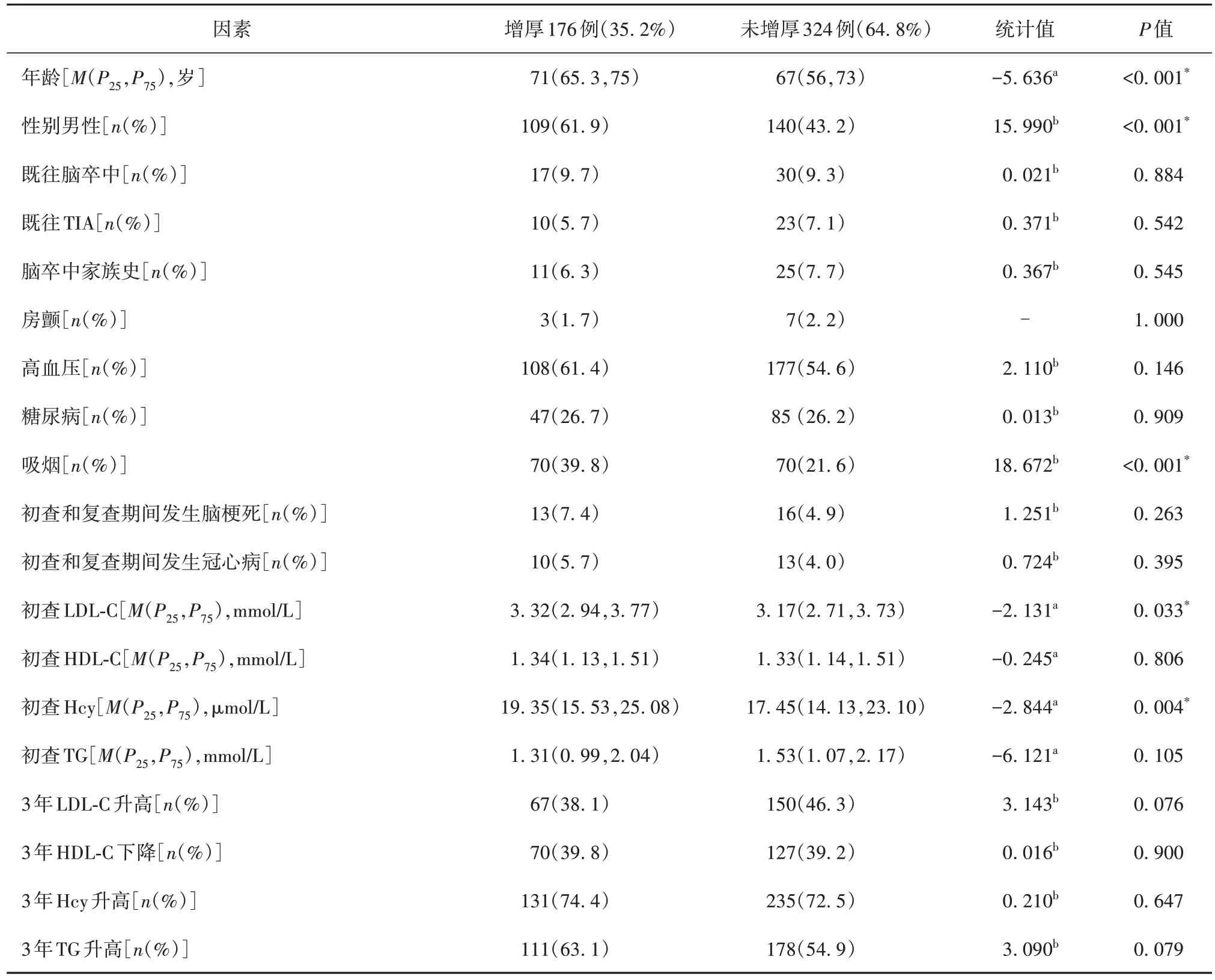
表1 卒中筛查人群3年CIMT增厚与未增厚人群比较
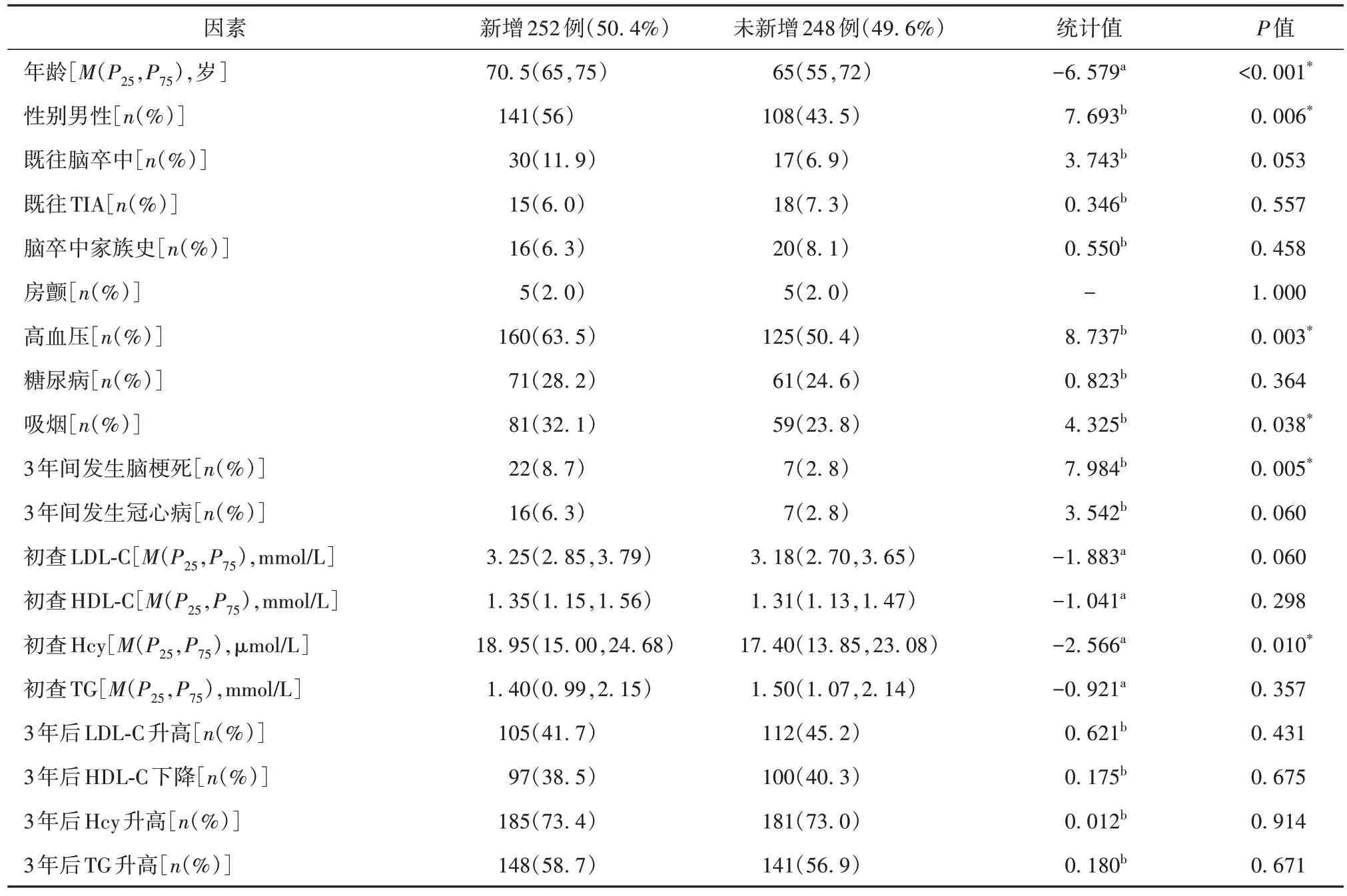
表2 卒中筛查人群3年新增斑块与未新增斑块人群比较
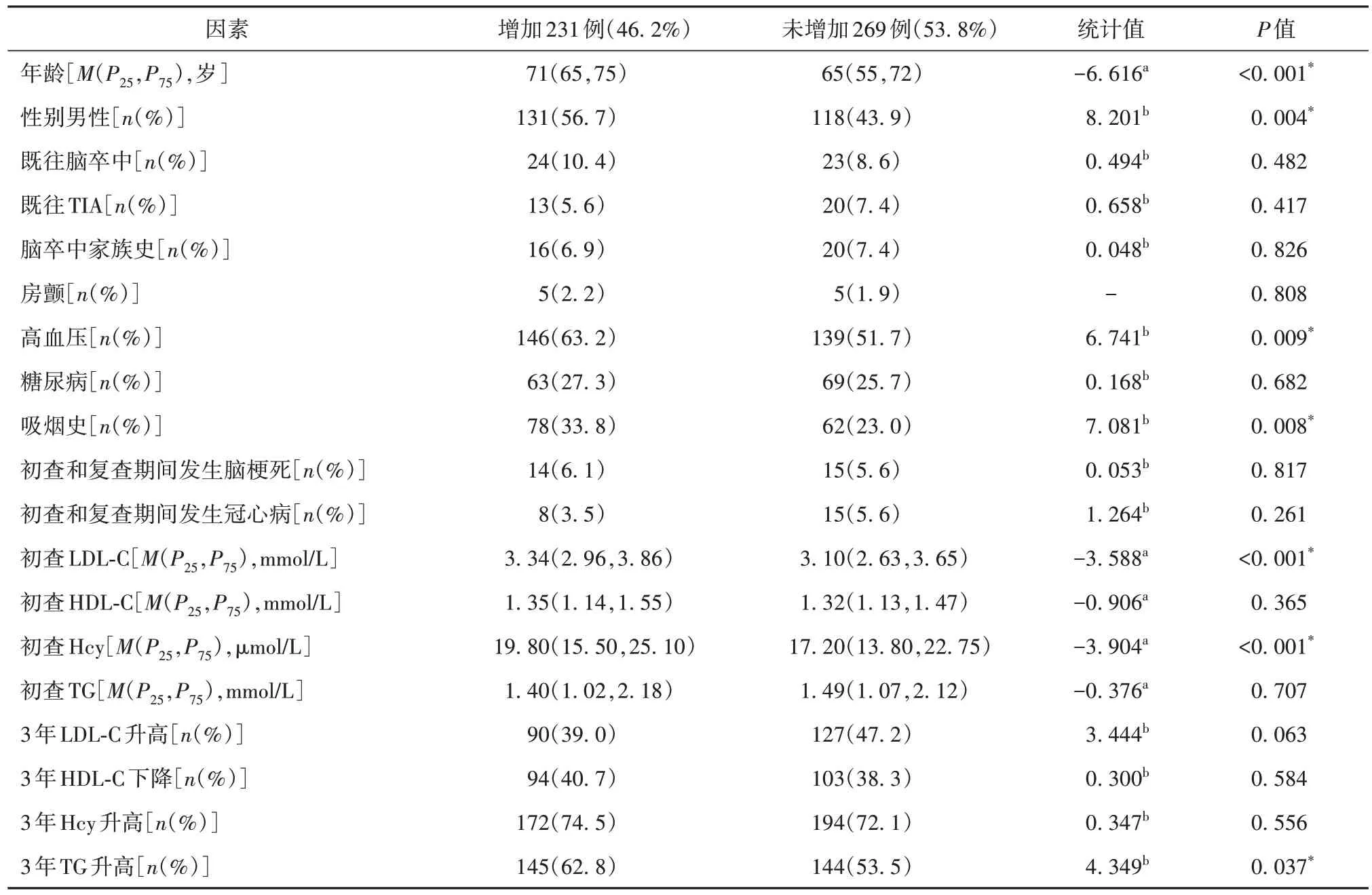
表3 卒中筛查人群3年颈部血管狭窄率增加与未增加人群比较

表4 CIMT增厚与未增厚、新增斑块与未新增斑块、新发颈动脉狭窄与未新发组间ORs
2.3 Hcy指标的影响因素
初查HHcy(≥15 μmol/L)患者有364 例,3 年后有119 例Hcy 较前下降,245 例Hcy 较前未下降。影响Hcy 是否下降的因素可能有性别、既往卒中史、吸烟、初查LDL-C、初查Hcy、3 年后Hcy(见表5)。

表5 初查Hcy≥15 μmol/L人群3年后Hcy下降组与Hcy未下降组人口学特征比较
2.4 Hcy 下降与颈动脉粥样硬化改善或维持正常的相关性
在364 例HHcy 参与者中,有150 例参与者3 年后颈动脉斑块减少或维持无;有212 例参与者3 年后CIMT 降低或维持正常;有179 例参与者3 年后颈动脉狭窄程度减轻或维持无狭窄。经调整性别、既往卒中、吸烟、基线LDL-C、基线Hcy、3 年后Hcy后行多因素分析,在HHcy 人群中,Hcy 下降与颈动脉粥样硬化改善或维持正常未显示相关性(见表6)。
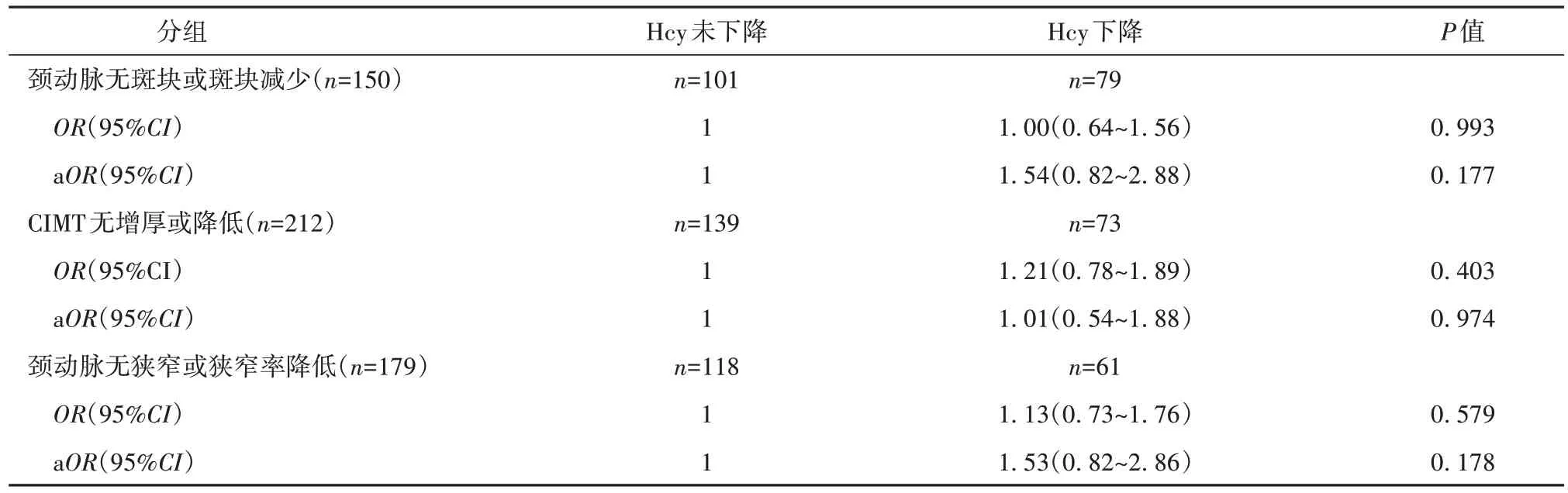
表6 经多因素调整3年后Hcy下降与未下降与颈动脉粥样硬化改善或维持正常的关系
3 讨 论
本研究表明,颈动脉粥样硬化的危险因素主要有高龄、吸烟、高LDL-C、高血压病、高TC,这和既往研究结果一致[3]。结果未显示糖尿病是动脉粥样硬化的危险因素,这可能和当地村民糖尿病知晓率低有关。经多因素分析,未发现初查Hcy 浓度是CIMT、颈动脉斑块、颈动脉狭窄率的独立危险因素,降低Hcy 并未延缓或逆转CIMT 增厚、颈动脉斑块增加、颈动脉狭窄增长。
本研究人群中初查HHcy(≥15 μmol/L)为364例,占比达72.8%,平均Hcy 浓度为21.33 μmol/L。Hcy 降低组Hcy 平均值由25.7 μmol/L 降低为19.1 μmol/L,降低6.6 μmol/L;Hcy 升高组Hcy 平均值由19.2 μmol/L 升高为25.1 μmol/L,升高5.9 μmol/L。不同文献中Hcy 浓度的差异可能是不同的纳入标准、地域、种族等所致,但Hcy 浓度越高越能客观反应其与疾病结局的相关性。既往研究显示≥20 岁陕西人均Hcy 浓度为19.0 μmol/L,男性平均Hcy 浓度为23.4 μmol/L,女性平均Hcy 浓度为16.6 μmol/L[11]。这些结果远高于西方世界普通人群[12](平均Hcy浓度:11.6 μmol/L,男性为13.0 μmol/L,女性为10.0 μmol/L),也高于中国沿海农村人口[13](平均Hcy 浓度:10.5 μmol/L,男性为12.0 μmol/L,女性为9.6 μmol/L)和日本农村普通人群[7](平均Hcy 浓度:10.5 μmol/L,男性为12.6 μmol/L,女性为9.8 μmol/L),理论上更能代表HHcy 对动脉粥样硬化的影响。根据我们的数据和Liu[14]等显示Hcy 升高并不是CIMT 增长的危险因素。即使经详细的分层分析,亦没有显示Hcy 水平在所有人群、患者、伴侣和儿童CIMT 增长中有显著差异。长期补充B 族维生素可显著降低Hcy 浓度,但却未能降低CIMT 变化[8,15]。有研究显示伴HHcy 的高血压患者与伴正常Hcy 的高血压患者的CIMT 无显著差异。然而,在其结果中,高血压合并HHcy患者的颈动脉斑块厚度和颈动脉狭窄程度均较Hcy 正常的高血压患者严重,作者认为这可能和纳入的样本量和测量的准确性有关[16]。同为西北落后农村地区,新生儿神经管畸形发病率全球最高地区,Li 等[17]以山西吕梁农村地区村民为研究对象显示HHcy与CIMT和颈动脉斑块无显著关系,HHcy不是形成动脉粥样硬化的独立危险因素,这和我们的研究结果一致。
HHcy已被确定为心脑血管疾病的强预测因子,独立于经典的动脉粥样硬化危险因素[18]。然而,并非所有的疾病预测因子都是严格定义的危险因素。生物标志物通常代表疾病的早期阶段。优化生物标志物的干预措施可能与降低疾病发病率相关,也可能与疾病发病率无关,这取决于治疗是否对生物标志物的出现和疾病发生的因果机制产生影响[17]。Hcy 诱导动脉粥样硬化的机制目前尚不明确。可能的机制包括:(1)损伤血管内皮细胞;(2)诱导血管平滑肌增殖;(3)促进免疫炎症反应;(4)诱发内质网应激;(5)影响机体甲基化;(6)导致血液凝固性增高;(7)引起脂质代谢紊乱[19]。降低了生物标志物水平,而并未降低疾病发病率是没有现实意义的。
目前的研究对Hcy 水平升高是否只是脑卒中等血管事件的次要现象存在争议[15,20,21]。在预防卒中的维生素干预(the Vitamin Intervention for Stroke Prevention,VISP)研究中,首次卒中时基线Hcy 水平升高导致卒中复发的风险显著增加。然而,多种维生素治疗降低Hcy并不能预防卒中复发[15]。结合我们的数据,HHcy 和降低Hcy 对早期动脉粥样硬化也没有显著的因果效应,这支持了Hcy水平与其他卒中危险因素混杂的观点,尽管这些因素是什么仍不确定。且脑血管病事件往往是动脉粥样硬化的累积效应和可能导致血栓形成的炎症或止血失衡触发所致。
本研究仍存在一些局限性。首先,纳入的样本量偏低,可能导致偏倚;其次,糖尿病和高血压等疾病知晓率低,提供的病史可能影响结果。
综上所述,我国陕西汉中市农村地区40 岁及以上村民动脉粥样硬化的危险因素主要有高龄、高LDL-C、吸烟、高血压等。该地区Hcy 平均水平高于国外、国内其他地区报道;HHcy 与颈动脉粥样硬化未发现明显相关性,未发现降低Hcy 能延缓或逆转颈动脉粥样硬化进程。
伦理学声明:本研究方案经由空军军医大学第一附属医院伦理委员会审批(批号:KY20232227-F-1),患者均签署知情同意书。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:王阳负责数据收集、文献收集、撰写论文;张潇负责统计学分析、绘制图表;师瑞负责协调项目实施、原始资料的汇总收集;李扬负责论文设计、拟定写作思路、指导撰写论文并最后定稿。
