水稻OsCNGC10基因抗倒伏性以及抗旱性功能研究
2024-04-28朱忠林巫燕飞杜雪竹
朱忠林 文 月 周 棋 巫燕飞 杜雪竹,2,* 盛 锋,*
研究简报
水稻基因抗倒伏性以及抗旱性功能研究
朱忠林1文 月1周 棋1巫燕飞1杜雪竹1,2,*盛 锋1,*
1湖北大学生命科学学院 / 省部共建生物催化与酶工程国家重点实验室, 湖北武汉 430062;2湖北洪山实验室, 湖北武汉 430062
环核苷酸门控离子通道是一种配体门控的阳离子通道, 存在于动物和植物体内, 是真核生物信号级联反应的重要组成部分。本研究利用水稻环核苷酸门控离子通道(cyclic nucleotide-gated channel,)基因, 构建了超表达载体和双靶点敲除载体, 通过农杆菌介导的遗传转化法获得敲除和过表达材料, 并从T2代中分离到纯合植株及。转基因植株茎秆特性以及抗倒伏性分析表明, 突变体茎秆强度和抗倒伏性增强; 茎秆细胞壁组织切片以及组织成分分析则表明突变体植株抗倒伏性增强是由于茎秆细胞壁茎壁厚度、薄壁组织细胞丰度以及木质素含量增加所致; 过表达降低了茎秆壁厚、茎秆木质素含量以及茎秆细胞壁细胞丰度, 敲除增加了茎秆木质素含量且增加了茎秆细胞壁薄壁细胞丰度, 初步证明与水稻茎秆细胞壁成分合成相关, 负调控水稻抗倒伏性; T2代田间试验结果表明, 与野生型相比, 突变体植株的株高、有效穗、穗长、穗粒数、结实率、千粒重和单株产量等农艺性状显著提升; 苗期干旱胁迫实验结果表明, 在干旱胁迫下,基因缺陷型植株体内丙二醛(MDA)含量积累速度加快, 且无法形成足够的游离脯氨酸, 而过表达植株在遭受干旱胁迫时, 体内游离脯氨酸(Pro)含量大量升高, 且MDA积累速度相对变慢, 初步说明正向调控水稻苗期抗旱性。本研究结果表明水稻可能在水稻抗倒伏及抗旱方面有潜在功能, 为培育抗倒伏且高产的水稻新品种提供了理论基础和新的种质资源。
水稻;; 抗倒伏; 抗旱; 细胞壁
水稻在世界上分布非常广泛, 全世界有122个国家种植水稻, 亚洲、欧洲、美洲、非洲和大洋洲都有水稻种植, 栽培面积常年在1.40~1.57亿公顷[1]。近年来, 随着大穗型高产水稻品种的推广, 以及直播、抛秧等简化栽培技术的广泛应用, 水稻倒伏的潜在风险越来越大[2]。田间发生倒伏时, 水稻的产量、品质均会降低, 机械收割也会受到严重阻碍。中国南方的水稻产量因倒伏通常会下降10%~30%, 严重时甚至会下降80%。此外, 水稻的产量受到干旱、高温等不良气候的制约。据统计, 我国每年因干旱导致水稻减产到总产量的13.1%, 严重制约水稻生产。因此, 培育抗倒伏、抗旱的优质高产水稻新品种, 保持水稻高产稳产以满足日益增长的粮食需求迫在眉睫。
环核苷酸门控离子通道(Cyclic nucleotide-gated channel, CNGC)是一种配体门控的阳离子通道, 主要分布在质膜上[3-4], 存在于动物和植物体内, 是真核生物信号级联反应的重要组成部分。1998年, Schuurink等[5]首次在植物体内克隆了CNGC。Arazi等[6]研究认为NtPB4与最近报道的具有相似功能,参与植物体内金属离子转运。Talke等[7]研究表明CNGC可作为植物环核苷酸信号的主要靶标。Kaplan等[8]和Yuan等[9]对模式植物拟南芥CNGC家族进行鉴定和功能分析, 发现拟南芥CNGCs家族共有20个成员, 分布于拟南芥各个组织和器官, 参与拟南芥生长发育以及在响应外界环境刺激行使一定功能。作为植物发育和逆境耐受性的调节因子,参与了植物Ca2+的吸收[10]。朱天全[11]在对和的研究中认为,与野生型拟南芥相比, 在苗期会有严重的矮化表型, 且花期会延迟。Tan等[12]研究认为CNGC5、CNGC6和CNGC9是拟南芥中构成性根毛尖端生长和生长素信号传导所必需的3个关键Ca2+通道。Jin等[13]研究结果表明负调控拟南芥的耐盐性, 可能参与了Na+的转运。Meral等[14]认为CNGC7和CNGC8至少是部分功能冗余, 并在花粉管顶端生长的启动过程中提供了必要的功能。同时, 该研究者的另一项工作表明对高温和干旱条件下的花粉育性至关重要[15]。植物CNGCs还存在可能参与调控生长发育等诸多潜在的功能, 需要进一步发掘并解析其作用机理。
在我们先前的工作中, 鉴定了水稻CNGCs共有16个成员, 进一步的非生物胁迫的诱导模式分析发现(_)受多种非生物胁迫诱导上调表达[16]。为了进一步验证其功能, 本研究构建了超表达载体以及敲除载体, 利用农杆菌介导的遗传转化法获得转基因材料, 在T1代进行稳定繁育时发现突变体植株表现出持绿性好、茎秆粗壮、根系发达等抗倒伏性状, 为了进一步研究其抗倒伏性, 从T2代中分离到纯合植株, 调查了转基因植株的抗倒伏性, 田间植株表型, 农艺性状, 并分析了转基因材料的茎秆外观结构、茎秆强度、茎秆的解剖结构等与植株抗倒伏性的关系。此外, 还考察了转基因植株在苗期抵御干旱胁迫的能力。本研究结果揭示了水稻基因可能在抗倒伏及抗旱方面有潜在作用, 为培育抗倒伏抗旱的水稻新品种提供了理论基础及新的种质资源。
1 材料与方法
1.1 试验材料
以粳稻野生型日本晴(spp.)为背景材料, 进行遗传转化。转化用的农杆菌为EHA105菌种, 原核感受态为大肠杆菌DH5α菌株。PGEM-Teasy载体(Promega)、PTGR质粒、载体及载体均由实验室提供。DNA marker (DL2000)、逆转录酶、反转录试剂盒(TaKaRa Prime Script RT reagent Kit with gDNA Eraser)购买于TaKaRa公司; Easy酶、T4-DNA连接酶、2 K DNA marker (Trans 2K)购买于北京全式金生物技术有限公司; 植物RNA提取试剂盒购于普洛麦格(北京)生物技术有限公司; MS培养基粉末购于武汉天源慧达生物科技有限公司; 纤维素(CLL)含量检测试剂盒、木质素含量检测试剂盒(紫外比色法)、半纤维素含量检测试剂盒(微量法)购于生工生物工程(上海)股份有限公司, 植物番红染绿试剂盒购自武汉塞维尔生物科技有限公司, 丙二醛含量检测试剂盒、脯氨酸含量检测试剂盒购自索莱宝科技有限公司。
1.2 试验方法
1.2.1 超表达载体构建 取幼嫩野生型日本晴水稻叶片, 提取RNA并反转录成cDNA。以cDNA为模板, 设计扩增引物(OsCNGC10-F/OsCNGC10-R)将目的基因片段进行PCR扩增(表1); 将产物与PGEM-Teasy载体连接, 将连接产物转化至大肠杆菌感受态中培养, 挑选克隆进行阳性鉴定, 回收阳性质粒; 设计带载体接头的引物(OsCNGC10-Flag-F/OsCNGC10-Flag-R), 以回收的阳性质粒为模板进行PCR扩增带载体接头的基因; 使用限制性核酸内切酶(I、HI)将载体双酶切, 利用诺维赞的同源重组酶将带接头的目的基因和双酶切后线性化的载体In-fusion连接, 得到重组载体()。

表1 本研究所用核苷酸序列及相应引物
1.2.2 敲除载体构建 利用华中农业大学开发的CRISPR-P 2.0 (CRISPR-P v2.0 hzau.edu.cn)设计的sgRNA序列(sgRNA1: 3'-TCAAGAGGCAG AGAACCGTG-5'; sgRNA2: 3'-CACGGTTCTCTGCCTCTT GA-5'); 设计获得短片段所需引物(L5AD5-F/CNGC10- gRNA1-U3R、CNGC10-gRNA1-U3F/CNGC10-gRNA2- U3R、CNGC10-gRNA2-U3F/L5AD5-R、gRNA2-U3F/ L5AD5-R), 以PTGR质粒做模板, 进行3组PCR扩增, 得到3个短片段PCR产物。再设计串联结构所需引物(S5AD-F/S5AD-R), 将3个PCR产物作为模板, 再次进行PCR扩增, 得到串联结构。使用限制性核酸内切酶I将pRGEB32载体进行双酶切, 再利用同源重组酶进行In-fusion连接, 得到重组终载体。
1.2.3 基因表达量分析 取幼嫩野生型日本晴水稻叶片提取RNA, 利用TaKaRa提供的反转录酶试剂盒, 对抽提后的RNA样品反转录成cDNA。设计RT-qPCR引物, 以(,)作为内参基因, 于CFX Connect Real-Time System (Bio-Rad)进行RT-qPCR分析, 采用2–∆∆CT计算基因的相对表达量, 每个样本设置3次生物学重复。
1.2.4 编辑植株的突变类型检测鉴定 为检测编辑植株中基因的突变情况, 分别在2个靶位点两端设计引物OsCNGC10-target1-F/OsCNGC10-target1-R和OsCNGC10-target2-F/OsCNGC10-target2-R, 提取基因编辑材料的T2代幼苗叶片DNA作为模板, 进行PCR扩增, 扩增产物送生工生物工程(上海)股份有限公司进行测序, 以野生型日本晴水稻 DNA 为模板的扩增产物片段序列为参照, 分析编辑植株的基因突变类型。
1.2.5 转基因植株农艺性状考察 转基因植株幼苗经鉴定后移栽至湖北大学生命科学学院试验基地, 依据当地常规稻田管理方式进行水肥管理、病虫草害防除。选取成熟期长势一致的超表达植株以及突变体水稻植株各10株, 考察株高、有效穗、穗长、有效分蘖、每穗粒数、千粒重、经济产量等农艺性状。
1.2.6 茎秆形态分析 在水稻始穗后15 d, 随机选取转基因植株和野生型日本晴各10株。测量所有单茎地上基部第一、二节的节间长, 节粗及壁厚; 并选取节间上、中、下3个点, 利用数显式游标卡尺分别测量茎秆长轴、短轴的茎粗; 将茎秆从中部纵切, 均匀选取2点, 利用数显式游标卡尺测量壁厚。
1.2.7 茎秆强度测定 水稻始穗后15 d, 每株系选取代表性植株5株调查, 用茎秆强度测定仪(DIK-7400, 日本)测定转基因植株和野生型日本晴的茎秆强度。选取单株水稻所有茎秆, 在茎秆中部捆扎, 测量时保持茎秆强度测定仪垂直于茎秆中部捆扎点, 缓慢均匀用力, 直到茎秆与地面成45度, 记录仪器峰值(单位: 牛顿 N), 每株测量3次。
1.2.8 茎秆细胞壁组织切片观察 将水稻茎秆基部第3节切成1~2 mm的薄片, 置于载玻片上, 加一滴植物番红染色液, 染色1 min; 吸去植物番红, 加蒸馏水清洗3次,吸去多余水分; 加一滴植物固绿染液, 染色30 s; 吸去植物固绿, 加蒸馏水清洗3次, 吸去多余水分; 加水封片, 吸去多余水分后置于生物显微镜下观察。
1.2.9 茎秆细胞壁组织成分分析 根据Van Soest等[17]方法稍加修改, 使用生工生物工程(上海)股份有限公司的试剂盒测定细胞壁组分及含量。选取抽穗期水稻材料, 将茎秆与叶鞘分离, 取每株主茎杆, 于电热鼓风干燥箱中105℃杀青15 min, 80℃烘干2 h, 50℃烘干至恒重; 将烘干的水稻茎秆剪碎, 使用磨样仪磨成粉末, 过40目筛, 装入2.0 mL EP管中, 干燥条件保存待用。
1.2.10 幼苗期干旱胁迫处理 选取T2代超表达植株, 突变体与野生型日本晴为试验材料, 种子经浸泡、催芽后, 利用1/2 MS培养基培养14 d至四叶一心期, 挑选生长状态良好、长势一致的植株幼苗移栽至温室, 缓苗一周。倒掉穴盘中的多余营养液, 断水, 每个处理设3次重复。胁迫15 d后, 每个处理选取6株用于观察幼苗表型, 处理后统计幼苗存活率。
1.2.11 生理生化指标测定 采用北京索莱宝科技有限公司的丙二醛含量检测试剂盒、脯氨酸含量检测试剂盒进行测定。
1.2.12 数据处理与分析 采用IBM SPSS 25对本文试验数据进行差异显著性分析。
2 结果与分析
2.1 OsCNGC10超表达载体获得
从水稻基因组数据库RGAP下载基因的相关序列, 从水稻日本晴克隆出的CDS序列, 利用同源重组酶将和线性化后的进行In-fusion连接, 得到重组终载体。将接连产物转化到大肠杆菌中, 挑单克隆摇菌, 经琼脂糖凝胶电泳检测条带正确后, 送菌液测序。将测序结果正确的返样质粒转化到农杆菌中,挑单克隆摇菌, 并进行菌落PCR。挑选菌落PCR结果中条带大小正确的菌液–80℃保存(图1)。
2.2 OSCNGC10敲除载体获得
本研究所用双靶点敲除载体的构建方式是在华中农业大学谢卡斌教授研究团队开创的tRNA串联法的基础上加以调整[18]。依据DNA序列以及基因结构, 设计2个gRNA合成接头引物以及gRNA连入表达载体所需的接头引物(表1); 采用infusion重组的方法将串联好的PCR产物到线性化的载体中。将上述反应产物热激转化大肠杆菌DH5α, 挑单克隆进行阳性检测并测序, 保存阳性菌株和质粒, 并将阳性质粒转化根癌农杆菌EHA105感受态(图2)。
图1 OsCNGC10超表达载体菌落PCR
M: Trans 2K; 1~8: 菌落PCR片段。
M: Trans 2K; 1–8: the colony PCR fragments.
图2 OsCNGC10敲除终载体菌落PCR检测
M: Trans 2K; 1~8: 菌落PCR片段。
M: Trans 2K; 1–8: the colony PCR fragments.
2.3 OsCNGC10转基因材料获得及阳性鉴定
利用农杆菌介导的水稻遗传转化, 分别获得基因的过表达植株12株, 敲除植株11株。用潮霉素引物(OsHyg-F/OsHyg-R)对该23株转化幼苗进行PCR阳性检测, 得到8株超表达苗和8株敲除苗(图3- A)。经过表达量分析以及靶点解码分析, 最终选取表达量相对较高的超表达株系(图3-B)以及单碱基缺失的纯合突变株系(图3-C)作为后续试验材料, 并自交繁育得到纯合材料。
2.4 OsCNGC10转基因材料田间表型鉴定
对转基因材料全生育期表型观察发现, 与野生型相比, 转基因植株表型在抽穗期和结实期都有较大差异(图4-A, B)。株系在抽穗期前生长缓慢, 其株高显著低于和WT。但当植株发育后期尤其是抽穗期后长势明显提高, 株高显著高于野生型和过表达株系, 表现出持绿性好、茎秆粗壮和抗倒伏性强的优势(图4-C, D)。
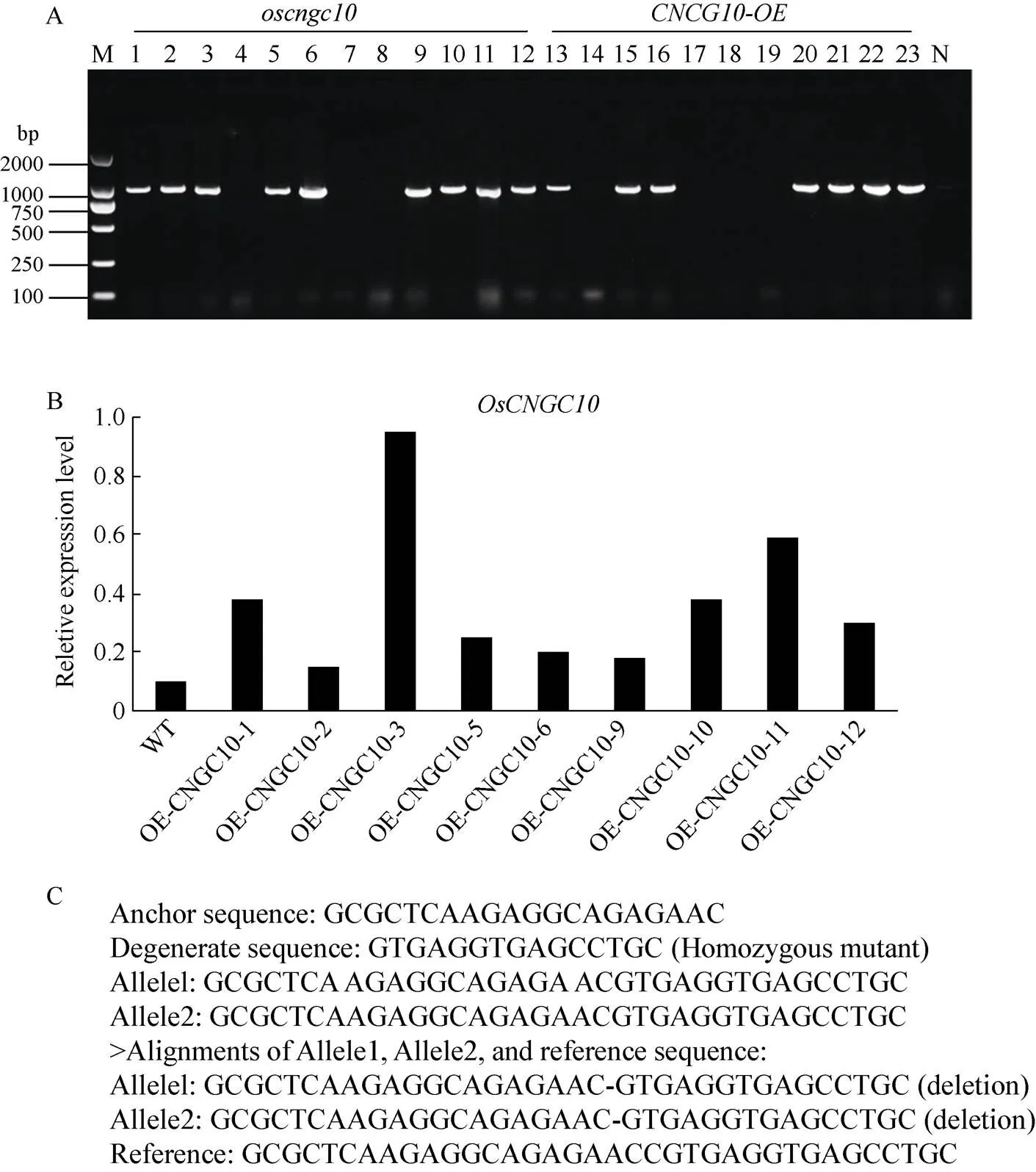
图3 T0代转基因植株的阳性鉴定
(A): 转基因植株阳性鉴定; (B): 超表达株系表达量分析; (C): 敲除株系靶点解码分析。M: Trans 2K; N: 阴性对照。
(A): positive identification of transgenic plants; (B): the expression analysis of the overexpression lines; (C): target decoding analysis in knockout lines. M: Trans 2K; N: the negative control.

图4 转基因植株及野生型(WT)株型
(A): 转基因材料以及野生型田间抽穗期表型; (B): 转基因材料以及野生型田间成熟期表型; (C): 转基因材料以及野生型抽穗期单株表型; (D): 转基因材料以及野生型成熟期单株表型。
(A): transgenic materials and field phenotypes of wild type at heading stage; (B): transgenic materials and wild type phenotypes at field maturity stage; (C): transgenic materials and single plant phenotypes of wild type at heading stages; (D): transgenic materials and single plant phenotypes of wild type at maturity stage.
2.5 转基因植株茎秆特性以及抗倒伏性分析
为了进一步探究在水稻抗倒伏方面的特性, 对同处于齐穗期15 d左右的转基因材料进行抗倒伏性测定。取该时期的不同材料茎秆测量基部节间间距, 并观察其根部生长差异。结果表明: 与野生型日本晴WT相比,地上三节节间距变短(图5-A), 根长显著变长, 根冠显著变大(图5-B); 且茎壁厚度显著增加, 茎秆强度显著增强, 而相较于WT则无显著差别(表2)。

图 5 转基因植株及野生型(WT)基部节间形态
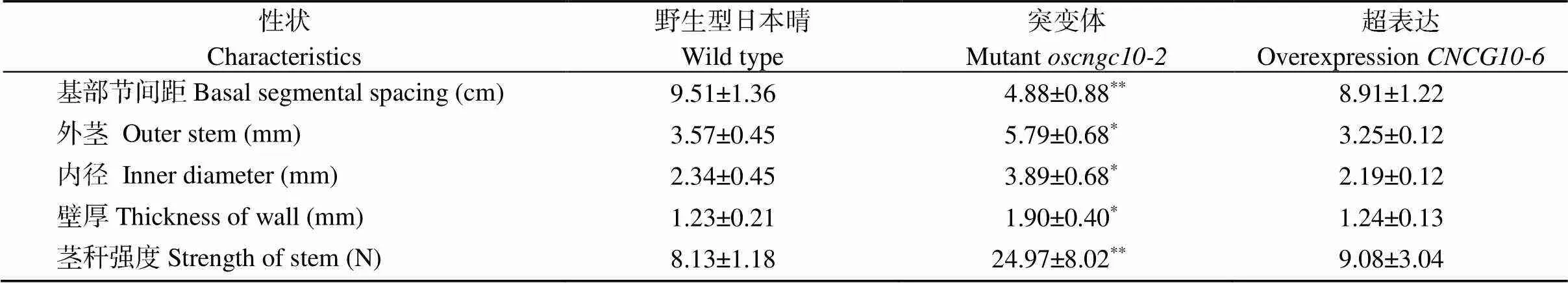
表2 转基因植株与野生型茎秆强度分析
**表示在0.01概率水平显著相关;*表示在0.05概率水平显著相关。
**: the correlation is significant at the 0.01 probability level;*: the correlation is significant at the 0.05 probability level.
2.6 茎秆细胞壁组织切片观察
为进一步探究株系茎秆抗倒伏能力的提升是否与细胞壁结构改变有关, 对同处于抽穗期的转基因材料取倒二节进行徒手切片观察。利用植物番红染绿进行染色, 在光学显微镜下成像, 并截取对应位置于体视镜下放大, 观察细胞壁厚(CWT)和秆壁厚度(SWT)。结果发现,植株茎秆细胞壁的CWT和SWT均显著高于野生型WT, 而则为三者最低(图6)。因此推测, 敲除引起细胞壁结构的改变, 细胞壁厚度和杆壁厚度增加, 导致了敲除植株茎秆特性的改变从而提高了抗倒伏能力。
2.7 茎秆细胞壁组织成分分析
研究认为, 水稻茎秆细胞壁的主要成分及其含量与水稻抗倒伏能力之间有密切联系。水稻茎秆物质含量丰富且复杂, 含有组成细胞壁的木质素、纤维素、半纤维素等。为了研究转基因材料的抗倒伏性差异是否由于细胞壁组分变化引起, 本试验对转基因材料成熟期的茎秆细胞壁主要成分(木质素、纤维素、半纤维素)的含量进行测定。结果表明, 与野生型相比, 在每1 g水稻茎秆粉末中,的木质素含量最高, 且显著高于WT, 而木质素含量最低。转基因材料与野生型相比, 纤维素以及半纤维素含量则无显著差异(图7)。由此推测, 敲除植株茎秆强度增强的原因, 可能是因为敲除该基因影响了控制木质素合成相关途径, 从而引起了木质素合成的大量增加而使其茎秆变粗, 抗倒伏性增强。
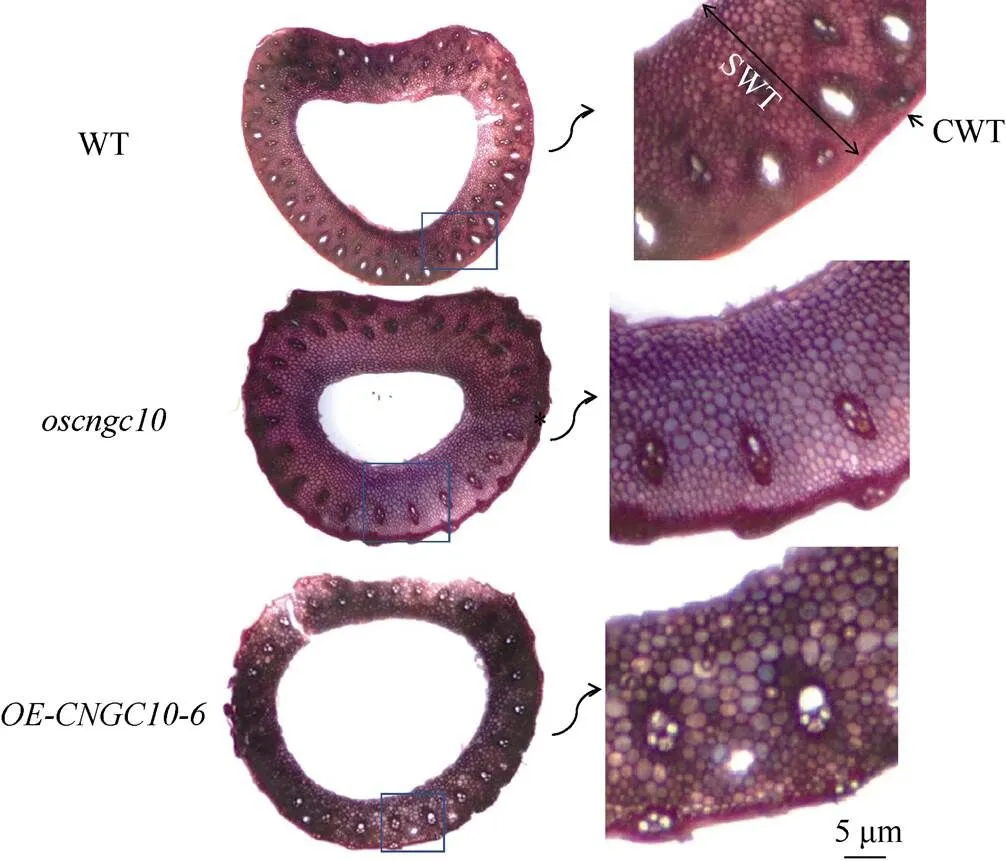
图6 转基因植株与野生型(WT)组织切片显微镜观察
CWT: 茎壁厚度; SWT: 秆壁厚度。
CWT: cell wall thickness; SWT: straw wall thickness.
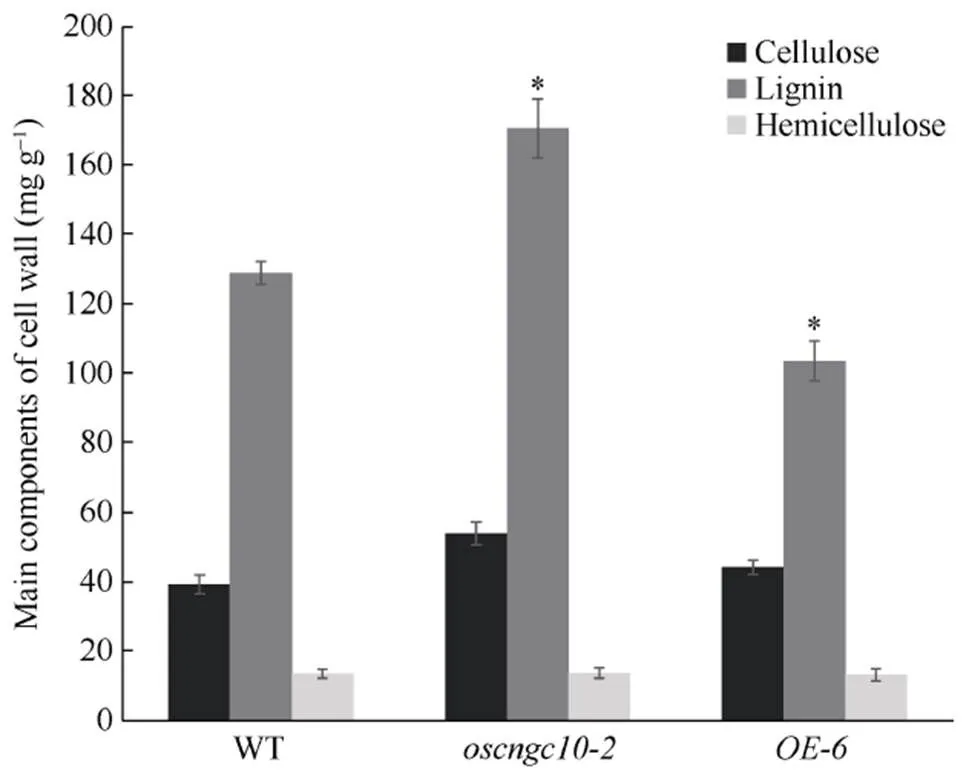
图7 转基因植株与野生型(WT)细胞壁主要成分分析
Cellulose: 纤维素; Lignin: 木质素; Hemicellulose: 半纤维素。
*表示在0.05概率水平显著相关。
*: the correlation is significant at the 0.05 probability level.
2.8 OsCNGC10转基因材料农艺性状分析
对转基因材料生育期调查发现, 同时移栽的秧苗,营养生长期要比和WT更长, 孕穗期推迟, 全生育期为137 d, 比野生型长7 d (表3)。而过表达材料与野生型相比生育期缩短了9 d。成熟期农艺性状统计分析结果显示, 突变体除分蘖数降低以外, 其株高、穗长、每穗粒数、一次枝梗数、二次枝梗数、千粒重和理论产量均显著高于野生型日本晴和过表达材料。
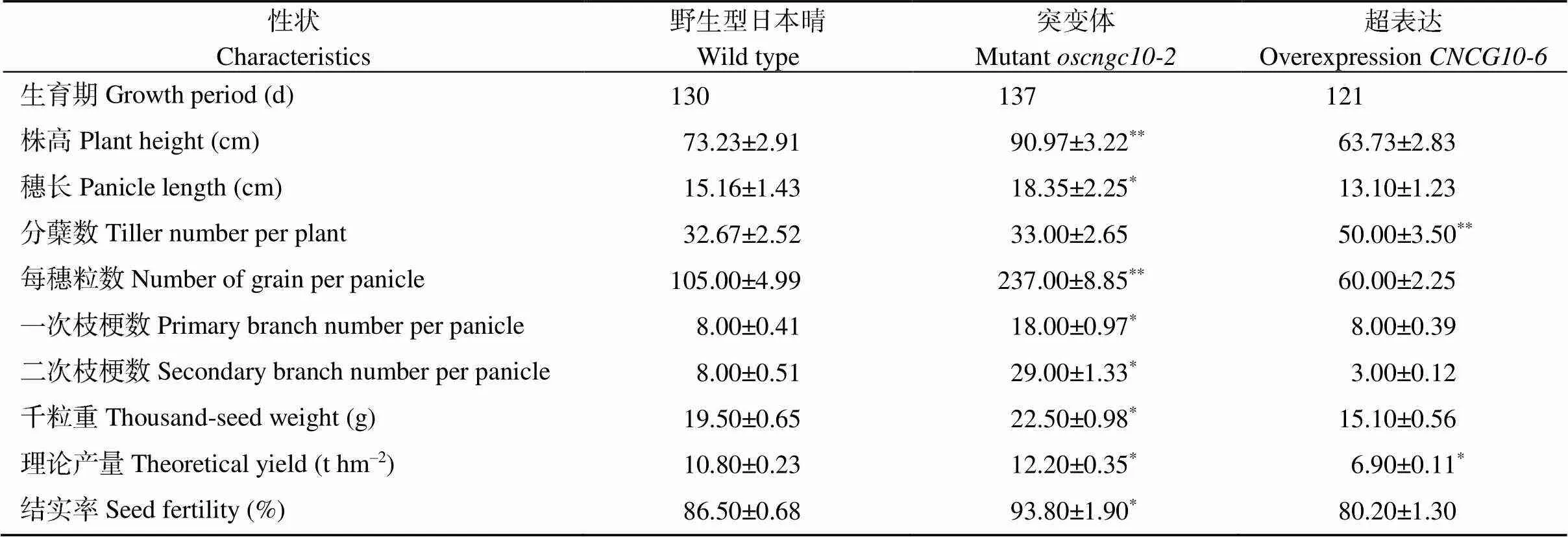
表3 转基因植株与野生型(WT)农艺性状分析
**表示在0.01概率水平显著相关;*表示在0.05概率水平显著相关。
**: the correlation is significant at the 0.01 probability level;*: the correlation is significant at the 0.05 probability level.
2.9 OsCNGC10调控水稻抗旱性表型鉴定
挑选生长状态较好且长势一致的植株幼苗移栽至温室, 待缓苗一周后倒掉穴盘中的多余营养液, 进行断水干旱处理。干旱胁迫处理15 d后, 观察发现,植株叶片干枯卷曲, 部分植株死亡; 但过表达材料仅有少数几片叶卷曲, 大部分植株叶片舒展, 生长状态良好(图8-A)。同时, 干旱胁迫后野生型以及转基因材料的死亡率统计表明: 相对于野生型, 超表达材料死亡率更低, 而敲除材料死亡率则高于野生型(图8-B)。胁迫结果表明:基因功能缺失导致植株对干旱的胁迫承受能力降低, 而过表达则提高了水稻苗期抗旱能力。
2.10 水稻叶片Pro、MDA含量测定分析
植物在遭受干旱胁迫时, 植株体内抵御逆境的相关成分含量会发生变化, 如脯氨酸(Pro)、丙二醛(MDA)等。为探究在干旱胁迫下对水稻叶片Pro和MDA含量的影响, 对干旱胁迫后水稻叶片中Pro和MDA含量进行了测定。测定结果发现在干旱处理15 d后, 每1 g叶片中,的Pro含量显著低于野生型, 过表达材料中Pro含量相对于野生型显著升高(图9-A)。同时, 干旱胁迫15 d后, 每1 g水稻叶片中MDA含量显著降低, 而叶片中MDA含量则显著升高(图9-B)。结果表明, 在干旱胁迫下,基因缺陷型植株无法形成足够的游离脯氨酸, 同时干旱胁迫下该基因缺陷型植株体内MDA含量积累速度加快。而过表达植株在遭受干旱胁迫时, 体内游离Pro含量大量升高, 且MDA积累速度相对变慢, 这说明了正向调控水稻苗期抗旱性。
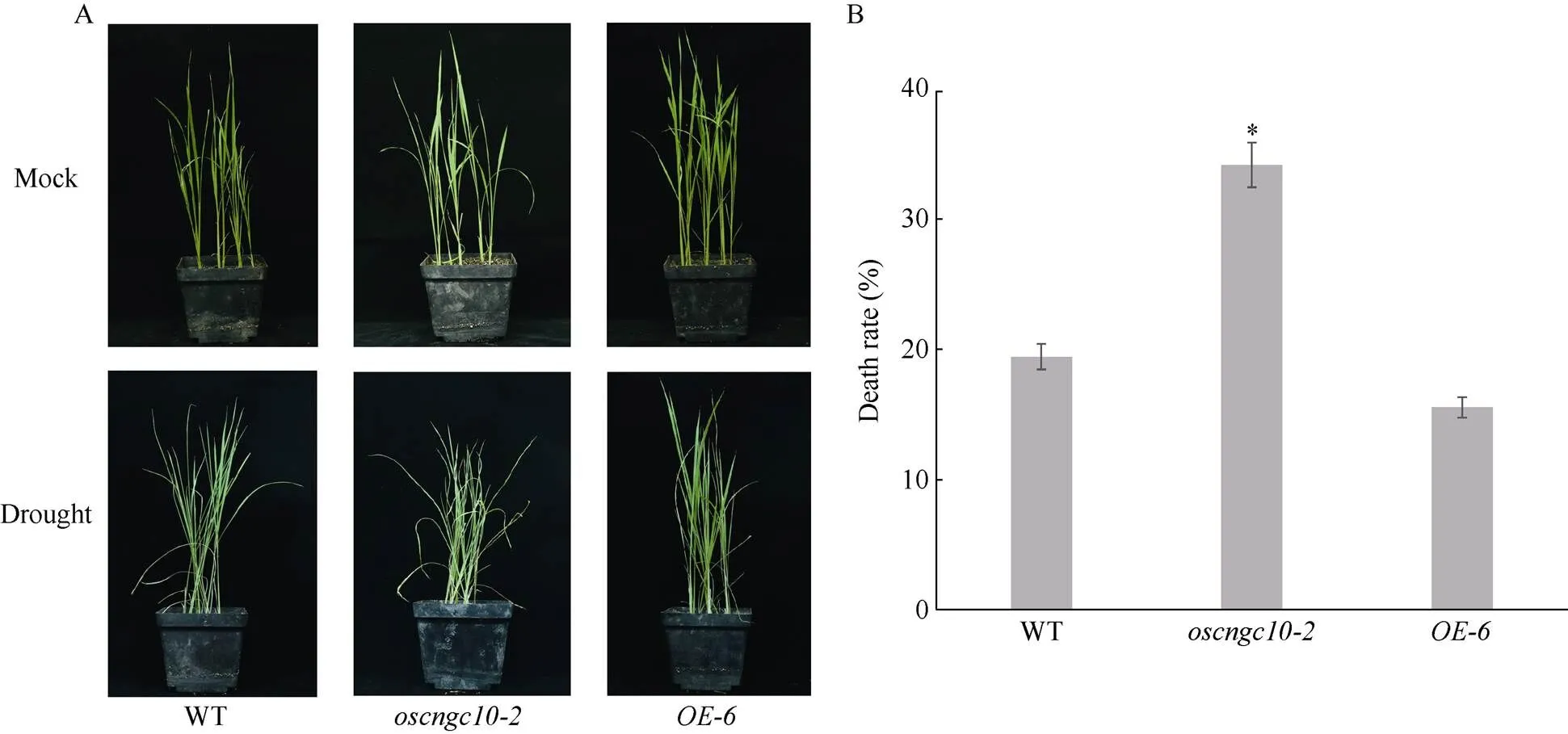
图8 转基因植株与野生型(WT)苗期干旱胁迫15 d表型以及存活率
*表示在0.05概率水平显著相关。标尺为20 cm。*: the correlation is significant at the 0.05 probability level. Bar: 20 cm.
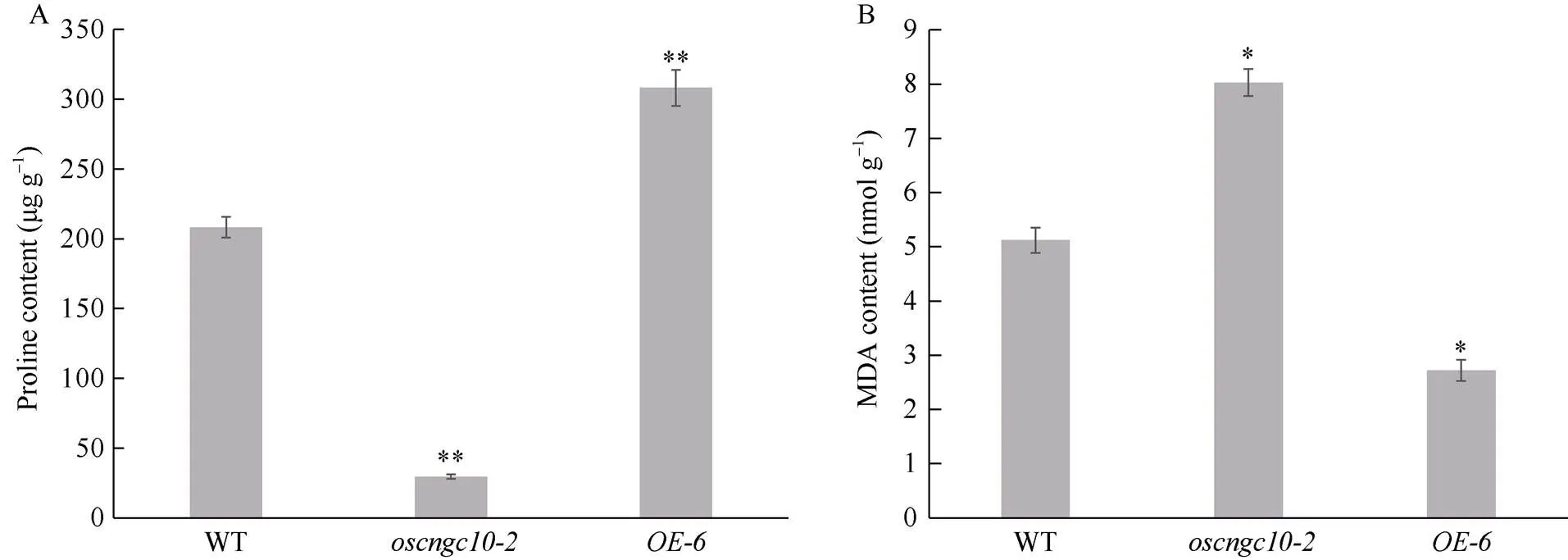
图9 转基因植株与野生型(WT)苗期干旱胁迫15 d后Pro及MDA含量
A: 植株叶片脯氨酸含量; B: 植株叶片丙二醛含量。***表示在0.01概率水平显著相关;*表示在0.05概率水平显著相关。
A: proline content in the leaves of the plants; B: MDA content in the leaves of the plants.**: the correlation is significant at the 0.01 probability level;*: the correlation is significant at the 0.05 probability level.
3 讨论
近些年来, 由于全球气候变暖和环境污染加剧, 全球粮食产量及储量也有了新的需求。如何提升作物面对诸如倒伏, 干旱等非生物胁迫的能力, 将经济损失降到最低, 是近些年来植物领域研究的热点之一。
倒伏对作物的品质及产量有重要影响, 通过基因工程手段选育具有抗倒伏能力的水稻品种对水稻育种具有重要意义。研究表明, 节间数、节间长、茎粗、茎壁厚以及大小维管束数目等形态性状均与抗倒伏能力有关[19]。茎基粗、茎基厚与茎秆强度呈正相关, 增加节间茎粗以及茎壁厚度可以有效提高水稻抗倒伏能力[20]。Yano等[21]将携带基因的植株与带有基因的水稻材料聚合杂交构建近等基因系, 获得了茎秆强度增强而产量不变的水稻材料。在本试验中, 着重研究了水稻茎秆特性。结果显示, 敲除植株茎秆强度显著提高, 且壁厚增加, 茎秆所含的木质素含量也增加。由此推测, 敲除会影响木质素合成相关途径, 但需要进一步试验探索。株高作为植物结构的重要组成部分之一, 与水稻的抗倒伏能力密切相关[22]。但有研究认为株高并不是影响水稻倒伏的最主要因素, 高秆不是倒伏的直接原因, 水稻的抗倒能力在品种之间存在不一致性, 高秆不一定易倒伏, 矮秆不一定抗倒。在适宜的栽培条件下, 并不是株高越高, 倒伏指数就越高[23-25]。与野生型日本晴相比, 突变体水稻株高在抽穗期前矮于野生型, 但同处于抽穗结实期时, 突变体植株株高更高, 且其抗倒伏能力增强。此外, 以往的大多数研究在注重矮秆抗倒伏这一性状时, 抛弃了产量这一重要因素, 本研究后续试验结果显示, 在增强了高秆水稻的抗倒伏能力的同时, 稻米产量也得到了提升, 这对水稻种质资源创新提供了一个很好的思路。
作为一种固着生物, 水稻极易受到各种非生物和生物胁迫带来的危害。干旱对水稻产量造成了严重影响, 对水稻的供应构成了威胁。通过现代分子生物学技术提高水稻对干旱胁迫的耐受性, 成为当前维持粮食安全行之有效的途径之一[26-27]。水稻的抗旱性是由多种类型的基因控制的复杂性状, 目前已发现一些基因可以在干旱、盐、低温、高温等非生物胁迫条件下调控水稻产量, 超表达(或敲除)这些基因可以提高转基因水稻的抗性及产量[28]。Hu等[29]研究认为通过基因工程手段聚合或导入外源抗旱基因可以提高水稻抗旱能力。Zhang等[30]将番茄中基因转入水稻中, 研究发现过表达可以显著提高水稻耐旱性, 且不影响转基因水稻的生长发育。李兆伟等[31]通过基因编辑对突变体材料的耐旱型进行考察, 表明转录因子OsNAC2d正调控水稻响应干旱胁迫。Xu等[32]研究认为超表达能够上调木质素合成基因和 ABA 信号通路关键基因来提高水稻的抗旱性, 并最终提高产量。杨建昌等[33]研究认为, 耐旱性更强的水稻品种的抗氧化系统更加强大, 能够快速清除积累的MDA, 因此, 能否快速消除积累的MDA可以作为水稻耐旱性的检测标准之一。同时, 以Pro为代表的一类渗透调节物质能够缓解干旱等非生物胁迫对植物造成的伤害, 从而维持植物细胞膨压和正常生理活动[34]。本试验前期通过PEG模拟干旱下OsCNGCs基因家族的表达模式分析表明,受PEG胁迫诱导上调明显[16]。苗期干旱胁迫试验结果表明, 干旱胁迫处理15 d后,植株叶片干枯卷曲, 部分植株死亡; 但过表达材料仅有少数几片叶卷曲, 大部分植株叶片舒展, 生长状态良好。同时,植株无法形成足够的游离Pro, 且植株体内MDA含量积累速度加快; 而过表达植株在遭受干旱胁迫时, 体内游离Pro含量大量升高, 且MDA积累速度相对变慢, 这说明了正向调控水稻苗期抗旱性。
植物CNGCs功能多样且复杂, 目前在水稻中的研究尚且较少。关于是如何调控水稻的抗倒伏性和抗旱性尚不清楚, 有待进一步研究。
[1] 国家统计局关于2022年粮食产量数据的公告. 中国信息报, (2022-12-13) (001). Announcement of the National Bureau of Satistics on Grain Production Data for 2022. China Information News, (2022-12-13) (001).
[2] Lang Y Z, Yang X D, Wang M E, Zhu Q S. Effects of lodging at different filling stages on rice yield and grain quality., 2012, 19: 315–319.
[3] Chin, K, Moeder W, Yoshioka K. Biological roles of cyclic-nucleotide-gated ion channels in plants: what we know and don't know about this 20 member ion channel family., 2009, 87: 668–677.
[4] Ma W, Qi Z, Smigel A, Walker R K, Verma R, Berkowitz G A. Ca2+, cAMP, and transduction of non-self perception during plant immune responses., 2009, 106: 20995–21000.
[5] Schuurink R C, Shartzer S F, Fath A, Jones R L. Characterization of a calmodulin-binding transporter from the plasma membrane of barley aleurone., 1998, 95: 1944–1949.
[6] Arazi T, Sunkar R, Kaplan B, Fromm H. A tobacco plasma membrane calmodulin-binding transporter confers Ni2+tolerance and Pb2+hypersensitivity in transgenic plants., 1999, 20: 171–182.
[7] Talke I N, Blaudez D, Maathuis F J, Sanders D. CNGCs: prime targets of plant cyclic nucleotide signalling?, 2003, 8(6): 286–293.
[8] Kaplan B, Sherman T, Fromm H. Cyclic nucleotide-gated channels in plants., 2007, 581: 2237–2246.
[9] Yuan Q, Ou-Yang S, Liu J, Suh B, Cheung F, Sultana R, Lee D, Quackenbush J, Buell C R. The TIGR rice genome annotation resource: annotating the rice genome and creating resources for plant biologists., 2003, 31: 229–233.
[10] Ma W, Ali R, Berkowitz A G. Characterization of plant phenotypes associated with loss-of-function of AtCNGC1, a plant cyclic nucleotide gated cation channel., 2006, 44: 494–505
[11] 朱天全. 拟南芥和基因在耐热和抗病中的功能研究. 南京农业大学硕士学位论文, 江苏南京, 2020. Zhu T Q. Functional Studies ofandGenes in Heat Tolerance and Disease Resistance. MS Thesis of Nanjing Agricultural University, Nanjing, Jiangsu, China, 2020 (in Chinese with English abstract).
[12] Tan Y Q, Yang Y, Zhang A, Gu L L, Sun S J, Xu W, Wang L, Liu H, Wang Y F. Three CNGC family members, CNGC5, CNGC6, and CNGC9, are required for constitutive growth ofroot hairs as Ca2+-permeable channels., 2019, 1: 100001.
[13] Jin Y, Jing W, Zhang Q, Zhang W. Cyclic nucleotide gated channel 10 negatively regulates salt tolerance by mediating Na+transport in.2015, 128: 211–220.
[14] Meral T O, Claudia R, Elizabeth B, Stephanie R, Amanda M, Sabine F, Candace T M, Rosager P L, Rui M, Jeffrey F H, Wu K Q. Cyclic nucleotide gated channels 7 and 8 are essential for male reproductive fertility., 2013, 8: e55277.
[15] Tunc-Ozdemir M, Tang C, Ishka M R, Brown E, Groves N R, Myers C T, Rato C, Poulsen L R, McDowell S, Miller G, Mittler R, Jeffrey F H. A cyclic nucleotide-gated channel (CNGC16) in pollen is critical for stress tolerance in pollen reproductive development., 2013, 161: 1010–1020.
[16] 周棋, 胡琴, 杜雪竹, 巫燕飞, 盛锋. 水稻CNGCs家族的鉴定及非生物胁迫诱导表达模式分析. 分子植物育种, 2023, 21: 6625–6637. Zhou Q, Hu Q, Du X Z,Wu Y F, Sheng F. Genome wide identification and expression analysis of CNGCs gene family in response to abiotoc stresses in rice., 2023, 21: 6625–6637 (in Chinese with English abstract).
[17] Van Soest P J, Robertson J B, Lewis B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition., 1991, 74: 3583–3597.
[18] Xie K B, Minkenberg B, Yang Y. Boosting CRISPR/Cas9 multiplex editing capability with the endogenous tRNA-processing system., 2015, 112: 3570–3575.
[19] 龚金龙, 邢志鹏, 胡雅杰, 张洪程, 戴其根, 霍中洋, 许轲, 魏海燕, 高辉. 籼、粳超级稻茎秆抗倒支撑特征的差异研究. 中国水稻科学, 2015, 29: 273–281. Gong J L, Xing Z P, Hu Y J, Zhang H C, Dai Q G, Huo Z Y, Xu K, Wei H Y, Gao H. Differences in stem resistance to topside support betweenandsuper rice., 2015, 29: 273–281 (in Chinese with English abstract).
[20] 雷小龙, 刘利, 刘波, 黄光忠, 马荣朝, 任万军. 杂交籼稻F优498机械化种植的茎秆理化性状与抗倒伏性. 中国水稻科学, 2014, 28: 612–620. Lei X L, Liu L, Liu B, Huang G Z, Ma R C, Ren W J. Physicochemical properties and lodging resistance of stem in mechanized planting of hybridrice F You 498., 2014, 28: 612–620 (in Chinese with English abstract).
[21] Yano K, Ookawa T, Aya K, Ochiai Y, Hirasawa T, Ebitani T, Takarada T, Yano M, Yamamoto T, Fukuoka S, Wu J, Ando T, Ordonio R L, Hirano K, Matsuoka M. Isolation of a novel lodging resistance QTL gene involved in strigolactone signaling and its pyramiding with a QTL gene involved in another mechanism., 2015, 8: 303–304.
[22] 张云辉, 张所兵, 林静, 汪迎节, 方先文. 水稻株高基因克隆及功能分析的研究进展. 中国农学通报, 2014, 30(12): 1–7. Zhang Y H, Zhang S B, Lin J, Wang Y J, Fang X W. Research progress on cloning and functional analysis of plant height genes in rice (L.).. 2014, 30(12): 1–7 (in Chinese with English abstract).
[23] 万宜珍, 马国辉. 超级杂交稻抗倒生理与形态机能研究: II. 培矮64S/E32与汕优63茎秆抗倒力学差异. 湖南农业大学学报(自然科学版), 2003, (2): 92–94. Wan Y Z, Ma G H. Studies on the Physiological and Morphological Functions of Super Hybrid Rice in Resistance to overpour: II. Differences in stem resistance to overpour between Peiai 64S/ E3 2 and Shanyou 63.(Nat Sci Edn), 2003, (2): 92–94 (in Chinese with English abstract).
[24] 钟代彬, 罗利军, 梅捍卫, 王一平, 余新桥, 应存山, 黎志康, 郭龙彪. 水稻主茎总叶数及其相关性状的QTL分析. 中国水稻科学, 2001,15: 8–13. Zhong D B, Luo L J, Mei H W, Wang Y P, Y u X Q, Ying C S, Li Z K, Guo L B. QTL analysis of total leaf number and related traits in the main stem of rice., 2001, 15: 8–13 (in Chinese with English abstract).
[25] 饶玉春, 李跃, 董国军, 曾大力, 钱前. 水稻抗倒伏研究进展. 中国稻米, 2009, (6): 15–19. Rao Y C, Li Y, Dong G J. Zeng D L, Qian Q. Lodging resistance of rice research progress., 2009, (6): 15–19 (in Chinese with English abstract).
[26] Kothari K S, Dansana P K, Giri J, Tyagi A K. Rice Stress Associated Protein 1 (OsSAP1) interacts with aminotransferase (OsAMTR1) and pathogenesis-related 1a protein (OsSCP) and regulates abiotic stress responses., 2016, 7: 1057.
[27] Lee S C, Lee M Y, Kim S J, Jun S H, An G, Kim S R. Characterization of an abiotic stress-inducible dehydrin gene,, in rice (L.)., 2005, 19: 212–218.
[28] 段俊枝, 杨翠萍, 王楠, 齐学礼, 冯丽丽, 燕照玲, 齐红志, 陈海燕, 张会芳, 卓文飞, 李莹. 利用基因工程技术提高非生物胁迫下水稻产量的研究进展. 中国稻米, 2023, 29(3): 15–23. Duan J Z, Yang C P, Wang N, Qi X L, Feng L L, Yan Z L, Qi H Z, Chen H Y, Zhang H F, Zhuo W F, Li Y. Progress on improving rice yield under abiotic stress by genetic engineering., 2023, 29(3): 15–23 (in Chinese with English abstract).
[29] Hu H, You J, Fang Y, Zhu X Y, Qi Z Y, Xiong L Z. Characterization of transcription factor gene SNAC2 conferring cold and salt tolerance in rice., 2010, 72: 567–568.
[30] Zhang Z, Li F, Li D, Zhang H, Huang R. Expression of ethylene response factor JERF1 in rice improves tolerance to drought., 2010, 232: 765–774.
[31] 李兆伟, 莫祖意, 孙聪颖, 师宇, 尚平, 林伟伟, 范凯, 林文雄.基因编辑水稻突变体的创建及其对干旱胁迫的响应.作物学报, 2023, 49: 365–376. Li Z W, Mo Z Y, Sun C Y, Shi Y, Shang P, Lin W W, Fan K, Lin W X. Construction of rice mutants by gene editing ofand their response to drought stress., 2023, 49: 365–376 (in Chinese with English abstract).
[32] Wu W Y, Tang W S, Wang C X, Ge L H, Chen M. SiMYB56 confers drought stress tolerance in transgenic rice by regulating lignin biosynthesis and ABA signaling pathway., 2020, 11: 785.
[33] 杨建昌, 王志琴, 朱庆森. 水稻品种的抗旱性及其生理特性的研究. 中国农业科学, 1995, 28(5): 65–72. Yang J C, Wang Z Q, Zhu Q S, Study on drought resistance and physiological characteristics of rice varieties., 1995, 28(5): 65–72 (in Chinese with English abstract).
[34] Xu L X, Han L B, Huang B R. Antioxidant enzyme activities and gene expression patterns in leaves of Kentucky bluegrass in response to drought and post-drought recovery., 2011, 136: 247–255.
Mechanism of loding residence and drought tolerance ofgene in rice
ZHU Zhong-Lin1, WEN Yue1, ZHOU Qi1, WU Yan-Fei1, DU Xue-Zhu1,2,*, and SHENG Feng1,*
1School of Life Sciences, Hubei University / State Key Laboratory of Biocatalysis and Enzyme Engineering, Wuhan 430062, Hubei, China;2Hubei Hongshan Laboratory, Wuhan 430062, Hubei, China
Cyclic nucleotide-gated ion channels are ligand-gated cationic channels that exist in animals and plants, which are an important part of eukaryotic signaling cascades. In this study,(cyclic nucleotide-gated channel) gene in rice was used, and the overexpression vectorand the double-target knockout vectorwere constructed. The knockout and overexpression materials were obtained by Agrobacterium-mediated genetic transformation. Homozygous plantsandwere isolated from T2generation. The analysis of stem characteristics and lodging resistance of transgenic plants showed thathad enhanced stem strength and lodging resistance. Stem cell wall sections and tissue composition analysis showed thatincreased lodging resistance due to the increase of stem wall thickness, parenchyma cell abundance, and lignin content. The knockout ofincreased the lignin content and the abundance of stem-cell wall parenchyma cells. The overexpression ofreduced stem wall thickness, lignin content, and cell abundance in stem cell wall, while the knockdown ofincreased lignin content and increased the abundance of thin-walled cells in stem cell wall, suggesting thatwas associated with the composition of stem cell wall and negatively regulated lodging resistance in rice. T2generation field experiment indicated that compared with the wild type,significantly increased plant height, the effective panicle length, panicle number, seed setting rate, 1000-grain weight, and yield per plant. The results of drought stress at seedling stage showed that malondialdehyde (MDA) content accumulated rapidly indefective plants under drought stress and insufficient free proline (Pro) was formed, while the free Pro content inplants was significantly increased. Moreover, the MDA accumulation rate was relativelyslow, which preliminarily indicated thatpositively regulated the drought resistance at seedling stage. The results of this study indicated thatmight have a potential function in lodging resistance and drought resistance in rice, which providing a theoretical basis and new germplasm resources for the breeding lodging resistance and high yield of new rice varieties.
rice;; lodging resistance; drought tolerance; cell wall
10.3724/SP.J.1006.2024.32027
本研究由武汉市生物技术关键技术科技重大专项(2022021302024851)和粮食作物种质创新与遗传改良湖北省重点实验室开放课题项目(2018lzjj01)资助。
This study was supported by the Wuhan Municipal Key Technology Project of Biotechnology (2022021302024851) and the Hubei Provincial Key Laboratory of Grain Crop Germplasm Innovation and Genetic Improvement (2018LZJJ01).
盛锋, E-mail: shengfsk@163.com; 杜雪竹, E-mail: duxeuzhusk@163.com
E-mail: 1418369969@qq.com
2023-07-20;
2024-01-12;
2024-02-19.
URL: https://link.cnki.net/urlid/11.1809.S.20240219.1122.014
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
