外源物质浸种对迟播油菜越冬期抗寒性及产量的影响
2024-04-28王先领雷贻忠肖胜男厍惠洁段圣省徐正华周广生
王先领 姜 岳 雷贻忠 肖胜男 厍惠洁 段圣省 黄 铭 蒯 婕 汪 波 王 晶 赵 杰 徐正华 周广生
外源物质浸种对迟播油菜越冬期抗寒性及产量的影响
王先领 姜 岳 雷贻忠 肖胜男 厍惠洁 段圣省 黄 铭 蒯 婕 汪 波 王 晶 赵 杰 徐正华*周广生
华中农业大学植物科学技术学院/ 农业农村部长江中游作物生理生态与耕作重点实验室, 湖北武汉 430070
确保迟播油菜产量是压减长江流域双季稻区冬闲田的关键, 提高越冬期抗寒性、促进冬前干物质积累是增加迟播油菜产量的有效途径。播前外源物质浸种是提高越冬期抗寒性, 促进冬前快速生长的有效措施。试验选用早熟品种华油杂137, 设置清水(CK), 0.01 mmol L-1、0.05 mmol L–1、0.10 mmol L–1的甜菜碱(T1-1、T1-2、T1-3), 0.1 mmol L–1、0.5 mmol L–1、1.0 mmol L–1的脯氨酸(T2-1、T2-2、T2-3), 0.03%、0.15%、0.30%的过氧化氢(T3-1、T3-2、T3-3), 0.001 mmol L–1、0.01 mmol L–1、0.05 mmol L–1的苹果酸(T4-1、T4-2、T4-3), 25 mg L–1、100 mg L–1、300 mg L–1的氧化纳米锌(T5-1、T5-2、T5-3), 0.5 mmol L–1、1.0 mmol L–1的多胺(T6-1、T6-2)浸种处理后, 于2021—2023年开展田间试验, 研究不同外源物质及浓度浸种对迟播油菜越冬期抗寒性及产量的影响。结果表明, 不同外源物质和不同浓度浸种处理影响迟播油菜出苗率, 部分处理如T3-3、T4-2、T5-3与CK相比显著提高, 提高幅度分别达到19.2%、15.3%、17.3%。部分外源物质浸种也显著提高了迟播油菜抗寒性, 其机制一方面是提高抗氧化系统中过氧化物酶、过氧化氢酶活性和谷胱甘肽含量, 减少活性氧、过氧化氢及丙二醛含量, 另一方面是增加可溶性糖、脯氨酸、苹果酸、多胺、甘露醇等渗透调节物质含量, 提高膜联冷应答蛋白激酶含量从而提高抗寒性。叶片抗寒性的增加有利于越冬期叶片生物量的积累, 有效分枝数增加, 单株角果数增加, 从而促进产量的提高。另外, 对筛选出的9个正向指标和3个负向抗寒性指标进行综合评价, 结果表明, 2年平均产量排序和抗寒性综合评价值排序结果基本一致, 产量较高、抗寒性较强的浸种处理为T5-3、T5-2、T2-3、T1-2。该研究可为长江流域迟播油菜冬前壮苗培育、提高越冬期抗寒性提供理论与技术支撑, 为迟播油菜抗逆稳产、促进冬闲田开发利用提供依据。
油菜; 迟播; 抗寒性; 外源物质; 浸种
当前, 我国食用植物油自给率仅30%左右[1]。我国是世界最主要的油菜生产国和消费国, 种植面积超过667万公顷、总产量达1400万吨, 占世界种植面积和产量的五分之一左右[2-3]。油菜作为国产植物油第一大油源, 在食用油的供给安全方面, 起到了重要的支撑作用。进一步扩大油菜种植面积是提高油菜籽总产量及食用油自给率的重要抓手。但我国油菜主产区在长江流域, 该产区主要采用稻-油及稻-稻-油轮作模式, 常因前茬水稻收获迟, 后茬油菜播期严重滞后导致油菜产量及效益严重降低, 我们将长江流域播期迟于10月25日的油菜称之为迟播油菜。因此, 利用油菜压减长江流域冬闲田扩大油菜面积的核心是确保迟播油菜的产量和效益, 提升油菜种植面积。
外源物质浸种可提高迟播油菜抗寒性, 利于越冬期干物质积累, 是提升产量的有效手段。提高出苗率是迟播油菜产量形成的基础。研究表明, 播种前对种子浸种处理可提高种子活力, 增强抗逆性, 加快种子萌发并提高发芽率[4-5], 利于温光资源的利用。迟播油菜越冬期生物量低, 干物质增长缓慢, 不利于产量形成。研究指出, 利用过氧化氢等外源物质浸种可促进低温油菜叶面积增大和干物质积累, 提高油菜分枝数与单株角果数, 提高产量[4]。低温胁迫下, 膜脂过氧化产生丙二醛和活性氧加重叶片的低温伤害, 与组织器官的耐寒性呈显著负相关[6-7]。抗寒性较高的作物体内同时也产生清除活性氧的抗氧化酶以及非酶促清除物质, 超氧化物歧化酶、过氧化物酶、过氧化氢酶、抗坏血酸过氧化物酶等抗氧化酶活性增强[8], 抗坏血酸、类胡萝卜素、谷胱甘肽等非酶促抗氧化物质含量增加[9-10], 并提高了对超氧阴离子自由基、羟基自由基、过氧化氢的清除能力及清除率[11]。作物的抗寒性还表现在通过增加体内甜菜碱、脯氨酸、苹果酸、多胺等渗透调节物质, 以维持细胞膜的稳定性和通透性, 降低膜脂过氧化等过程中产生的有害物质, 提高细胞膜的保护功能[12], 从而提高作物的抗寒性。但这些渗透调节物质作为外源物质以浸种的方式在作物抗寒方面的应用却鲜有报道。
迟播油菜冬前叶片数仅3~5片, 抗寒性差, 冬季干物质积累量小, 导致籽粒产量低而不稳, 因此, 提高迟播油菜越冬期抗寒性, 增加冬季干物质积累量是迟播油菜田间管理的重点。前人较多研究均集中在利用种子处理技术提高发芽出苗阶段的抗寒性,但利用外源物质浸种提高迟播油菜苗期抗寒性, 并提高越冬期干物质积累量的研究鲜有报道。本研究在前期室内筛选的基础上, 选用6种不同浓度的外源物质进行浸种处理后, 进行2年的田间试验, 通过测定抗寒性关键指标、产量及产量构成, 筛选对迟播油菜浸种有实际应用价值的外源物质及适宜浓度并解析其机制, 为长江流域迟播油菜生产提供理论与技术支撑。
1 材料与方法
1.1 试验设计
试验于2021—2023连续2年在华中农业大学试验基地(30.52°N, 114.31°E)进行。前茬为水稻, 2021—2022年试验地全氮、有机质、碱解氮、速效磷、速效钾含量分别为0.89 g kg-1、15.67 g kg–1、24.32 mg kg–1、14.11 mg kg–1、127.00 mg kg–1, 2022— 2023年分别为0.90 g kg–1、14.77 g kg–1、24.17 mg kg–1、14.58 mg kg–1、123.96 mg kg–1。供试品种为华油杂137, 随机区组设计, 3次重复, 计54个小区。10月25日条播, 行距为25 cm, 小区面积为20 m2。基肥使用复合肥(N∶P2O5∶K2O = 25%∶7%∶8%) 750 kg hm–2及硼肥15 kg hm–2。三叶期定苗, 密度为7.5×104株 hm–2。
浸种前, 将待浸种油菜种子去除干瘪、破损籽粒, 使用80%乙醇溶液表面消毒10 min, 并用无菌水冲洗3次, 药剂浸种10 h, 在超净工作台中自然风干备用。浸种所用外源物质及浓度如表1所示。

表1 用于迟播油菜浸种的不同外源物质及浓度
1.2 测定指标与方法
1.2.1 出苗率和越冬期农艺性状 出苗后每小区选取5行统计出苗数, 计算出苗率。出苗率(%)=出苗数/播种种子数×100%。越冬期取样调查株高、根颈粗、主根长、叶片干物重等指标, 使用叶面积仪(Li-3100c, Li-Cor Inc, 美国)测定叶面积。取样时选取代表性植株10株, 3次重复。
1.2.2 成熟期关键性状 于成熟期(4月27日)每小区连续取样10株, 考察株高、有效分枝数、根颈粗和地上部干重等关键农艺性状, 采用YYD-1茎秆强度测定仪(浙江杭州托普仪器有限公司)测定其缩茎段以上15 cm处抗折力。
1.2.3 成株率、产量与产量构成因素 于成熟期每小区连续取样10株, 考察单株角果数、每角粒数、千粒重和单株产量, 以小区实收记实际产量。收获后, 统计单位面积内收获的油菜株数, 计算成株率。成株率(%)=收获密度/定苗密度´100%。
1.2.4 生理指标 越冬期每个小区连续取样5株的叶片, 去掉叶脉及边缘, 用锡纸包裹后至液氮中于-80℃低温保存。采用Elisa试剂盒(Jiangsu Meibiao Biotechnology Co., Ltd., 江苏盐城)测定抗寒性相关生理指标(超氧化物歧化酶、过氧化物酶、过氧化氢酶、抗坏血酸过氧化物酶、丙二醛、过氧化氢、超氧阴离子、羟自由基、抗坏血酸、类胡萝卜素、谷胱甘肽、可溶性糖、脯氨酸、苹果酸、甜菜碱、多胺、甘露醇、膜联冷应答蛋白激酶和Ca2+通道蛋白)。用快速自动研磨仪(JXFSTPRP24, 上海净信实业发展有限公司, 上海)对低温冷冻样品研磨。取0.1000 g样品与0.90 mL磷酸缓冲液(pH 7.0)混合, 低温混匀震荡5 min, 4℃离心15 min, 提取上清液和酶标试剂加入每个样品孔中, 37℃避光孵育15 min。显色后, 在450 nm波长先测定样品OD值, 根据标准曲线计算各物质含量[13]。
1.2.5 抗寒性综合评价 利用“逼近理想解法”(Topsis法)对18个浸种处理通过主成分分析所筛选到的指标进行抗寒性综合评价。首先对负向指标进行逆向化处理, 逆向化计算公式为
U= [max(Y) –Y]/[max(Y) – min(Y)],
然后将所有指标映射区间至[1, 2], 进行区间化处理以消除量纲的影响, 区间化计算公式为
Z= 1+[(U– min(U)]/[max(U) – min(U)]。
构建一个×的矩阵, 然后通过计算相对接近度C进行综合排序, 计算方法如下:
定义最大值:

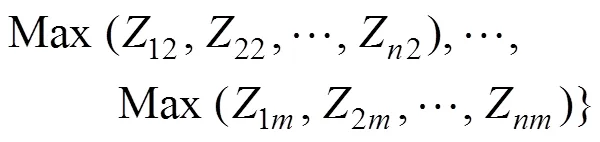
定义最小值:


定义第(= 1, 2, 3, …,)个评价对象距离与最大值的距离

定义第(= 1, 2, 3, …,)个评价对象距离与最小值的距离

得出第个评价对象的得分

其中,代表待评价的处理数,代表参与综合评价的指标。
1.3 数据处理
采用Microsoft Excel 2020软件整理数据, 采用SPSS 24.0进行方差分析, 采用最小显著差法(Least significant difference, LSD)进行多重比较, 使用Origin 2022绘图和主成分分析。
2 结果与分析
2.1 2个油菜生长季的气象因子
2个油菜生长季的日最高温度、日最低温度、日降雨量和日太阳辐射量存在差异。相比第1生长季(2021—2022), 第2生长季(2022—2023)越冬期、花期和角果期降雨量明显增加。第2生长季越冬期太阳辐射量相较第1生长季整体有所降低。同时, 第2生长季越冬期内温度较低, 其中零下低温有21 d, 而第1生长季仅有4 d, 同比增加425.0% (图1-a, b)。
2.2 不同外源物质浸种对油菜出苗率的影响
不同外源物质浸种, 出苗率存在差异, 年际间表现一致。与CK比, 出苗率最高的处理是T3-3, 2021—2022年提高了20.1%, 2022—2023年提高了18.3%, 均达显著水平(< 0.05)。其余5种外源物质最佳处理为T1-3、T2-3、T4-2、T5-3、T6-1, 分别比CK提高10.9%、12.5%、14.0%、16.0%、10.0% (图2)。
2.3 不同外源物质浸种对迟播油菜产量及产量构成的影响
外源物质浸种, 处理间产量差异较大。2年产量最高的处理均是T5-3, 分别比CK提高12.3%和12.9%, 其次是T5-2和T2-3。T1-2、T3-3、T4-2、T6-2是该外源物质浸种处理下增产效果的最适浓度, 2021—2022年分别比CK提高9.0%、3.5%、4.4%、6.9%, 2022—2023年则分别提高10.0%、3.8%、3.5%、7.7%。每角粒数、千粒重、成株率在浸种后变化较小, 主要通过单株角果数影响油菜产量(表2)。方差分析表明, 单株角果数受年份和浸种处理的影响分别达显著(<0.05)和极显著水平(<0.01), 产量受两者影响均达极显著水平(<0.01), 每角粒数、千粒重和成株率受两者的影响不显著。年份和浸种处理的互作效应对产量及产量构成因素的影响不显著。

图1 2021-2022生长季(a)和2022-2023生长季(b)的主要气象因子
min和max分别代表日最低温和日最高温。
minandmaxrepresent the daily minimum temperature and the daily maximum temperature, respectively.

图2 不同外源物质浸种对迟播油菜2021-2022 (a)和2022-2023 (b)生长季出苗率的影响
不同小写字母表示不同外源物质浸种处理间差异达显著水平(< 0.05)。处理同表1。
Different lowercase letters indicate that there is significant difference between different seed soaking treatments with different exogenous substances (< 0.05). Treatments are the same as those given in Table 1.

表2 不同外源物质浸种对迟播油菜产量及产量构成的影响

(续表2)
不同小写字母表示同一年份不同外源物质浸种处理间差异达显著水平(< 0.05)。*、**分别表示在0.05和0.01概率水平显著差异, ns表示差异不显著。处理同表1。
Different lowercase letters indicate significant difference between different seed soaking treatments with different exogenous substances in the same year at< 0.05. * and ** indicate significant differences at the 0.05 and 0.01 probability levels, respectively, while ns indicates no significant differences. Treatments are the same as those given in Table 1.
2.4 不同外源物质浸种对油菜成熟期关键农艺性状的影响
2021—2022生长季和2022—2023生长季有效分枝数最大的处理分别是T1-2和T1-3, 分别比CK提高28.3%和24.2%; 根颈粗最大的处理分别是T3-2和T3-1, 分别比CK提高18.5%、18.6%; 地上部干重最大的处理分别是T5-3和T6-1, 分别比CK提高37.7%、39.7%。抗折力最大的处理分别是T2-3和T6-1, 分别比CK提高46.0%、40.0% (表3)。方差分析表明, 浸种处理对有效分枝数、地上部干重和抗折力的影响极显著(<0.01), 年份对根颈粗和抗折力的影响极显著(<0.01), 株高、根颈粗受年份和浸种处理之间互作效应的影响极显著(<0.01)。
2.5 不同外源物质浸种对迟播油菜越冬期关键农艺性状及叶片生物量的影响
浸种处理后, 根颈粗、叶面积及叶片生物量均在T5-3处理下最高, 2021—2022年相比CK分别提高了36.9%、30.9%、55.3%, 2022—2023年则分别提高了33.1%、28.5%、52.9%。方差分析表明, 除叶面积外, 其余指标受年份的影响达显著(<0.05)或极显著水平(<0.01)。浸种处理对株高、根长、根颈粗、叶面积、叶片生物量的影响均达到极显著水平(<0.01), 年份和浸种处理之间的互作效应对以上指标的影响均未达到显著水平(表4)。
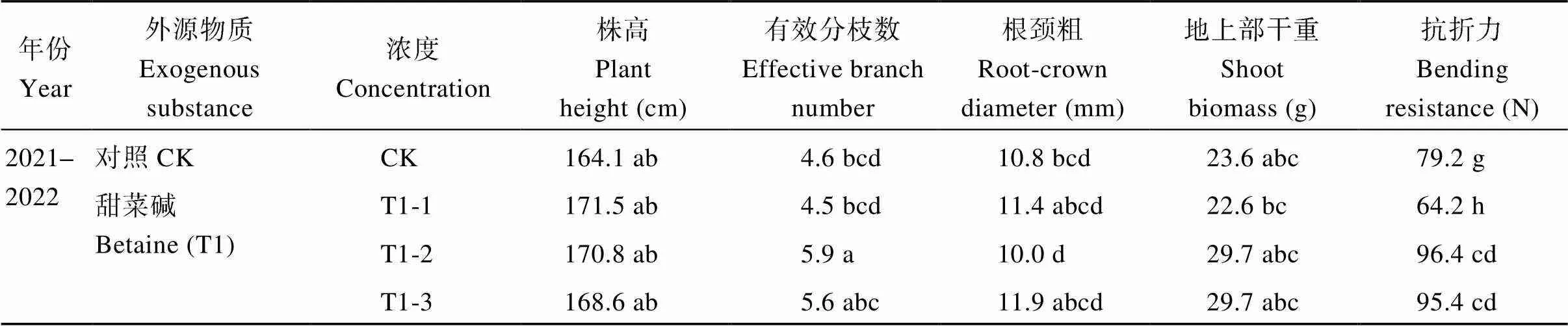
表3 不同外源物质浸种对迟播油菜成熟期关健农艺性状的影响
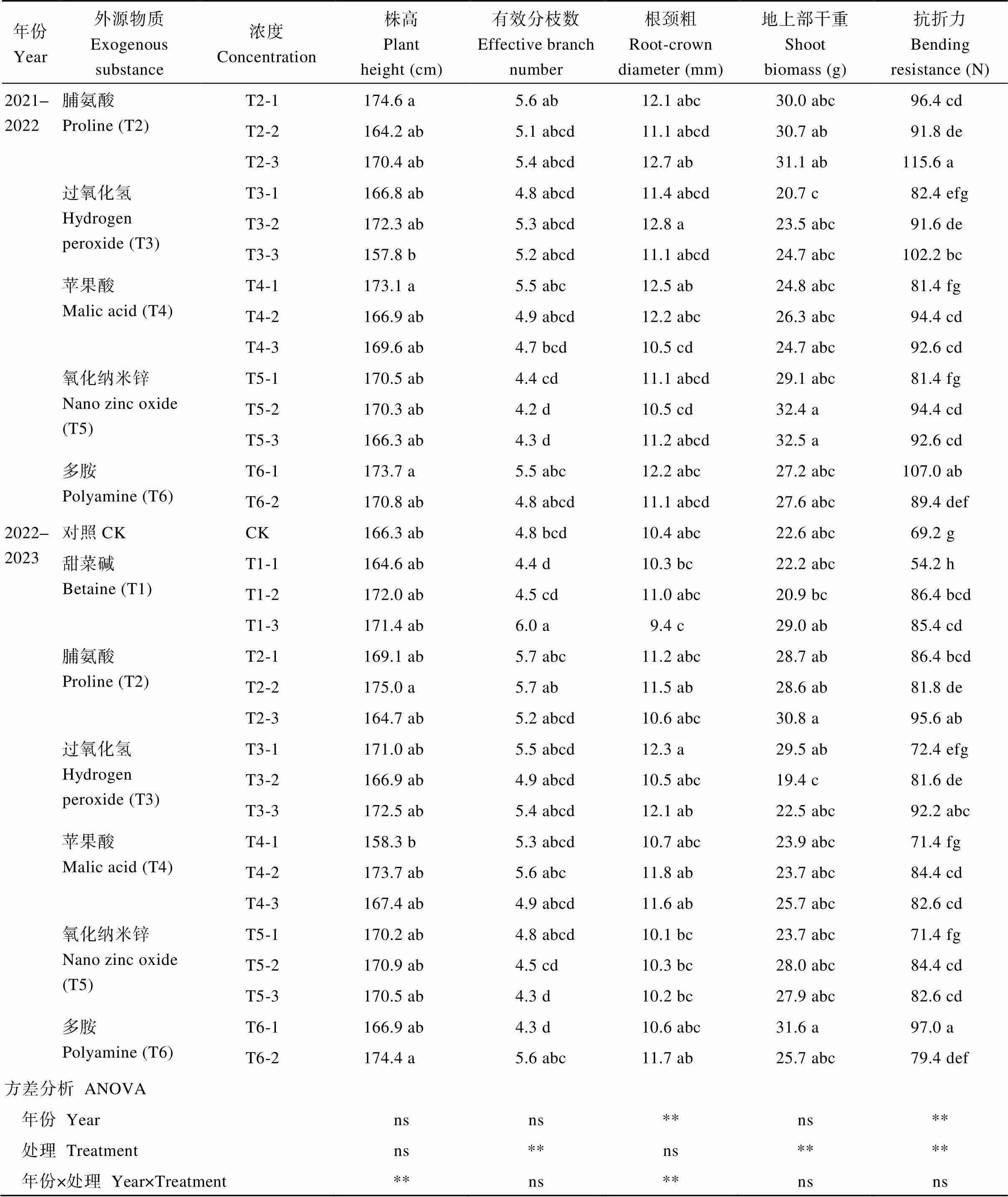
(续表3)
不同小写字母表示同一年份不同外源物质浸种处理间差异达显著水平(< 0.05)。*、**分别表示在0.05和0.01概率水平显著差异, ns表示差异不显著。处理同表1。
Different lowercase letters indicate significant difference between different seed soaking treatments with different exogenous substances in the same year at< 0.05. * and ** indicate significant differences at the 0.05 and 0.01 probability levels, respectively, while ns indicates no significant differences. Treatments are the same as those given in Table 1.

表4 不同外源物质浸种对迟播油菜越冬期关键农艺性状及叶片生物量的影响
不同小写字母表示同一年份不同外源物质浸种处理间差异达显著水平(< 0.05)。*、**分别表示在0.05和0.01概率水平显著差异, ns表示差异不显著。处理同表1。
Different lowercase letters indicate significant difference between different seed soaking treatments with different exogenous substances in the same year at< 0.05. * and ** indicate significant differences at the 0.05 and 0.01 probability levels, respectively, while ns indicates no significant differences. Treatments are the same as those given in Table 1.
2.6 产量与越冬期关键农艺性状的相关性分析
对越冬期根颈粗、叶面积及叶片生物量与产量进关性分析, 产量与根颈粗、叶面积、叶片生物量相关性均达极显著水平(<0.001)。因此, 可以针对越冬期叶片生理指标进行抗寒性评价(图3)。
2.7 不同外源物质浸种对油菜越冬期叶片抗寒生理的影响
2.7.1 活性氧积累和抗氧化酶系统 浸种后, 叶片MDA和H2O2、∙OH含量均有降低趋势, 最低处理均为T5-3, 分别比CK降低42.8%、42.9%、43.8%, O2∙-最低处理是T3-2, 比CK降低29.2%。叶片中SOD、POD、CAT活性最高处理是T5-3, 分别比CK提高91.5%、55.7%、90.5%, APX最高的处理是T2-3, 比CK提高59.6% (表5)。
2.7.2 非酶促清除系统 浸种后, 叶片中抗坏血酸、类胡萝卜素含量最高的处理均是T6-2, 分别比CK提高41.4%和28.2%; 还原型谷胱甘肽则以T5-3 处理含量最高, 比CK提高37.1%。苹果酸、氧化纳米锌、多胺浸种处理后各浓度下叶片中类胡萝卜素、谷胱甘肽含量均高于CK (表6)。
2.7.3 渗透调节物质 浸种后, 叶片中可溶性糖、苹果酸、多胺和甘露醇含量最高的处理均是T5-3, 分别比CK提高47.4%、61.7%、76.5%和70.0%; 脯氨酸和甜菜碱含量最高的处理分别是T5-2和T1-3, 分别比CK提高23.2%和31.3%。外源脯氨酸和氧化纳米锌浸种后, 各浓度下叶片脯氨酸含量均高于CK, 外源脯氨酸、氧化纳米锌和多胺浸种后, 各浓度下叶片中苹果酸、多胺、甘露醇含量均高于CK (表7)。
2.7.4 膜联冷应答蛋白激酶和Ca2+通道蛋白 浸种后, 位于细胞膜上的膜联冷应答蛋白激酶(MRPK)除T1-1、T3-1和T3-2处理外, 其余处理较CK酶活性明显提高; 而Ca2+通道蛋白(VGCC)含量除T2-3、T4-3处理外, 其余处理较CK均显著增加。MRPK酶活性提高最高的处理是T5-3, 较CK提高34.8%; VGCC含量增加最多的处理是T6-1, 较CK提高54.7% (图4)。

图3 产量与越冬期迟播油菜(a)根颈粗、(b)叶面积和(c)叶片生物量的相关性分析
***:<0.001.

表5 不同外源物质浸种对迟播油菜越冬期叶片活性氧及抗氧化系统的影响
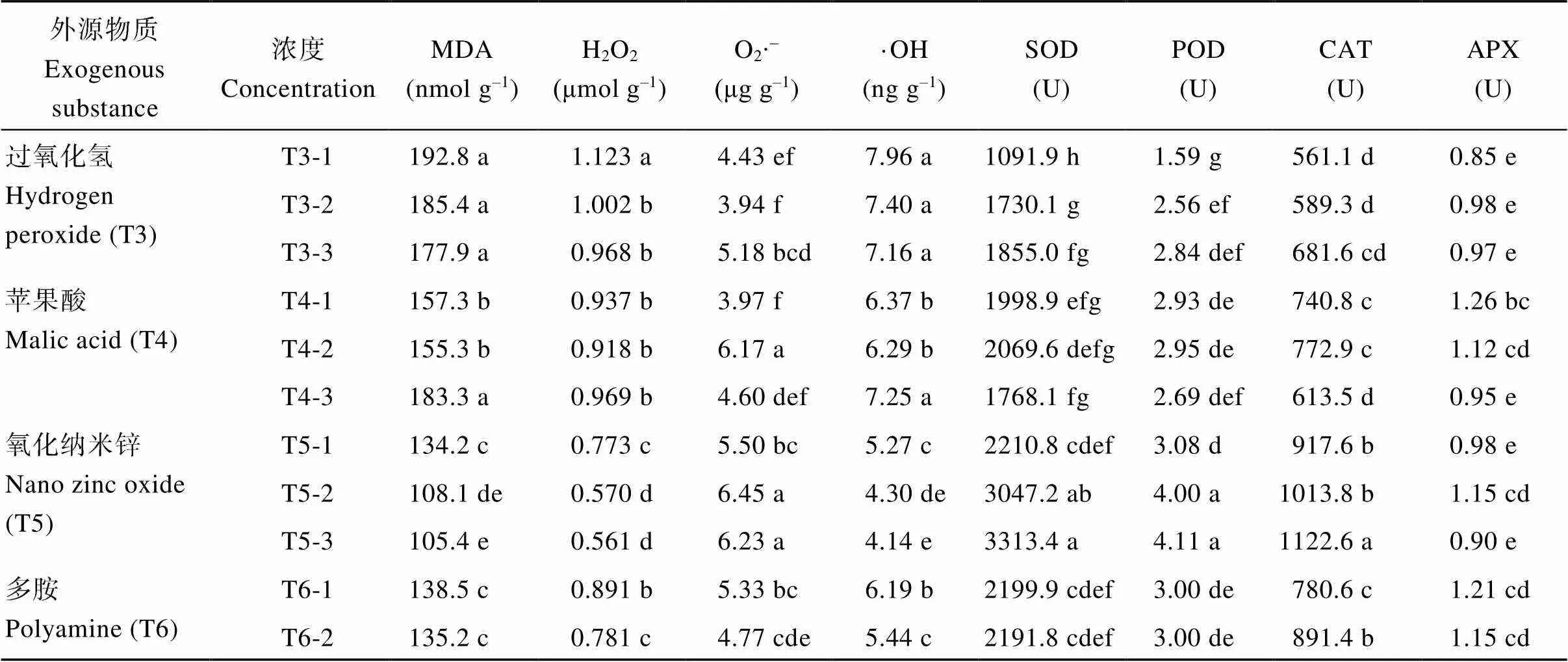
(续表5)
不同小写字母表示不同外源物质浸种处理间差异达显著水平(< 0.05)。处理同表1。
Different lowercase letters indicate significant difference between different seed soaking treatments with different exogenous substances at< 0.05. Treatments are the same as those given in Table 1.

表6 不同外源物质浸种对迟播油菜越冬期叶片非酶促清除系统的影响
不同小写字母表示不同外源物质浸种处理间差异达显著水平(< 0.05)。处理同表1。
Different lowercase letters indicate significant difference between different seed soaking treatments with different exogenous substances at< 0.05. Treatments are the same as those given in Table 1.

表7 不同外源物质浸种对迟播油菜越冬期叶片渗透调节物质的影响
不同小写字母表示不同外源物质浸种处理间差异达显著水平(< 0.05)。处理同表1。
Different lowercase letters indicate significant difference between different seed soaking treatments with different exogenous substances at< 0.05. Treatments are the same as those given in Table 1.

图4 不同外源物质浸种对迟播油菜越冬期叶片膜联冷应答蛋白激酶和Ca2+通道蛋白的影响
不同小写字母表示不同外源物质浸种处理间差异达显著水平(< 0.05)。MRPK: 膜联冷应答蛋白激酶; VGCC: Ca2+通道蛋白。处理同表1。
Different lowercase letters indicate significant difference between different seed soaking treatments with different exogenous substances at< 0.05. MRPK: the membrane-associated cold response protein kinase; VGCC: Ca2+channel protein. Treatments are the same as those given in Table 1.
2.8 迟播油菜外源物质浸种抗寒性的评价指标筛选与Topsis综合评价
2.8.1 迟播油菜外源物质浸种抗寒性评价指标筛选
通过对产量、越冬期叶面积和生物量及叶片生理指标主成分分析后聚类。根据指标间相关性, 将与Y、LA、LB正相关的POD、CAT、GSH、MRPK、Mal、Pol、Man、Pro、SS等9个指标划分为叶片抗寒性正向指标, 将与Y、LA、LB负相关的H2O2、∙OH、MDA等3个指标划分为叶片抗寒性负向指标(图5)。
2.8.2 迟播油菜外源物质浸种后抗寒性综合评价
将9项正向指标和3项负向指标进行Topsis综合评价, 正理想距离D+越小, 负理想距离D-越大, 则相对接近度C越大, 越接近最优结果。结果表明, 2年平均产量排序结果和抗寒性综合评价结果基本一致, 提高越冬期抗寒性能促进产量提升。根据相对接近度C得出迟播油菜外源物质浸种处理抗寒性较优、产量较高的4种试剂及浓度分别是T5-3、T5-2、T2-3、T1-2。另外, 筛选出甜菜碱浸种的最适浓度为T1-2, 脯氨酸为T2-3, 过氧化氢为T3-3, 苹果酸为T4-2, 氧化纳米锌为T5-3, 多胺为T6-2 (表8)。

图5 抗寒性生理指标的主成分分析
Y: 产量; LA: 叶面积; LB: 叶片生物量; POD: 过氧化物酶; SOD: 超氧化物歧化酶; CAT: 过氧化氢酶; GSH: 谷胱甘肽; MRPK: 膜联冷应答蛋白激酶; Mal: 苹果酸; Pol: 多胺; Man: 甘露醇; ASA: 抗坏血酸; Car: 类胡萝卜素; O2∙–: 超氧阴离子自由基; SS: 可溶性糖; Pro: 脯氨酸; Bet: 甜菜碱; VGCC: Ca2+通道蛋白; APX: 抗坏血酸过氧化物酶; H2O2: 过氧化氢; ∙OH: 羟自由基; MDA: 丙二醛。
Y: yield; LA: leaf area; LB: leaf biomass; POD: peroxidase; SOD: superoxide dismutase; CAT: catalase; GSH: glutathione; MRPK: membrane-associated cold response protein kinase; Mal: malic acid; Pol: polyamine; Man: mannitol; ASA: ascorbic acid; Car: carotenoids; O2∙-: superoxide anion radical; SS: soluble sugar; Pro: proline; Bet: betaine; VGCC: Ca2+channel protein; APX: ascorbate peroxidase; H2O2: hydrogen peroxide; ∙OH: hydroxyl radical; MDA: malondialdehyde.

表8 迟播油菜外源物质浸种抗寒性Topsis综合评价及平均产量排序结果

(续表8)
处理同表1。Treatments are the same as those given in Table 1.
3 讨论
3.1 外源物质浸种对迟播油菜出苗率、越冬期干物质积累和产量的影响
提升迟播油菜产量是利用长江流域冬闲田的前提。油菜播期推迟带来的直接问题是出苗困难, 生长缓慢, 越冬期抗寒性弱, 产量低。因此迟播油菜田间管理的核心是提高出苗率、增加越冬期生物量积累。浸种是促进种子萌发, 增加出苗率的有效手段。研究表明, 外源过氧化氢浸种可缓解低温对种子萌发抑制并增加萌发期间对低温胁迫的抗性[14]。方彦等[15]指出, 适宜浓度外源脱落酸浸种促进种子萌发并增加了体内脯氨酸等渗透调节物质的含量, 出苗率增加。本研究表明不同外源物质浸种, 迟播油菜出苗率显著提高。
叶片是油菜越冬期生物量最大的器官, 油菜抗寒性增加有利于冬前生物量积累[16]。研究表明, 播期每推迟5 d, 活动积温减少100℃左右, 达到一定叶片数的时间大幅增加[17], 导致干物质积累不足, 苗长势弱。本研究表明, 外源物质浸种处理后油菜越冬期干物质积累量相比对照有升高趋势。前人研究表明, 迟播产量降低, 通过过氧化氢浸种后可以通过提高油菜有效分枝数与单株角果数来弥补迟播带来的产量损失, 对每角粒数无显著影响[18], 与本研究一致。有研究指出, 过氧化氢浸种处理除可以增加分枝数和每角粒数外, 千粒重也显著提高[4], 这与本研究中外源物质浸种处理后千粒重无显著差异不同, 这可能是因为浸种浓度、品种选用或者环境因素所导致。
3.2 外源物质浸种对迟播油菜越冬期抗寒性的影响
提高迟播油菜越冬期抗寒性是产量提高的关键举措。叶片细胞膜脂损伤与修复的活性氧积累及清除系统, 维持细胞膜结构稳定的渗透调节物质及膜信号传导蛋白是研究抗寒性的重要生理。本研究发现迟播油菜浸种处理后, 相比对照叶片通过增加体内抗氧化酶SOD、POD、CAT和APX活性, 迅速清除体内的H2O2、∙OH和MDA来减轻膜脂伤害, 这与前人研究一致[19]。低温环境下, 作物体内抗坏血酸、还原型谷胱甘肽含量降低, 活性氧积累, 破坏膜的结构和功能, 加剧膜质过氧化[9]。有研究表明, 氧化纳米锌可以激活作物体内的抗氧化系统, 增加体内抗氧化酶的活性[20-21], 帮助油菜降解和清除寒冷环境产生的有害自由基, 减轻寒冷伤害, 这与本研究的结果基本一致。同时有助于在细胞膜和和细胞结构上形成一层保护膜, 增强细胞膜的稳定性和抗寒性[22], 防止膜的损伤和细胞结构的破坏。另外, 也有研究提出了氧化纳米锌增加作物抗性的新见解, 即通过调节赤霉素和脱落酸等植物激素的合成与信号传导, 增加体内激素含量调节作物的生长和抗性[23]。
渗透调节是作物面对低温胁迫的主要调节方式[24]。脯氨酸作为作物体内重要的渗透调节物质[24-25], 在油菜受到低温胁迫后, 体内脯氨酸含量显著增加, 以维持细胞膜渗透调节的稳定[26]。这与本研究外源脯氨酸浸种可以增加油菜越冬期的内源脯氨酸含量相一致。脯氨酸浸种后, 还可以通过提高体内脯氨酸的含量降低细胞内液相转变为固相的温度, 防止低温冻伤[27]。还有研究表明, 脯氨酸浸种可以通过调节脂质代谢, 促进脂肪的分解和氧化, 从而增加产生热能的能力, 帮助作物在寒冷环境中产生更多热量从而提高抗寒性[28]。除此之外, Chen等[29]也提到了脯氨酸浸种可以提高和抗寒基因的表达, 从而增强对寒冷的适应能力。
细胞膜的稳定性与作物的抗寒性存在密切关系,抗寒性较强的作物在低温胁迫时膜的稳定性显著提高。Ca2+对维持膜的完整性[30]、调节离子运输[31]等方面起到重要作用, 维持细胞中Ca2+的稳定是保持细胞活力所必需的[32], 本研究发现外源脯氨酸浸种处理后, VGCC、MRPK相较对照有所提高, 表明浸种后可通过介导细胞膜的Ca2+的跨膜运输以维持细胞内Ca2+稳定, 提高叶片的抗寒性, 这与前人报道低温可诱导膜联蛋白基因表达上调[33-34]以及Wang等[35]发现VGCC含量增加调控作物对低温的耐受性相一致。
3.3 抗寒性评价指标筛选及评价方法
目前普遍认为, 运用多指标多方法相结合的抗逆性评价是较为可靠的[36]。油菜越冬期抗寒性受多种因素共同影响, 机制复杂, 且不同指标间存在交互作用, 通过单一指标进行抗寒性评价是片面的。因此, 需要运用多指标进行综合评价来全面、准确地衡量抗寒性强弱[37]。研究作物某一特性与抗寒性关系, 可采用隶属函数综合评价(D-CRITIC)的方法, 例如范军强等[38]运用此方法并结合主成分分析比较了14个油菜品种的气孔特性与抗寒性的关系。但是, 评价由若干指标组成的不同的试验方案之间的优劣程度, 更宜采用“逼近理想解”排序方法(Topsis法)来进行综合排序, Su等[39]利用该方法评价了肥料类型、不同盐水灌溉量和灌溉水盐度对产量和水分生产力的影响大小进行优劣排序。这与本研究通过主成分分析对抗氧化系统、渗透调节物质、细胞膜稳定等指标与产量、叶面积、叶片生物量相关性强弱进行筛选, 筛选出正向指标与负向指标, 然后利用以上两类指标评价不同的外源物质及浓度对油菜抗寒性的影响, 找到最适处理相类似, 是一种比较可靠的综合评价手段。
4 结论
通过主成分分析筛选出与越冬期抗寒性相关的9项正向指标和3项负向指标, 对以上12项指标进行Topsis评价排序, 得出迟播油菜越冬期抗寒性排序和2年平均产量排序基本一致, 产量较好和抗寒性较优的4个处理为300 mg L–1氧化纳米锌、100 mg L–1氧化纳米锌、1.0 mmol L–1脯氨酸、0.05 mmol L–1甜菜碱。迟播油菜浸种后通过提高抗氧化系统中抗氧化酶活性、提高非酶促清除物质和减少活性氧、丙二醛含量, 增加渗透调节物质含量和膜联冷应答蛋白激酶活性, 缓解了低温带来的损伤, 提高了迟播油菜的抗寒性, 促进叶片越冬期的干物质积累, 增加有效分枝数和角果数, 从而提高了产量。
[1] 刘成, 冯中朝, 肖唐华, 马晓敏, 周广生, 黄凤洪, 李加纳, 王汉中.我国油菜产业发展现状、潜力及对策. 中国油料作物学报, 2019, 41: 485–489. Liu C, Feng Z C, Xiao T H, Ma X M, Zhou G S, Huang F H, Li J N, Wang H Z. Development, potential and adaptation of Chinese rapeseed industry., 2019, 41: 485–489 (in Chinese with English abstract).
[2] Food and Agriculture Organization (FAO) of the United Nations. FAO Statistical Databases in 2023. [2023-04-25]. http://www.fao. org.
[3] 李勤, 刘小焱, 盛紫微, 曲昭杰, 罗涛, 王晶, 蒯婕, 汪波, 李俊, 徐正华, 周广生. 我国油菜适合机械化收获关键农艺性状研究进展. 中国油料作物学报, 2023, 45: 1053–1061. Li Q, Liu X Y, Sheng Z W, Qu Z J, Luo T, Wang J, Kuai J, Wang B, Li J, Xu Z H, Zhou G S. Research progress on target agronomic traits for mechanized harvesting of rapeseed in China., 2023, 45: 1053–1061 (in Chinese with English abstract).
[4] 张顺凯, 王端, 陶雨佳, 江海东. H2O2浸种对晚直播油菜生长及产量的影响. 中国油料作物学报, 2019, 41: 559–567. Zhang S K, Wang D, Tao Y J, Jiang H D. Effects of seeds soaking with hydrogen peroxide on growth and yield of rapeseed at different sowing dates., 2019, 41: 559–567 (in Chinese with English abstract).
[5] 张钰钦, 杨之帆, 李越, 李银水, 胡小加, 秦璐, 廖星. 外源海藻糖浸种对低温胁迫油菜种子萌发及幼苗生长的影响. 中国油料作物学报, 2022, 44: 376–384. Zhang Y Q, Yang Z F, Li Y, Li Y S, Hu X J, Qin L, Liao X. Effect of exogenous trehalose on seed germination and seedling growth of rapeseed under low temperature., 2022, 44: 376–384 (in Chinese with English abstract).
[6] 朱春权, 魏倩倩, 项兴佳, 胡文君, 徐青山, 曹小闯, 朱练峰, 孔亚丽, 刘佳, 金千瑜, 张均华. 褪黑素和茉莉酸甲酯基质育秧对水稻耐低温胁迫的调控作用. 作物学报, 2022, 48: 2016–2027. Zhu C Q, Wei Q Q, Xiang X J, Hu W J, Xu Q S, Cao X C, Zhu L F, Kong Y L, Liu J, Jin Q Y, Zhang J H. Regulation effects of seedling raising by melatonin and methyl jasmonate substrate on low temperature stress tolerance in rice., 2022, 48: 2016–2027 (in Chinese with English abstract).
[7] 刘自刚, 张长生, 孙万仓, 杨宁宁, 王月, 何丽, 赵彩霞, 武军艳, 方彦, 曾秀存. 不同生态区冬前低温下白菜型冬油菜不同抗寒品种(系)的比较. 作物学报, 2014, 40: 346–354. Liu Z G, Zhang C S, Sun W C, Yang N N, Wang Y, He L, Zhao C X, Wu J Y, Fang Y, Zeng X C. Comparison of winter rapeseed varieties (lines) with different cold resistance planted in the northern-extending regions in China under low temperature before winter., 2014, 40: 346–354 (in Chinese with English abstract).
[8] 蒲媛媛, 赵玉红, 武军艳, 刘丽君, 白静, 马骊, 牛早霞, 金姣姣, 方彦, 李学才, 孙万仓. 北方强冬性甘蓝型冬油菜品种(系)抗寒性评价. 中国农业科学, 2019, 52: 3291–3308. Pu Y Y, Zhao Y H, Wu J Y, Liu L J, Bai J, Ma L, Niu Z X, Jin J J, Fang Y, Li X C, Sun W C. Comprehensive assessment on cold tolerance of the strong winterL. cultivated in northern China., 2019, 52: 3291–3308 (in Chinese with English abstract).
[9] 曾韶西, 王以柔. 低温胁迫对黄瓜子叶抗坏血酸过氧化物酶活性和谷胱甘肽含量的影响. 植物生理学报, 1990, 16: 37–42. Zeng S X, Wang Y R. Effects of low temperature stress on ascorbic acid peroxidase activity and glutathione content in cucumber cotyledons., 1990, 16: 37–42 (in Chinese).
[10] Chung S W, Rho H, Lim C K, Jeon M K, Kim S, Jang Y J, An H J. Photosynthetic response and antioxidative activity of ‘Hass’ avocado cultivar treated with short-term low temperature., 2022, 12: 11593.
[11] He H, Lei Y, Yi Z, Raza A, Zeng L, Yan L, Ding X Y, Yong C, Zou X L. Study on the mechanism of exogenous serotonin improving cold tolerance of rapeseed (L.) seedlings., 2021, 94: 161–170.
[12] Wang P C, Hsu C C, Du Y Y, Zhu P P, Zhao C Z, Fu X, Zhang C G, Paez J S, Macho A P, Tao W A, Zhu J K. Mapping proteome-wide targets of protein kinases in plant stress responses., 2020, 117: 3270–3280.
[13] Hu S L, Chen Q H, Guo F, Wang M L, Zhao H, Wang Y, Ni D J, Wang P. ()‑3‑Hexen‑1‑ol accumulation enhances hyperosmotic stress tolerance in., 2020, 103: 287–302.
[14] 张曼, 戴蓉, 张顺凯, 江海东. H2O2浸种对油菜种子低温萌发的缓解效应. 南京农业大学学报, 2017, 40: 963–970. Zhang M, Dai R, Zhang S K, Jiang H D. Alleviation effects of seed soaking with H2O2on seed germination in rape under low temperature stress., 2017, 40: 963–970 (in Chinese with English abstract).
[15] 方彦, 武军艳, 孙万仓, 杨晓娟, 韩慧敏, 韩亚伟, 陈亚平. 外源ABA浸种对冬油菜种子萌发及幼苗抗寒性的诱导效应. 干旱地区农业研究, 2014, 32(6): 70–74. Fang Y, Wu J Y, Sun W C, Yang X J, Han H M, Han Y W, Chen Y P. Inducing effects of exogenous ABA on seed germination and cold tolerance of winter rape seedlings., 2014, 32(6): 70–74 (in Chinese with English abstract).
[16] 黄少华, 王增春, 刘胜环. 不同植物生长调节剂浸种对油菜壮苗的效果比较. 江苏农业科学, 2006, (3): 49–51. Huang S H, Wang Z C, Liu S H. Comparison of the effect of soaking seeds with different plant growth regulators on rapeseed seedling strengthening., 2006, (3): 49–51 (in chinese).
[17] 徐家裕, 倪文海. 早中熟甘蓝型油菜播种期研究. 中国油料作物学报, 1987, (2): 41–44.Xu J Y, Ni W H. Study on sower for early and late maturingL., 1987, (2): 41–44 (in Chinese).
[18] 万林. H2O2浸种对直播油菜生长和抗寒性的影响. 南京农业大学硕士学位论文, 江苏南京, 2015. Wan L. Effect of Seed Soaking with Hydrogen Peroxide on Growth and Chilling Resistance of Direct-seeding Oilrape. MS Thesis of Nanjing Agricultural University, Nanjing, Jiangsu, China (in Chinese with English abstract).
[19] Ella E S, Dionisio-Sese M L, Ismail A M. Seed pre-treatment in rice reduces damage, enhances carbohydrate mobilization and improves emergence and seedling establishment under flooded conditions., 2011, 2011: plr007.
[20] Alabdallah N M, Alzahrani H S. The potential mitigation effect of ZnO nanoparticles on [L. Moench] metabolism under salt stress conditions., 2020, 27: 3132–3137.
[21] Faizan M, Bhat J A, Hessini K, Yu F, Ahmad P. Zinc oxide nanoparticles alleviates the adverse effects of cadmium stress on Oryza sativa via modulation of the photosynthesis and antioxidant defense system., 2021, 220: 112401.
[22] Rameshraddy, Pavithra G J, Reddy B H R, Salimath M, Geetha K N, Shankar A G. Zinc oxide nano particles increases Zn uptake, translocation in rice with positive effect on growth, yield and moisture stress tolerance., 2017, 22: 287–294.
[23] Fatima A, Safdar N, Ain N, Yasmin A, Chaudhry G. Abscisic acid-loaded ZnO nanoparticles as drought tolerance inducers inL. with physiological and biochemical aAttributes., 2023, 42: 7280–7293.
[24] 李春燕, 陈思思, 徐雯, 李东升, 顾骁, 朱新开, 郭文善, 封超年. 苗期低温胁迫对扬麦16叶片抗氧化酶和渗透调节物质的影响. 作物学报, 2011, 37: 2293–2298. Li C Y, Chen S S, Xu W, Li D S, Gu X, Zhu X K, Guo W S, Feng C N. Effect of low temperature at seedling stage on antioxidation enzymes and cytoplasmic osmoticum of leaves in wheat cultivar yangmai 16., 2011, 37: 2293–2298 (in Chinese with English abstract).
[25] Ren Y Q, Guo Y T, Zhao M L. Research progress of response to low temperature stress in Plant., 2020, 18: 4775–4781.
[26] 吕艳, 黄涌, 邹锡玲, 罗丹, 王小燕, 鲍五洲, 陈建军, 马海清,程勇. 油菜抗低温的评价指标与分子生理机制研究进展. 中国油料作物学报, 2020, 42: 527–535. Lyu Y, Huang Y, Zou X L, Luo D, Wang X Y, Bao W Z, Chen J J, Ma H Q, Cheng Y. Reaserches on evaluation, physiological and molecular mechanism of rapeseed low-tempreature resistance., 2020, 42: 527–535 (in Chinese with English abstract).
[27] Jahed K R, Saini A K, Sherif S M. Coping with the cold: unveiling cryoprotectants, molecular signaling pathways, and strategies for cold stress resilience., 2023, 14: 1246093.
[28] Zuo S Y, Zuo Y T, Gu W R, Wei S, Li J. Exogenous proline optimizes osmotic adjustment substances and active oxygen metabolism of maize embryo under low-temperature stress and metabolomic analysis., 2022, 10: 1388.
[29] Chen Y, Jiang J F, Chang Q S, Gu C S, Song A P, Chen S M, Dong B, Chen F D. Cold acclimation induces freezing tolerance via antioxidative enzymes, proline metabolism and gene expression changes in two chrysanthemum species., 2014, 41: 815–822.
[30] Wu H C, Jinn T L. Heat shock-triggered Ca2+mobilization accompanied by pectin methylesterase activity and cytosolic Ca2+oscillation are crucial for plant thermotolerance., 2010, 5: 1252–1256.
[31] Kang T M, Hilgemann D W. Multiple transport modes of the cardiac Na+/Ca2+exchanger., 2004, 427: 544–548.
[32] Ren R F, Zhou H, Zhang L L, Jiang X R, Liu Y. Ca2+participates in programmed cell death by modulating ROS during pollen cryopreservation., 2022, 41: 1043–1057.
[33] Renaut J, Hausman J F, Wisniewski M E. Proteomics and low-temperature studies: bridging the gap between gene expression and metabolism., 2006, 126: 97–109.
[34] Breton G, Vazquez-tello A, Danyluk J, Sarhan F. Two novel intrinsic annexins accumulate in wheat membranes in response to low temperature., 2000, 41: 177–184.
[35] Wang J C, Liu X, Zhang A, Ren Y L, Wu F Q, Wang G, Xu Y, Lei C L, Zhu S S, Pan T, Wang Y F, Zhang H, Wang F, Tan Y Q, Wang Y P, Jin X, Luo S, Zhou C L, Zhang X, Liu J L, Wang S, Meng L Z, Wang Y H, Chen X, Lin Q B, Zhang X, Guo X P, Cheng Z J, Wang J L, Tian Y L, Liu S J, Jiang L, Wu C Y, Wang E T, Zhou J M, Wang Y F, Wang H Y, Wan J M. A cyclic nucleotide-gated channel mediates cytoplasmic calcium elevation and disease resistance in rice., 2019, 29: 820–831.
[36] Subrahmanyam D, Subash N, Haris A, Sikka A K. Influence of water stress on leaf photosynthetic characteristics in wheat cultivars differing in their susceptibility to drought., 2006, 44: 125–129.
[37] 刘海卿, 孙万仓, 刘自刚, 武军艳, 钱武, 王志江, 郭仁迪, 马骊, 侯献飞, 刘林波. 北方寒旱区白菜型冬油菜抗寒性与抗旱性评价及其关系. 中国农业科学, 2015, 48: 3743–3756. Liu H Q, Sun W C, Liu Z G, Wu J Y, Qian W, Wang Z J, Guo R D, Ma, L, Hou X F, Liu L B. Evaluation of drought resistance and cold resistance and research of their relationship at seedling stage of winter rapeseed (L.) in cold and arid regions in North China., 2015, 48: 3743–3756 (in Chinese with English abstract).
[38] 范军强, 武军艳, 刘丽君, 马骊, 杨刚, 蒲媛媛, 李学才, 孙万仓. 甘蓝型冬油菜气孔特性与抗寒性的关系. 中国农业科学, 2023, 56: 599–619. Fan J Q, Wu J Y, Liu L J, Ma L, Yang G, Pu Y Y, Li X C, Sun W C. Correlation between stomatal characteristics and cold resistance ofL., 2023, 56: 599–619 (in Chinese with English abstract).
[39] Su H, Sun H, Dong X, Chen P, Zhang X, Tian L, Liu X, Wang J. Did manure improve saline water irrigation threshold of winter wheat? A 3-year field investigation., 2021, 258: 107203.
Effects of seed soaking with exogenous substances on late-seeded rapeseed cold resistance of during overwintering period and yield
WANG Xian-Ling, JIANG Yue, LEI Yi-Zhong, XIAO Sheng-Nan, SHE Hui-Jie, DUAN Sheng-Xing, HUANG Ming, KUAI Jie, WANG Bo, WANG Jing, ZHAO Jie, XU Zheng-Hua*, and ZHOU Guang-Sheng
College of Plant Science and Technology, Huazhong Agricultural University / Key Laboratory of Crop Ecophysiology and Farming System for the Middle Reaches of the Yangtze River, Ministry of Agriculture and Rural Affairs, Wuhan 430070, Hubei, China
In double-cropping rice areas in the Yangtze River Basin (YRB), ensuring the yield of late-seeded rapeseed is essential to reduce the winter fallow fields. Additionally, promoting the accumulation of dry matter before winter and improving cold resistance during the overwintering period are effective ways to increase the yield of late-seeded rapeseed. Soaking seeds with exogenous substances is an effective measure to improve the cold resistance during the overwintering period and promote the rapid growth before winter. In this experiment, the early maturing rapeseed variety Huayouza 137 was selected, while soaking-seed treatments of water (CK); 0.01 mmol L–1, 0.05 mmol L–1, 0.10 mmol L–1betaine (T1-1, T1-2, T1-3); 0.1 mmol L–1, 0.5 mmol L–1, 1.0 mmol L–1proline (T2-1, T2-2, T2-3); 0.03%, 0.15%, 0.30% hydrogen peroxide (T3-1, T3-2, T3-3); 0.001 mmol L–1, 0.01 mmol L–1,0.05 mmol L–1malic acid (T4-1, T4-2, T4-3); 25 mg L–1, 100 mg L–1, 300 mg L–1nano zinc oxide (T5-1, T5-2, T5-3); 0.5 mmol L–1, 1.0 mmol L–1polyamines (T6-1, T6-2) were conducted between 2021 and 2023 rapeseed growing season. We studied the effects of soaking seeds with different exogenous substances and their levels on the cold resistance in winter and yield of late-seeded rapeseed. The results showed that the different exogenous substances and their levels of soaking seeds affected the germination rate of late-seeded rapeseed, and part of them, such as T3-3, T4-2, and T5-3, significantly increased by 19.2%, 15.3%, and 17.3% versus CK. Soaking seeds with some exogenous substances significantly improved the cold resistance of late-seeded rapeseed in winter. On the one hand, the activities of peroxidase, catalase, and the content of glutathione were improved, and the contents of hydrogen peroxide, active oxygen and MDA reduced; on the other hand, the contents of soluble sugar, proline, malic acid, polyamine, and mannitol were increased; at the same time, the content of membrane cold response protein kinase was increased. The increase of leaf cold resistance was beneficial to the accumulation of leaf biomass and the increase of effective branches and pod number per plant, thus promoting yield. In addition, 9 positive and 3 negative cold resistance indicators were comprehensively evaluated. The results showed that the two-year average yield ranking and the comprehensive evaluation value ranking of cold resistance were basically the same over the two years. While the soaking-seed treatments with the best yield and cold resistance were T5-3, T5-2, T2-3, and T1-2. These results of this study provide theoretical and technical support for the cultivation of late-seeded rapeseed seedlings before winter and the improvement of cold resistance in the YRB, and provide a basis for the stress resistance and stable production of late-seeded rapeseed and the development and utilization of winter fallow fields.
rapeseed; late-seeded; cold resistance; exogenous substance; soaking seeds
10.3724/SP.J.1006.2024.34134
本研究由湖北省重点研发计划项目(2023BBB028)和财政部和农业农村部国家现代农业产业技术体系建设专项(CARS-12)资助。
This study was supported by the Key Research and Development Plan of Hubei Province (2023BBB028) and the China Agriculture Research System of MOF and MARA (CARS-12).
徐正华, E-mail: xzh@mail.hzau.edu.cn
E-mail: xlwang@webmail.hzau.edu.cn
2023-08-05;
2024-01-12;
2024-02-09.
URL: https://link.cnki.net/urlid/11.1809.S.20240206.1532.010
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
