耐亚磷酸盐除草剂转基因油菜的创建和抗性评价
2024-04-28朱天宇马朝芝
钟 元 朱天宇 戴 成 马朝芝
耐亚磷酸盐除草剂转基因油菜的创建和抗性评价
钟 元 朱天宇 戴 成 马朝芝*
华中农业大学作物遗传改良全国重点实验室 / 国家油菜工程技术研究中心 / 洪山实验室, 湖北武汉 430070
在油菜的生产过程中, 大量伴生的杂草严重影响了其产量和品质。由于近年来田间抗除草剂杂草数量的增加, 除草剂的选择正在迅速减少, 这影响了未来农业的可持续发展。植物可以通过正磷酸盐(Pi)转运蛋白吸收亚磷酸盐(Phi), 但Phi不能被代谢为作物的磷肥料, 导致植物生长受到抑制。此前, 从罗尔斯通菌属(sp. strain 4506)中分离出了(phosphite dehydrogenase)基因, 其139位的酪氨酸突变为谷氨酰胺(Y139Q)的突变蛋白ptxDQ催化Phi转化为Pi的活性显著提高。为了评价ptxD/Phi系统对甘蓝型油菜杂草的防治效果, 本研究获得了带有密码子优化的(Y139Q,ptxD)基因的转基因甘蓝型油菜。在以Phi为单一磷元素的条件下,ptxD转基因油菜可以正常生长, 体内Pi含量显著提高, 且Pi饥饿响应基因(和等)的表达水平被显著抑制, 说明ptxD在油菜体内可以促使Phi转化为Pi。此外,ptxD转基因油菜具有比野生型油菜和单子叶杂草(狗尾草)更强的生长竞争优势。综上所述,ptxD/Phi是一种有效的油菜磷利用和杂草控制系统, 既可以抑制杂草的生长, 又可以为作物提供充足的Pi营养, 从而提高了农业的可持续性。
甘蓝型油菜; 除草剂; 亚磷酸盐;
油菜是十字花科芸薹属植物, 主要有油用、菜用和观赏等用途[1]。在油菜整个生长周期中, 田间常会有大量的杂草伴生, 对油菜的产量和品质产生影响, 杂草会与油菜争夺肥、光、水和生存空间等, 造成油菜减产10%~15%, 严重的甚至会减产50%以上[2]。为了保障和稳定油菜安全生产, 必须提高对草害的防治效率。目前, 化学防治是农业现代化进程中应用最为广泛的杂草防治方法。相较于人工除草、轮作、生物防治、浅耕灭草等传统技术, 化学除草效果显著、人工成本低且不改变土层结构。然而农药的大量使用不仅会破坏土壤中的生物多样性, 还会危害人体健康[3]。现阶段, 除草剂被广泛用于控制杂草。乙胺磺隆、苯唑啉乙基和喹唑磷乙基(苯磺隆、草甘膦、草铵膦)都是油菜地常用的除草剂[4-6]。然而化学除草剂长期过量使用, 会导致农田中抗除草剂杂草数量急剧增加。因此, 迫切需要开发能够有效治理杂草的新工具, 特别是非除草工具, 以有效地管理杂草。
磷(P)是一种必需的常量营养素, 它通过被吸收成重要的细胞成分而起着至关重要的作用, 是所有生物体所必需的[7-9]。磷酸盐主要有2种形式, 正磷酸盐(Pi)和亚磷酸盐(Phi)[10-12]。Phi是Pi的一种简化形式, 其中一个氧原子被氢原子取代[13], 它被广泛用于控制卵菌病原菌引起的植物真菌病害[14-16]。虽然植物可以通过Pi转运体吸收Phi, 但Phi不能被代谢为作物的磷肥[17-19]。亚磷酸酯脱氢酶()基因来源于细菌(如WM88), 它编码一种催化Phi氧化成Pi的酶[18,20]。转基因株系使植物将Phi作为磷的唯一来源进行发育[21-23],/Phi系统作为杂草控制的非除草剂工具, 已成功应用于许多作物中, 如水稻、玉米和棉花等[19,23-24]。此外,/Phi系统在不使用抗生素/除草剂抗性基因的转基因植物中具有很大的潜力[25-26]。
从sp. 4506(PtxDR4506)中分离到基因[27], 通过定向进化获得了第139位酪氨酸突变为谷氨酰胺的ptxD突变蛋白(Y139Q, ptxDQ), 其催化Phi转化为Pi的效率比PtxDR4506提高了5.8倍[27]。在此基础上, 我们优化了ptxD的密码子, 构建了转化油菜的双元载体pCambia1300-ptxD, 将载体转化到油菜, 获得了ptxD转基因油菜株系。转基因株系可以在只有Phi存在的情况下正常生长, 且在提供Phi的条件下可抑制Pi饥饿诱导的基因的表达水平, 表明ptxD转基因油菜可以将Phi转化为Pi, 从而提供其生长所需的Pi。此外, 当P以Phi的形式供给时,ptxD转基因甘蓝型油菜在人工基质中的竞争优势超过了狗尾草()这类单子叶杂草。以上结果表明,ptxD/Phi技术是一种较好的油菜杂草抑制系统。
1 材料与方法
1.1 试验材料和生长条件
以甘蓝型油菜‘Westar’为材料进行植株转化。所有野生型(Westar、B409和Damor)和转基因植株均在20~23℃、光照强度为100 μmol m–2s–1、相对湿度为60%的温室中生长(光照/暗时间16 h/8 h)。
1.2 载体构建
本研究以pcb11-P139Q为模板(华中农业大学植物科学技术学院吴高兵老师惠赠), 用ptxD基因特异性引物进行片段PCR扩增, 跑胶确认目的基因ptxD扩增产物。再与线性化后的载体进行重组, 转化大肠杆菌DH5α, 挑取单克隆进行PCR检测, 阳性菌株送公司经测序确认, 提取质粒并保存于–20℃, 得到植物表达载体-ptxD。进一步用电转法将新构建的植物表达载体p1300-ptxD转入农杆菌, 28℃培养36~48 h后挑选单菌落, 用引物ptxD-F、ptxD- R进行阳性鉴定。相关引物见表1。
1.3 甘蓝型油菜转基因植株的产生与筛选
在获得-ptxD载体后, 通过农杆菌介导的油菜遗传转化获得转基因株系。农杆菌介导的甘蓝型油菜的转化过程参考实验室先前的研究方法[28]:将构建的载体转农杆菌后侵染油菜受体材料Westar的下胚轴, 经过组织培养的继代转化方式获得阳性苗。用Hygromycin B (120 µg mL–1)、Phi (1 mmol L–1)或Phi + Pi (1.5 mmol L–1+ 0.5 mmol L–1)筛选阳性愈伤组织和转基因植株。其中M2是愈伤诱导培养基, M3、M4分别是芽分化与根诱导的培养基。利用ptxD基因特异性引物对T0代转基因系进行PCR扩增。相关引物见表1。
1.4 RNA提取和qRT-PCR分析
叶片组织收集自ptxD的转基因系和有或无Phi处理的野生型油菜。利用RNA Prep Pure Plant Kit (Cat. No. LS1040, Promega, 美国)试剂盒提取植物组织RNA, 利用Transcript RT kit (Cat. No. AE311, TransGen Biotech, 中国)反转录获得cDNA, 反转录产物稀释100倍作为模板。为内参基因。qRT-PCR反应体系为2×SYBR Green Master Mix 5 μL, 包含上下游引物各0.4 μL、cDNA模板4.2 μL。qRT-PCR反应程序为95℃ 5 min; 95℃ 30 s, 59℃ 1 min, 72℃ 10 min, 30个循环。每个处理3个生物学重复, 依照2–ΔΔCt方法分析基因相对表达量。相关引物见表1。
1.5 油菜磷元素含量的测定
将ptxD的T1代转基因系和甘蓝型油菜‘Westar’在Hoagland培养基中萌发1周, 然后使用无P、Pi (KH2PO4)和不同Phi (KH2PO3)浓度的营养液中再萌发2周。将0.2~0.3 g完全干燥的样品磨成粉末, 加入30 mL去离子水转移到50 mL容量瓶中。然后加入2滴2,6二硝基苯酚指示剂, 用6 mol L–1NaOH调节pH至黄色, 加入10 mL钼酸钒铵溶液混合均匀,最后用水定容。采用分光光度计(UV2100, UNICO, 中国)在440 nm波长处测定无机Pi的浓度。以适当浓度的KH2PO4作为标准。根据公式计算磷含量: P (µg g–1叶鲜重) = C × (V/W)。式中: C为提取液的磷含量(µg mL–1); V为提取液的体积(mL); W为样品鲜重(g)。
1.6 转基因甘蓝型油菜的生长
以无磷MS培养基(不含KH2PO4, 货号PM1011- P)为基础, 添加不同浓度的KH2PO3(1 mmol L–1、2 mmol L–1、4 mmol L–1和8 mmol L–1)和1 mmol L–1的KH2PO4, 将油菜种子播种到这些培养基上, 生长7 d后, 观察其生长表现。
营养液水培: 将生长7 d左右的幼苗用海绵固定在穴盘上面, 使用无P、1 mmol L–1Pi和4 mmol L–1Phi的营养液水培, 在温室(16 h光照, 8 h黑暗)继续培养。
营养液土培: 将T1子代培养在沙子︰蛭石=1︰1的塑料托盘中, 并用含无P、1 mmol L–1Pi、4 mmol L–1Phi和8 mmol L–1Phi的营养液浇灌, 在温室进行培养。
在播种后2周测量其鲜重、株高和根长, 用SPAD-502仪测定叶片叶绿素含量。每次加入的所有分析至少重复3次。在一个重复中, 每组数量为15~20株。
1.7 杂草的竞争试验
为了检验ptxD/Phi系统对杂草(狗尾草)的防治效果, 将T1子代、野生型Westar油菜和杂草播种在塑料托盘中, 用沙子︰蛭石=1︰1, 用含有8 mmol L–1Phi或1 mmol L–1Pi的营养液作为P源浇灌3周。在竞争试验中, 在试验结束当天, 对每个处理的代表性托盘进行拍照, 并确定植物的生长参数。所有参数采用SPSS Statistics Base (version 22)软件进行统计分析。采用单因素方差分析和检验评估显著差异。

表1 本研究中使用的引物
2 结果与分析
2.1 创建ptxDQ转基因甘蓝型油菜
由于缺乏Phi分解代谢酶, 植物的生长发育会受到Phi的抑制[29-30]。本研究首先考察了甘蓝型油菜Westar对Phi处理是否敏感。以无磷MS培养基(不含KH2PO4)为基础, 添加不同浓度的KH2PO3(1 mmol L–1、2 mmol L–1、4 mmol L–1和8 mmol L–1)和1 mmol L–1的KH2PO4, 将Westar种子播种到这些培养基上, 生长7 d后, 观察其生长表现。与无P条件下生长的Westar植株相比, 在1 mmol L–1Pi条件下的幼苗生长良好, 下胚轴长度约为无P条件下长度的1.4倍(图1-a, b)。在Phi条件下, 甘蓝型油菜Westar的根长和鲜重受到抑制, 且与Phi的浓度呈正相关关系, 当Phi浓度为8 mmol L–1时, 其鲜重和根长分别下降了约49%和65% (图1-c, d), 说明甘蓝型油菜Westar对Phi处理敏感。为了分析Phi是否对不同生态型油菜都具有抑制作用, 本研究分析了3种油菜品系Westar、Damor和B409在水培条件下对Phi的敏感度。将在正常条件下萌发7 d的油菜幼苗转移到含有4 mmol L–1Phi或1 mmol L–1Pi的Hoagland培养液中(附图1-a), 生长2周后发现, 与Pi处理相比, 在Phi处理下的Westar、Damor和B409生长都受到了严重的抑制(附图1-b), 其中根长下降了25%左右(附图1-c), 鲜重下降了62.5%左右(附图1-d), 表明Phi对不同的油菜品系都有抑制作用。
在此之前, 从sp. 4506菌株中克隆了基因(PtxD), 蛋白序列分析结果表明, PtxDR4506与假单胞杆菌来源的PtxD蛋白(PtxDWM88)同源性为54 % (附图2)。在PtxD基础上, 通过定向进化获得了第139位酪氨酸突变为谷氨酰胺的ptxD突变蛋白(Y139Q, ptxDQ), 其催化Phi转化为Pi的效率比PtxDR4506提高了5.8倍[27]。为检测ptxDQ在油菜中是否具有生物学功能, 我们将ptxD的基因序列进行密码子优化, 进一步扩增ptxD基因片段, 构建到pCambia1300载体中, 获得载体p1300- ptxDQ(图1-e)。其中35S启动子驱动ptxD基因表达(图1-e), 此外该载体还包含一个潮霉素抗性基因的位点(HygR) (图1-e)。
/Phi系统在多个植物中已经证明可以用于转基因植株的筛选[17,19,22-23,25-26]。为了验证/Phi系统是否可以用于转基因油菜的筛选, 本研究将p1300-ptxD载体转化至油菜受体Westar中, 分别以HygB (120 µg mL–1)、Phi (1 mmol L–1)和Phi + Pi (1.5 mmol L–1+0.5 mmol L–1)为筛选剂筛选阳性愈伤。在HygB为筛选剂的条件下, 油菜愈伤可以正常膨大并分化出芽(图1-f)。在以Phi为单一磷元素的条件下, 油菜愈伤虽然可以分化, 但是在芽分化培养基上(M3), 愈伤不能正常膨大, 且没有分化出芽(附图3-a), 说明在Phi为单一磷元素的筛选条件下, 不能获得油菜转基因株系。在Phi + Pi (1.5 mmol L–1+ 0.5 mmol L–1)筛选条件下, 愈伤组织和芽均生长良好(图1-f, g)。其中, 81.47%~90.32 %的外植体在Phi + Pi筛选条件下转化为愈伤, 29.23%~49.07%的外植体在HygB条件下转化为愈伤(表2)。0.64%~1.73%外植体在Phi + Pi筛选条件下分化出正常生长的植株; 3.22%~4.17%外植体在HygB筛选条件下分化出正常生长的植株(表2)。最终获得了油菜转化再生苗共41株, 其中基于Pi+Phi筛选得到了11株, 基于HygB筛选得到了30株(表2)。
为了进一步验证筛选所获得的植株是阳性转基因株系, 本研究设计了特异性扩增ptxD基因片段的引物。PCR结果显示, 通过HygB筛选所获得的30株再生苗均扩增出1009 bp大小的特异性条带(附图3-b), 而通过Pi+Phi筛选得到的11株再生苗未扩增出目的条带(附图3-b)。说明, 目前的组培筛选条件(Phi + Pi: 1.5 mmol L–1+ 0.5 mmol L–1)不适用于油菜转基因株系的筛选。进一步通过RT-PCR鉴定ptxD基因在转基因株系中的表达水平。与野生型对照(Westar)相比, 6个转基因株系(L1、L4、L5、L10、L22和L24)均检测到ptxD基因的表达(图1-h)。进一步通过qRT-PCR验证上述6个转基因株系中ptxD基因的表达水平。结果显示,ptxD基因在5个转基因株系(L1、L4、L5、L10和L22)中的表达水平均显著高于野生型对照(Westar) (图1-i), 其中L5和L10的表达量最高。此外, 我们检测了ptxD基因在L10株系各个组织中的表达水平, RT-PCR结果显示L10植株的根、茎、叶样品均扩增出216 bp的目的条带(附图3-c), 说明ptxD基因在L10转基因油菜植株的根、茎、叶中都有表达。最终选择表达量较高的2个转基因油菜株系L5和L10进行后续研究。

图1 含有密码子优化ptxDQ的转基因甘蓝型油菜的产生
(a) 甘蓝型油菜Westar在Pi和不同Phi浓度处理7 d后的生长情况。标尺为2 cm。(b) 生长7 d后下胚轴长度的统计情况。(c) 生长7 d后根长的统计情况。(d) 生长7 d后鲜重的统计情况。(e) 植物转化载体p1300-ptxD示意图。(f)和(g)以120 µg mL–1Hygromycin B和0.5 mmol L–1Pi +1.5 mmol L–1Phi为筛选剂进行转化。标尺为2 cm。(h) 油菜再生苗RNA水平的PCR鉴定。(i) 油菜再生苗ptxD基因相对表达量分析。数字编号为不同的油菜再生苗单株, M为marker,为油菜内参基因。使用检验进行显著性检验, *、**、***分别表示在0.05、0.01、0.001概率水平差异显著。
(a): the growth ofWestar treated with Pi and Phi at different concentrations for 7 days. Scale bar: 2 cm. (b): statistics of hypocotyl length after 7 days of growth. (c): statistics on root length after 7 days of growth. (d): Statistics on fresh weight after 7 days of growth. (e): Schematic diagram of the plant transformation vectorp1300-ptxD. (f) and (g): 120 µg mL–1hygromycin B and 0.5 mmol L–1Pi + 1.5 mmol L–1Phi were used as the screening agents for transformation. Scale bar: 2 cm. (h): PCR identification of RNA levels inseedlings. (i): the relative expression level ofptxDgene inregenerated seedlings. The numbers are differentregenerated seedling monocots, M is marker, andisinternal gene. The significance is analyzed by t-test. *, **, and *** mean significant difference at the 0.05, 0.01, and 0.001 probability levels, respectively.

表2 同一载体(pCMBIA1300-PtxDQ)不同筛选剂的转化情况统计
2.2 ptxDQ转基因油菜可以利用亚磷酸盐作为磷的唯一来源
为了研究ptxD过表达的甘蓝型油菜是否可以利用亚磷酸盐转变为磷酸盐来供油菜的生长发育, 本研究将对照(Westar)和T1代转基因植株(L5和L10)分别培养在塑料托盘中, 其中沙子和蛭石的比例为1︰1。分别用含无磷(No P)、4 mmol L–1Phi和1 mmol L–1Pi的Hogland营养液处理。播种14 d后, 在无磷和1 mmol L–1Pi条件下, 对照(Westar)和ptxD过表达株系的生长差异不明显(图2-a); 在Phi处理下, 对照(Westar)长势较弱, 而ptxD过表达株系(L5和L10)长势相对正常(图2-a)。播种后56 d时, 与1 mmol L–1Pi处理条件相比, 对照(Westar)在不含P和Phi处理下的生长受到非常强的抑制(图2-b);ptxD过表达株系(L5和L10)在不含磷和1 mmol L–1Pi处理条件下和对照无显著差异, 而在外施4 mmol L–1Phi的条件下,ptxD过表达株系可以正常生长(图2-b)。此外, 对照材料和ptxD过表达株系在Pi处理下在第68天左右开花, 而在Phi处理下,ptxD过表达株系在第76天开花, 对照材料Westar第89天时才开花(图2-c)。
SPAD-502仪测定叶片叶绿素含量结果显示, 不含P和Pi处理下的对照材料Westar和T1代ptxD过表达株系的SPAD值没有显著差异(图2-d); 但外施Phi后, 转基因植株L5和L10的叶绿素水平高于野生型植株Westar (图2-d)。进一步测定了对照株系Westar和ptxD过表达株系在不同处理条件下植物体内的Pi含量, 结果表明, 对照材料Westar在无P和Pi处理条件下, Pi含量分别为0.25 mg g–1DW和0.90 mg g–1DW,ptxD过表达株系L5和L10在无P和Pi处理条件下, Pi含量也分别在0.25 mg g–1DW和0.95 mg g–1DW, 两者之间并无显著差异(图2-e)。在Phi处理条件下, 对照(Westar)体内Pi含量为0.25 mg g–1DW, 而ptxD转基因植株的Pi水平为2.0~2.2 mg g–1DW, 显著高于对照植株(图2-e)。表明ptxD转基因株系可以有效地将Phi转变为Pi, 从而提高转基因油菜的生物量和叶绿素相对含量。
已有研究结果表明, 拟南芥磷转运蛋白(、和)和磷响应转录因子()编码基因在植物缺P或低P条件下会显著上调[31-33]。本研究进一步检测对照株系(Westar)和T1代ptxD过表达株系(L5和L10)在无P、含有Phi或Pi培养2周后, 磷饥饿诱导基因的表达水平。在对照(Westar)材料中,、、和基因的表达水平在无P和Phi处理下与Pi处理相比显著提高(图3), 说明油菜、、和同源基因也受到低磷的诱导。在ptxD过表达株系中,等基因的表达水平在无P的条件下被显著诱导; 而Phi处理后,等基因的表达水平与Pi处理后的表达水平无显著差异(图3)。进一步说明ptxD可以将Phi转变为Pi, 抑制低磷响应基因的表达水平。
2.3 ptxDQ油菜在Phi处理下比杂草竞争力强
为了检测Phi作为除草剂的可行性, 我们将对照材料(Westar)、T1代ptxD过表达株系(L5和L10)和单子叶杂草(狗尾草)分别培养在塑料托盘中, 分别用含无磷(No P)、8 mmol L–1Phi和1 mmol L–1Pi的Hogland营养液处理。添加Pi后, 狗尾草、野生型植株Westar和两个转基因品系L5和L10生长旺盛(图4-a, b)。与Pi处理相比, 在Phi处理下野生型植株Westar和狗尾草的生长受到了显著的抑制, 而ptxD转基因株系L5和L10无显著的差异(图4-a, b)。经Phi处理后, 狗尾草的鲜重显著降低, 约为Pi处理条件下的54% (图4-c);ptxD转基因植株幼苗的鲜重也降低, 约为Pi处理条件下的26%, 与降低了84%的Westar相比, 显著高于野生型植株Westar和狗尾草(图4-d)。Phi处理过的ptxD转基因植株的株高和根长度也没有受到抑制, 它们比Phi处理过的野生型植株Westar更长(图4-d), 这表明Phi具有作为苗期前除草剂杀死或抑制田间杂草的潜力。有意思的是, T1代ptxD过表达株系中有部分植株在外施Phi条件下, 植株生长显著被抑制(图4-e), 进一步利用ptxD基因特异性引物检测部分株系(图4-e中红框标记)的基因组中是否插入了ptxD基因片段, 通过PCR结果显示, 生长受抑制的株系均不能扩增ptxD基因特异性条带(图4-e), 推测T1代ptxD过表达株系中出现了分离。我们后续会扩大群体, 通过Southern blot等其他方法来检测其拷贝数和计算分离比。
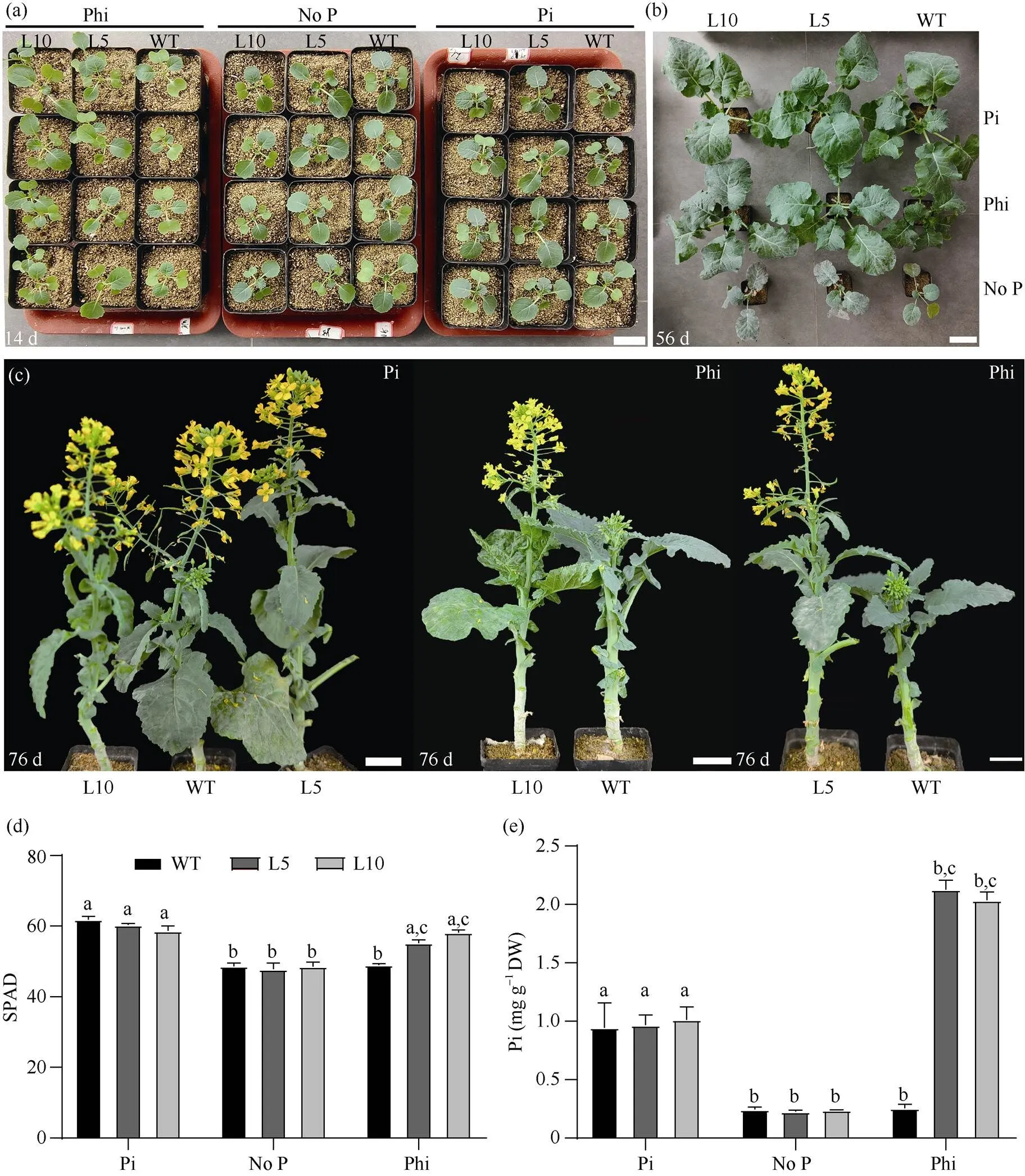
图2 沙培水培法研究Phi对野生型和ptxDQ转基因甘蓝型油菜植株生长的影响
(a)~(c)野生型植株和2个ptxD转基因系(L5和L10, T1代)在沙培养(沙 : 蛭石=1:1)中分别生长14 d (a)、56 d (b)和76 d (c), 分别用无P、Pi或Phi营养液处理。(a)~(c)中比例尺分别为3 cm、7 cm、7 cm。(d) 柱状图为不含P、Pi或Phi营养液灌溉2周后野生型植株和2个ptxD转基因品系的SPAD值。(e)柱状图为不加P、Pi或Phi营养液灌溉2周后野生型植株和2个ptxD转基因品系的Pi含量。使用检验进行显著性检验: 当≤ 0.05时, 如果用不同的小写字母标注, 则条形图代表的值存在显著差异。
(a)–(c): the image shows the Westar plants and twoptxDtransgenic lines (L5 and L10, T1generation) grown in sand culture (sand : vermiculite = 1:1) for 14-day (a), 56-day (b) and 76-day (c) by irrigating no P, Pi, or Phi nutrient solutions. In (a)–(c), the scale bar was 3, 7, and 7 cm, respectively. (d): bar graph shows the SPAD values of Westar and twoptxDtransgenic lines irrigated by no P, Pi, or Phi nutrient solutions for two weeks. (e): bar graph shows the Pi contents of Westar and twoptxDtransgenic lines irrigated by no P, Pi, or Phi nutrient solutions for two weeks. Different lowercase letter indicates significant difference at≤ 0.05 by-test.
(a)的相对表达量; (b)的相对表达量; (c)的相对表达量; (d)的相对表达量。使用检验进行显著性检验: 当≤ 0.05时, 如果用不同的小写字母标记, 则条形图代表的值存在显著差异。
(a): the relative expression level of; (b): the relative expression level of; (c): the relative expression levels of; (d): the relative expression of. Different lowercase letter indicates significant difference at≤ 0.05 by-test.

(图4)
(a)和(b) Westar、狗尾草和转基因植株在Pi和Phi处理3周后的生长发育情况, Pi浓度为1 mmol L-1, Phi浓度为8 mmol L-1。(a) 标尺为5 cm; (b) 标尺为2 cm。(c) 柱状图为(a)所示43株狗尾草的鲜重。使用检验进行显著性检验: ***,< 0.0001。(d) Westar和转基因植株在Pi和Phi处理3周后的鲜重、株高、根长的情况。(e) T1代转基因株系中的ptxD特异性条带的PCR分析。1~5, 表示L10的不同转基因植株。使用检验进行显著性检验: 当≤ 0.05时, 如果用不同的小写字母标记, 则条形图代表的值存在显著差异。
(a) and (b): growth and development of Westar, Setaria, and transgenic plants after 3 weeks of Pi and Phi treatment, Pi concentration was 1 mmol L-1, Phi concentration was 8 mmol L-1, (a) Scale bar: 5 cm; (b) Scale bar: 2 cm. (c): bar graph shows fresh weight ofrepresenting in (a).The significance is analyzed by-test: ***:< 0.0001.(d): fresh weight, plant height, and root length of Westar and transgenic plants after 3 weeks of Pi and Phi treatment. (e):ptxDspecific band in T1transgenic lines by PCR.1-5, indicated different transgenic plants of L10. Different lowercase letter indicates significant difference at≤ 0.05 by-test.
3 讨论
油菜田间常伴生着大量的杂草, 严重影响了油菜的生产, 加上除草剂(如草甘膦等)过量使用, 油菜田间抗除草剂杂草的数量逐年增加[34-36]。已有研究表明,/Phi系统可以有效控制棉花和烟草中的杂草[19,22], 但是该系统在油菜中的应用还未见报道。本研究将来源于罗尔斯通菌中的ptxD基因转化到甘蓝型油菜,ptxD转基因油菜能够在以亚磷酸为唯一磷源的条件下正常生长, 且与杂草相比具有显著的生长优势, 为解决磷利用和控制油菜田间杂草提供了一条新途径。
由于除草剂在农业中的持续大量使用, 抗除草剂杂草的数量急剧增加, 因此需要寻找新的除草剂资源。常规除草剂针对特定的代谢酶, 如草甘膦可以抑制莽草酸途径(shikimate pathway)中的关键酶 5-烯醇式丙酮莽草酸-3-磷酸合酶(EPSPS)的活性[37]。此前已经有很多报道, 将EPSPS不同位点的脯氨酸突变可以显著降低草甘膦与EPSPS的结合[38-40]。其原理是随着氨基酸种类的改变, EPSPS的结构和功能发生变化, 从而使其与底物的亲和力增加, 导致草甘膦无法再占据PEP结合位点, 植物因此形成对草甘膦的抗性[41]。但是, 持续使用相同的除草剂加速了杂草的进化。Gaines等[42]发现了一种高度抗草甘膦的杂草, 其中基因扩增了100倍, 导致过表达40倍。植物的生长依赖于Pi的持续供应, 然而, 大部分Pi会与土壤中的金属离子(如Ca2+、Fe3+和Al3+)结合形成不溶性磷酸盐, 并且Pi被细菌迅速转化为不能被植物直接吸收和利用的有机形式[16,18,43]。磷肥的过量使用还会导致水系富营养化[44-45]。因此, 寻找能够替代磷的新型肥料成为农业可持续发展的迫切需要。与Pi相比, Phi具有独特的生化特性, 有更高的溶解度, 但与金属离子的化学反应性较低, 大多数微生物无法利用[44,46-47]。Phi在结构上类似于Pi, 植物能够通过Pi转运蛋白吸收Phi[13]。植物自身不能直接代谢Phi, 外施Phi显著抑制植物的生长发育[17-19], 表明Phi可以作为单子叶和双子叶植物的苗前和苗后除草剂。在自然界中, Phi可以被少数土壤和海洋细菌利用[14,26], 通过NAD依赖性亚磷酸酯氧化还原酶(PTXD)将Phi转化为Pi[47-49]。我们之前从sp. 4506(PtxDR4506)中克隆了基因, 通过定向进化将139位的酪氨酸突变为谷氨酰胺, 脱氢酶的催化活性显著提高[27]。ptxD转基因品系可以通过将Phi转化为Pi来缓解Phi对油菜的生长抑制(图2), 并通过提供Phi来减弱ptxD转基因品系的磷饥饿反应(图3)。这些结果表明, 我们可以利用ptxD基因建立以Phi为磷肥和除草剂的植物磷利用与杂草控制相结合的体系。此外我们可以看到, Phi可以抑制非转基因油菜和狗尾草的生长, 因此我们推测Phi对双子叶杂草可能也有同样的作用效果, 因为本研究所用的杂草为狗尾草, 在后续在试验过程中, 我们会在田间进行外施Phi观察其对双子叶杂草的防控效果。此外也会选择一些抗性杂草进行验证。
在组织培养中, 抗生素和除草剂抗性基因常被用作筛选转基因阳性植株的选择性标记。然而, 这些抗性基因有可能会转移到可共存的其他杂草中, 从而产生“超级杂草”和10种抗生素耐药性[50-51]。此外, 很少有选择性药物对植物细胞增殖和分化有负面影响[17,52]。由于可以作为植物遗传转化的新型选择性标记, 因此在植物生物技术发展过程中显示出巨大的潜力[25]。基因与以Phi为唯一磷源的选择性培养基结合, 作为一种有效的系统来选择多种植物的转化细胞[17,19,23]。我们发现Phi强烈抑制愈伤组织再生(附图2), 与烟草的研究结果一致[22]。在Phi培养基中添加了Pi后, 油菜愈伤可以进行再分化(图1-f), 并最终获得了再生苗, 但这些再生植株并不是阳性转基因株系, 推测可能是使用的Phi浓度过低, 加上转化的外植体数量不足等原因导致我们未能通过Phi筛选到阳性转基因株系,接下来我们将继续验证其作为油菜转化系统的可能性。
4 结论
本研究首先使用含有不同浓度的亚磷酸盐处理甘蓝型油菜, 结果表明, 随着亚磷酸浓度的升高, 油菜的生长被显著抑制, 表明亚磷酸对油菜幼苗的生长具有较强抑制作用。前期研究发现, 罗尔斯通菌属(sp. strain 4506)中ptxD蛋白139位的酪氨酸突变为谷氨酰胺(Y139Q)后能够提高其催化Phi转化为Pi的活性。在此基础上, 通过遗传转化将ptxD转入到甘蓝型油菜并获得阳性转基因株系。与对照植株相比,ptxD转基因油菜可以明显减轻亚磷酸盐对油菜生长的抑制作用, 且体内正磷酸盐含量在ptxD转基因株系中显著提高, 表明转基因油菜能将Phi氧化成Pi供油菜生长发育。此外,p1300- ptxD转基因油菜比狗尾草具有更强的生长竞争优势, 表明ptxD/Phi系统可以有效控制杂草生长。综上所述,ptxD转基因油菜具有将Phi转化为Pi的能力, 从而赋予其在Phi条件下比野生型油菜和杂草更强的生长竞争优势, 表明ptxD/Phi是有效的油菜磷利用和杂草控制系统, 为有效解决油菜磷利用和杂草控制提供了全新的可行方案。
[1] 李利霞, 陈碧云, 闫贵欣, 高桂珍, 许鲲, 谢婷, 张付贵, 伍晓明. 中国油菜种质资源研究利用策略与进展. 植物遗传资源学报, 2020, 21: 1–19. Li L X, Chen B Y, Yan G X, Gao G Z, Xu K, Xie T, Zhang F G, Wu X M. Proposed strategies and current progress of research and utilization of oilseed rape germplasm in China., 2020, 21: 1–19 (in Chinese with English abstract).
[2] 敖礼林, 余增钢, 饶卫华. 油菜田杂草综合高效防控技术. 科学种养, 2019, (1): 39–40. Ao L L, Yu Z G, Rao W H. Comprehensive and efficient prevention and control technology of weeds in rapeseed fields., 2019, (1): 39–40 (in Chinese).
[3] de F Sousa M G, da Silva A C, Dos Santos Araújo R, Rigotto R M. Evaluation of the atmospheric contamination level for the use of herbicide glyphosate in the northeast region of Brazil., 2019, 191: 604.
[4] Heap I, Duke S O. Overview of glyphosate-resistant weeds worldwide., 2018, 74: 1040–1049.
[5] Husken A, Dietz-Pfeilstetter A. Pollen-mediated intraspecific gene flow from herbicide resistant oilseed rape (L.)., 2007, 16: 557–569.
[6] Squire G R, Hawes C, Begg G S, Young M W. Cumulative impact of GM herbicide-tolerant cropping on arable plants assessed through species-based and functional taxonomies., 2009, 16: 85–94.
[7] Schachtman D P, Reid R J, Ayling S M. Phosphorus uptake by plants:from soil to cell., 1998, 116: 447–453.
[8] Sun S, Wang L, Mao H, Shao L, Li X, Xiao J, Ou-Yang Y, Zhang Q. A G-protein pathway determines grain size in rice., 2018, 9: 851.
[9] Wang Y, Chen Y F, Wu W H. Potassium and phosphorus transport and signaling in plants., 2021, 63: 34–52.
[10] Bozzo G G, Singh V K, Plaxton W C. Phosphate or phosphite addition promotes the proteolytic turnover of phosphate- starvation inducible tomato purple acid phosphatase isozymes., 2004, 573: 51–54.
[11] Eshraghi L, Anderson J P, Aryamanesh N, McComb J A, Shearer B, Hardy G S. Suppression of the auxin response pathway enhances susceptibility towhile phosphite- mediated resistance stimulates the auxin signalling pathway., 2014, 14: 68.
[12] Kariman K, Barker S J, Jost R, Finnegan P M, Tibbett M. Sensitivity of jarrah () to phosphate, phosphite, and arsenate pulses as influenced by fungal symbiotic associations., 2016, 26: 401–415.
[13] Burra D D, Berkowitz O, Hedley P E, Morris J, Resjo S, Levander F, Liljeroth E, Andreasson E, Alexandersson E. Phosphite- Induced changes of the transcriptome and secretome inleading to resistance against., 2014, 14: 254.
[14] Achary V M M, Ram B, Manna M, Datta D, Bhatt A, Reddy M K, Agrawal P K. Phosphite: a novel P fertilizer for weed management and pathogen control., 2017, 15: 1493–1508.
[15] Danova-Alt R, Dijkema C, DE Waard P, Kock M. Transport and compartmentation of phosphite in higher plant cells: kinetic and31P nuclear magnetic resonance studies., 2008, 31: 1510–1521.
[16] Thao H T B, Yamakawa T, Myint A K, Sarr P S. Effects of phosphite, a reduced form of phosphate, on the growth and phosphorus nutrition of spinach (L)., 2008, 54: 761–768.
[17] Dormatey R, Sun C, Ali K, Fiaz S, Xu D R, Calderon-Urrea A, Bi Z Z, Zhang J L, Bai J P./Phi as alternative selectable marker system for genetic transformation for bio-safety concerns: a review., 2021, 9: e11809.
[18] Loera-Quezada M M, Leyva-Gonzalez M A, Lopez-Arredondo D, Herrera-Estrella L. Phosphite cannot be used as a phosphorus source but is non-toxic for microalgae., 2015, 231: 124–130.
[19] Pandeya D, Lopez-Arredondo D L, Janga M R, Campbell L M, Estrella-Hernandez P, Bagavathiannan M V, Herrera-Estrella L, Rathore K S. Selective fertilization with phosphite allows unhindered growth of cotton plants expressing thegene while suppressing weeds., 2018, 115: E6946–E6955.
[20] Costas A M, White A K, Metcalf W W. Purification and characterization of a novel phosphorus-oxidizing enzyme fromWM88., 2001, 276: 17429–17436.
[21] Changko S, Rajakumar P D, Young R E B, Purton S. The phosphite oxidoreductase gene,as a bio-contained chloroplast marker and crop-protection tool for algal biotechnology using., 2020, 104: 675–686.
[22] Lopez-Arredondo D L, Herrera-Estrella L. Engineering phosphorus metabolism in plants to produce a dual fertilization and weed control system., 2012, 30: 889–893.
[23] Nahampun H N, Lopez-Arredondo D, Xu X, Herrera-Estrella L, Wang K. Assessment ofgene as an alternative selectable marker for-mediated maize transformation., 2016, 35: 1121–1132.
[24] Manna M, Achary M M, Islam T, Agrawal P K, Reddy M K. The development of a phosphite-mediated fertilization and weed control system for rice., 2016, 6: 24941.
[25] Lopez-Arredondo D L, Herrera-Estrella L. A novel dominant selectable system for the selection of transgenic plants underand greenhouse conditions based on phosphite metabolism., 2013, 11: 516–525.
[26] Pandeya D, Campbell L M, Nunes E, Lopez-Arredondo D L, Janga M R, Herrera-Estrella L, Rathore K S.gene in combination with phosphite serves as a highly effective selection system to generate transgenic cotton (L)., 2017, 95: 567–577.
[27] Liu T T, Yuan L L, Deng S R, Zhang X X, Cai H M, Ding G D, Xu F S, Shi L, Wu G B, Wang C. Improved the activity of phosphite dehydrogenase and its application in plant biotechnology., 2021, 9: 764188.
[28] Dai C, Li Y, Li L, Du Z, Lin S, Tian X, Li S, Yang B, Yao W, Wang J, Guo L, Lu S. An efficient-mediated transformation method using hypocotyl as explants for., 2020, 40: 96.
[29] Carswell C, Grant B R, Theodorou M E, Harris J, Niere J O, Plaxton W C. The fungicide phosphonate disrupts the phosphate-starvation response in Brassica nigra seedlings., 1996, 110: 105–110.
[30] Varadarajan D K, Karthikeyan A S, Matilda P D, Raghothama K G. Phosphite, an analog of phosphate, suppresses the coordinated expression of genes under phosphate starvation., 2002, 129: 1232–1240.
[31] Ren F, Guo Q Q, Chang L L, Chen L, Zhao C Z, Zhong H, Li X B.gene encoding a MYB-like protein functions in response to phosphate starvation., 2012, 7: e44005.
[32] Ren F, Zhao C Z, Liu C S, Huang K L, Guo Q Q, Chang L L, Xiong H, Li X B. APHT1 phosphate transporter, BnPht1;4, promotes phosphate uptake and affects roots architecture of transgenic., 2014, 86: 595–607.
[33] Li Y, Wang X, Zhang H, Wang S, Ye X, Shi L, Xu F, Ding G. Molecular identification of the phosphate transporter family 1 () genes and their expression profiles in response to phosphorus deprivation and other abiotic stresses in., 2019, 14: e220374.
[34] Buddenhagen C E, James T K, Ngow Z, Hackell D L, Rolston M P, Chynoweth R J, Gunnarsson M, Li F, Harrington K C, Ghanizadeh H. Resistance to post-emergent herbicides is becoming common for grass weeds on New Zealand wheat and barley farms., 2021, 16: e0258685.
[35] Green J M, Siehl D L. History and outlook for glyphosate- resistant crops., 2021, 255: 67–91.
[36] Holmes K H, Lindquist J L, Rebarber R, Werle R, Yerka M, Tenhumberg B. Modeling the evolution of herbicide resistance in weed species with a complex life cycle., 2022, 32: e02473.
[37] Zabalza A, Orcaray L, Fernandez-Escalada M, Zulet-Gonzalez A, Royuela M. The pattern of shikimate pathway and phenylpropanoids after inhibition by glyphosate or quinate feeding in pea roots., 2017, 141: 96–102.
[38] Wakelin A, Preston C. A target-site mutation is present in a glyphosate-resistantpopulation., 2006, 46: 432–440.
[39] Yu Q, Cairns A, Powles S. Glyphosate, paraquat and ACCase multiple herbicide resistance evolved in abiotype., 2007, 225: 499–513.
[40] Baerson S R, Rodriguez D J, Tran M, Feng Y, Biest N A, Dill G M. Glyphosate-resistant goosegrass. Identification of a mutation in the target enzyme 5-enolpyruvylshikimate-3-phosphate synthase., 2002, 129: 1265–1275.
[41] Sammons R D, Gaines T A. Glyphosate resistance: state of knowledge., 2014, 70: 1367–1377.
[42] Gaines T A, Zhang W, Wang D, Bukun B, Chisholm S T, Shaner D L, Nissen S J, Patzoldt W L, Tranel P J, Culpepper A S, Grey T L, Webster T M, Vencill W K, Sammons R D, Jiang J, Preston C, Leach J E, Westra P. Gene amplification confers glyphosate resistance in., 2010, 107: 1029–1034.
[43] Robertson I D, Dean L M, Rudebusch G E, Sottos N R, White S R, Moore J S. Alkyl phosphite inhibitors for frontal ring-opening metathesis polymerization greatly increase pot life., 2017, 6: 609–612.
[44] Mehta D, Ghahremani M, Perez-Fernandez M, Tan M, Schlapfer P, Plaxton W C, Uhrig R G. Phosphate and phosphite have a differential impact on the proteome and phosphoproteome ofsuspension cell cultures., 021, 105: 924–941.
[45] Rima F B, da Silva Y, Teixeira M P R, Maia A J, Assis K G O, da Silva R, de Souza Junior V S, da Silva Y, Lopes J W B, Barbosa R S, Singh V P. Phosphorus in soils and fluvial sediments from a Cerrado biome watershed under agricultural expansion., 2022, 194: 388.
[46] Baammi S, Daoud R, El Allali A. Assessing the effect of a series of mutations on the dynamic behavior of phosphite dehydrogenase using molecular docking, molecular dynamics and quantum mechanics/molecular mechanics simulations., 2023, 41: 4154–4166.
[47] Gonzalez-Morales S I, Pacheco-Gutierrez N B, Ramirez- Rodriguez C A, Brito-Bello A A, Estrella-Hernandez P, Herrera-Estrella L, Lopez-Arredondo D L. Metabolic engineering of phosphite metabolism inPCC 7942 as an effective measure to control biological contaminants in outdoor raceway ponds., 2020, 13: 119.
[48] Sandoval-Vargas J M, Jimenez-Clemente L A, Macedo-Osorio K S, Oliver-Salvador M C, Fernandez-Linares L C, Duran-Figueroa N V, Badillo-Corona J A. Use of thegene as a portable selectable marker for chloroplast transformation in., 2019, 61: 461–468.
[49] Yuan H, Wang Y, Liu Y, Zhang M, Zou Z. A novel dominant selection system for plant transgenics based on phosphite metabolism catalyzed by bacterial alkaline phosphatase., 2021, 16: e0259600.
[50] Chavana J, Singh S, Vazquez A, Christoffersen B, Racelis A, Kariyat R R. Local adaptation to continuous mowing makes the noxious weeda superweed candidate by improving fitness and defense traits., 2021, 11: 6634.
[51] Garcia M J, Palma-Bautista C, Rojano-Delgado A M, Bracamonte E, Portugal J, Alcantara-de la Cruz R, De Prado R. The triple amino acid substitution TAP-IVS in thegene confers high glyphosate resistance to the superweed., 2019, 20: 2396.
[52] Scarrow R. Glyphosate resistance: of superweeds and survivors., 2017, 3: 17078.
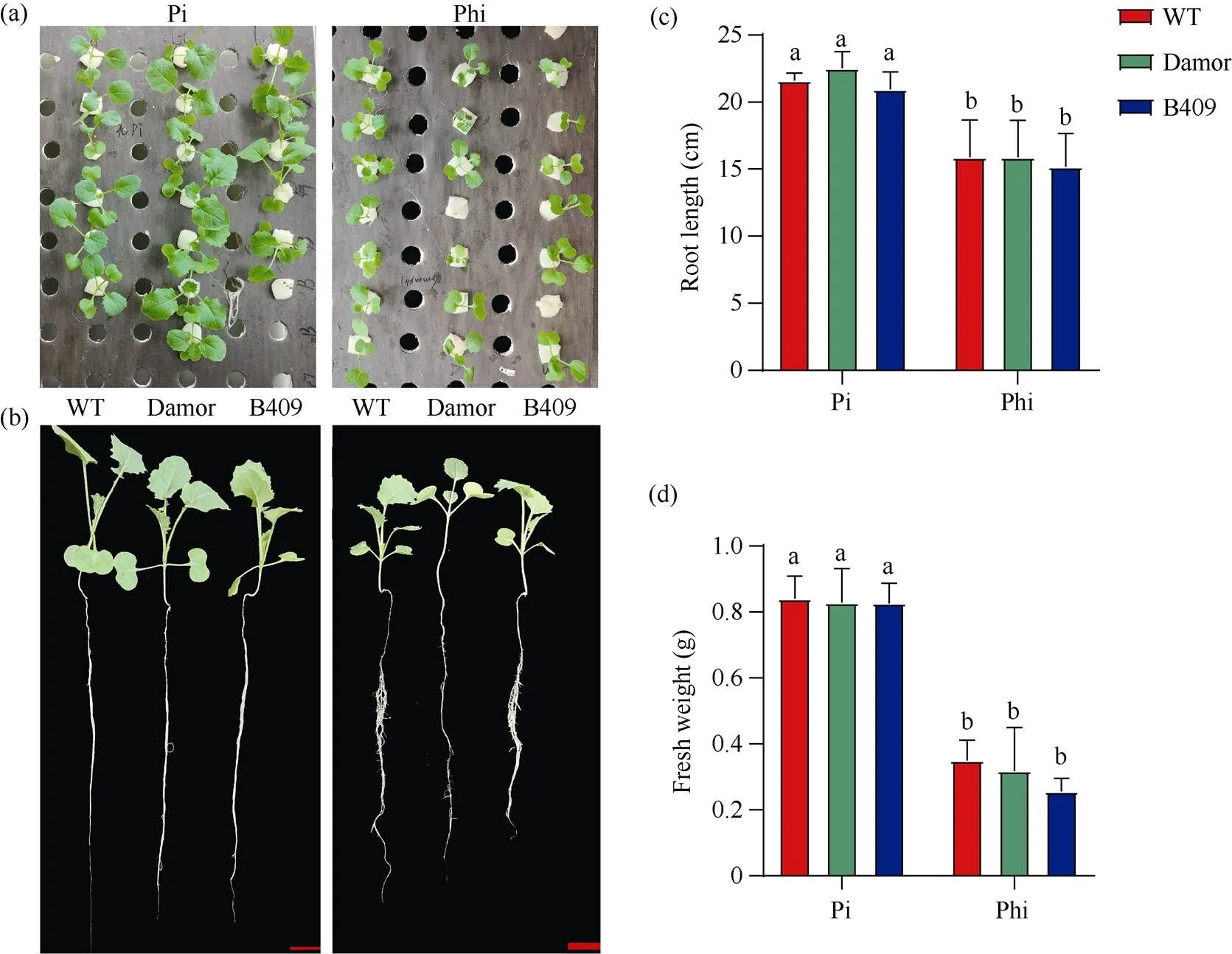
附图1 不同生态型油菜在Pi和Phi下的水培试验
Fig. S1 Hydroponics experiments of different ecotypes ofunder Pi and Phi
(a)和(b) 处理2周后不同油菜的生长状况。Pi浓度为1 mmol L–1, Phi浓度为4 mmol L–1。标尺为2 cm。(c) 处理2周后不同油菜根长的统计。(d) 处理2周后不同油菜鲜重的统计。使用检验进行显著性检验: 当≤ 0.05时, 如果用不同的小写字母标注, 则条形图代表的值存在显著差异。
(a) and (b) growth of differentafter 2 weeks of treatment. The Pi concentration is 1 mmol L–1and the Phi concentration is 4 mmol L–1. Scale bar: 2 cm. (c) statistics of differentroot length after 2 weeks of treatment. (D) statistics of differentfresh weight after 2 weeks of treatment. The significance is analyzed at≤ 0.05 by-test. The values represented by the bars chart are significantly different if marked with different lowercase.

附图2 ptxD蛋白序列分析
Fig. S2 Protein sequence analysis ofptxD
PtxDR4506、PtxDR4506(Y139Q)和PtxDWM88氨基酸序列比对。相同的残基用黑色表示, 相似的残基用灰色表示。
Alignment of PtxDR4506, PtxDR4506(Y139Q), and PtxDWM88amino acid sequence. The identical residues were shaded by black, and the similar residues were shaded by gray.
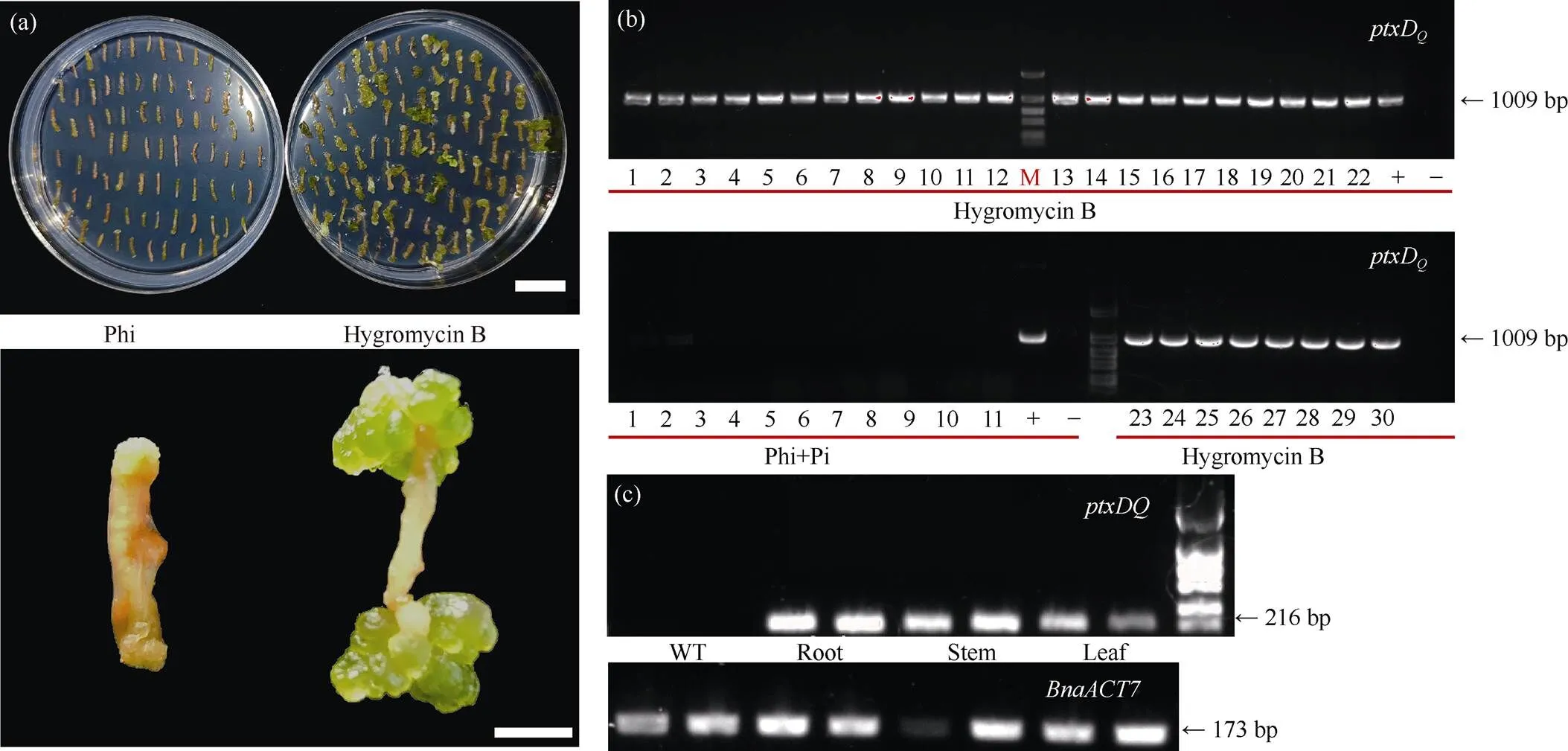
附图3 潮霉素B和Phi对愈伤组织再生的影响
Fig. S3 Callus regeneration with Hygromycin B or Phi selection on shoot initiation media
(a) 以120 µg mL–1Hygromycin B和1 mmol L–1Phi为筛选剂进行转化。标尺为2 cm。(b) 油菜再生苗DNA水平的PCR分析。数字编号为不同的油菜再生苗单株, M为marker。(c) 转基因油菜L10株系的根、茎、叶的RT-PCR分析。为油菜内参基因。
(a) 120 µg mL–1Hygromycin B and 1 mmol L–1Phi were used as screening agents for transformation. Scale bar: 2 cm. (b) PCR identification ofseedlings at DNA level. The numbers are differentregenerated seedling monocots, M is marker. (c) RT- PCR analysis of roots, stems, and leaves of L10 strain of transgenic rapeseed.isinternal gene.
Developing and resistance assessing of phosphite-tolerant herbicide transgenicL.
ZHONG Yuan, ZHU Tian-Yu, DAI Cheng, and MA Chao-Zhi*
National Key Laboratory of Crop Genetic Improvement, Huazhong Agricultural University / National Engineering Research Center of Rapeseed / Hongshan Laboratory, Wuhan 430070, Hubei, China
During the production of, the yield and quality of the crop are seriously affected by a large number of accompanying weeds. Herbicide control options are rapidly diminishing due to the recent increase in the number of herbicide-resistant weeds in fields, which affects the sustainable development of agriculture in the future. Plants can take up phosphite (Phi) via orthophosphate (Pi) transporters, but the Phi cannot be metabolized and used as a phosphorus fertilizer for crops, resulting in plant growth inhibition. Previously, agene isolated fromsp. 4506, and the mutant protein ptxDQat position 139, which had tyrosine mutation to glutamine (Y139Q), significantly improved the conversion activity of Phi to Pi. To evaluate the efficacy ofptxD/Phi-based weed control system in, we generated transgenicplants with a codon-optimized(Y139Q,ptxD) gene. Ectopic expression ofptxDconfered the ability to convert Phi to Pi, resulting in improving plant growth in the presence of Phi. Pi-starvation-induced genes (e.g.and) were suppressed in theptxDtransgenic lines by supplying Phi, indicating thatptxDcan transform Phi into Pi in rapeseed. In addition,ptxDtransgenichad a greater competitive growth advantage over wild-typeand monocotyledonous weeds (). In conclusion, theptxD/Phi system provided an effective alternative for suppressing the weed growth while providing adequate Pi nutrition to the crops, which in turn improved the sustainability of agriculture.
; herbicide; phosphite;
10.3724/SP.J.1006.2024.34110
本研究由国家自然科学基金项目(32072105)资助。
This study was supported by the National Natural Science Foundation of China (32072105).
马朝芝, E-mail: yuanbeauty@mail.hzau.edu.cn
E-mail: zy14745140090623@163.com
2023-07-03;
2023-10-23;
2023-12-13.
URL: https://link.cnki.net/urlid/11.1809.S.20231212.1648.002
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
