miR-135a-5p通过调控CXCL12表达降低吗啡耐受
2024-04-26何华美
何华美,陆 巍
1.贵州医科大学 麻醉学院,贵州 贵阳 550000;2.贵州医科大学附属医院 疼痛科,贵州 贵阳 550000
吗啡是临床上治疗重度癌痛的“金标准”药物[1],然而长期使用会形成吗啡耐受(morphine tolerance,MT),主要表现为随着吗啡的使用出现镇痛效果下降或需要增加剂量才能维持原有的镇痛效能,这会导致患者使用依从性下降,陷入镇痛控制不佳及副作用增加的恶性循环[2]。目前MT的具体机制仍然未知,了解MT的分子机制,寻找新的治疗靶点至关重要。研究显示MT模型中CXC趋化因子配体12(C-X-C motif chemokine ligand 12,CXCL12)水平显著上调[3],中脑导水管周围灰质内注射高剂量CXCL12可降低阿片类药物的镇痛作用[4]。微小RNAs(microRNAs,miRNAs)是一种小的非编码的内源性RNA,可与靶mRNA的3′-非翻译区(3′-UTR)的特定互补序列结合,从而调控细胞转录和蛋白编码翻译。研究表明miRNA在转录后水平介导MT的发展[5],长期使用吗啡会引起某些miRNAs表达变化,这些miRNAs与μ阿片受体(μ opioid receptor,MOR) mRNA的3′-UTR互补结合以阻止MOR的翻译,导致MOR生物合成降低,最终导致吗啡耐受[5]。既往研究表明miR-135a-5p调控CXCL12影响心肌梗死后的炎性反应和细胞凋亡[6],但在MT模型中尚无文献报道。本研究通过建立吗啡耐受小鼠模型,以探讨miR-135a-5p靶向Cxcl12对MT的影响及机制,为预防及治疗MT提供新见解。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级健康雄性6~8周C57BL/6J小鼠64只,体质量18~22 g,尾部完好,小鼠均购自斯贝福(北京)生物技术有限公司,许可证编号:SCXK(京)2019-0010。所有小鼠均饲养于贵州医科大学动物实验中心,饲养条件:12 h循坏灯光,温度20~24 ℃,湿度50%~70%,给予动物标准饲料并自由饮水。本实验所有操作均符合动物伦理要求,并通过贵州医科大学动物实验伦理委员会批准(伦理审查表编号:2201404)。
1.1.2 细胞来源:人胚胎肾母细胞HEK 293T购自长沙市檀溪生物科技有限责任公司。
1.1.3 主要试剂:CXCL12-siRNA、NC-siRNA、miR-agomir、miR-NC、LV-CXCL12、LV-control[慢病毒(lentivirus,LV)上海吉玛制药技术有限公司合成];CXCL12抗体(Abcam公司,ab275879);β-actin抗体(proteintech公司,81115-1-RR);辣根过氧化物酶标记山羊抗兔IgG二抗(Merck Millipore公司);盐酸吗啡注射液(东北制药集团沈阳第一制药有限公司);双荧光素酶检测试剂盒(上海碧云天生物技术有限公司,RG021S);总RNA提取试剂盒(生工生物工程(上海)股份有限公司);实时荧光定量PCR仪(Applied Biosystems公司)。
1.2 方法
1.2.1 动物分组:采用随机数字表法将64只小鼠分为:1)对照(NS)组、2)吗啡耐受(MT)组、3)CXCL12沉默(CXCL12-siRNA)组、4)沉默阴性对照(NC-siRNA)组、5)miR-135a-5p 激动剂(miR-agomir)组、6)激动剂阴性对照(miR-NC)组、7)miR-135a-5p 激动剂+CXCL12过表达(miR-agomir+LV-CXCL12)组、8)miR-135a-5p 激动剂+过表达阴性对照(miR-agomir+LV-control)组。处理:1)组全程每日大腿内侧皮下注射等体积0.9%氯化钠溶液给药,30 min后进行行为学测试。2)组全程每日大腿内侧皮下注射吗啡(0.1 mg/mL)10 mg/kg 1次,注射完毕后30 min进行行为学测试。3)组和4)组第1~3日大腿内侧皮下注射吗啡(0.1 mg/mL)10 mg/kg 1次,行为学测试完成后分别鞘内注射CXCL12-siRNA(5 pmol/μL)5 μL、NC-siRNA(5 pmol/μL)5 μL;5)组和6)组第1~3日大腿内侧皮下注射吗啡(0.1 mg/mL)10 mg/kg 1次,行为学测试完成后分别鞘内注射miR-agomir(20 pmol/μL)5 μL、miR-NC(20 pmol/μL)5 μL;7)组和8)组第1~3日大腿内侧皮下注射吗啡(0.1 mg/mL)10 mg/kg 1次,行为学测试后鞘内注射miR-agomir (20 pmol/μL)5 μL,第4~6日行为学测试后分别鞘内注射LV-CXCL12(1×108TU/L)5 μL、LV-control(1×108TU/L,TU:transducing unit)5 μL。所有分组小鼠均于第7日给药完毕后处死,取L4~L5脊髓组织-80 ℃保存待检。
1.2.2 鞘内注射:小鼠在2%七氟烷麻醉状态下,定位L5~L6棘突间隙作为穿刺点,左手拇指和中指握住小鼠髂嵴以定位L6的棘突,同时向外绷紧皮肤,右手持微量注射器插入L5和L6椎骨的凹槽之间,尾部轻弹表明针头成功进入硬膜下间隙。当尾巴轻弹时,用另一只手缓慢地将agomir或siRNA 5 μL递送到鞘内空间。注射完毕后针头在穿刺点滞留1 min后拔出,用酒精棉球对穿刺点进行消毒。
1.2.3 行为学测试:参照文献[7],每次给药后30 min把小鼠尾部末端1/3放入恒温的热水中(52±0.5)℃,用秒表记录从小鼠尾部入水到开始甩尾的时间(test tail flick latency,TL),连续测定3次,两次间隔5 min。取实验开始前1日的3次潜伏期的平均值作为基础甩尾潜伏期(basal tail flick latency,BL)。如果小鼠在10 s内不甩尾则将尾部拿离热水,将潜伏期定为10 s(cut-off time)。当TL恢复至基础水平可认为已产生耐受。计算最大效应分率%MPE(percent of maximal potential effect)用以表示药物对疼痛反应的影响。%MPE=(TL-BL)/(cut-off time-BL)×100。
1.2.4 RT-qPCR检测脊髓组织中CXCL12、miR-135a-5p mRNA表达水平:TrizolTM试剂提取L4~L5脊髓组织中总RNA,按照反转录试剂盒合成 cDNA,参照RT-qPCR 试剂盒说明书进行 RT-qPCR 反应。根据2-△△Ct法计算各组CXCL12、miR-135a-5p mRNA 相对表达量。引物序列(表1)。

表1 RT-qPCR 引物序列Table 1 Primers of RT-qPCR
1.2.5 Western blot 检测脊髓组织中CXCL12、LC3-Ⅱ、LC3-Ⅰ、p62蛋白表达:脊髓组织中加入裂解液提取各组蛋白,使用BCA试剂盒检测蛋白质总浓度,依次进行电泳、转膜、封闭。加入适宜浓度的CXCL12、LC3、p62一抗于 4 ℃ 冰箱孵育过夜,PBS 清洗后,再加入二抗室温孵育 2 h,PVDF膜用增强型化学发光试剂(enhanced chemiluminescence,ECL)进行化学发光反应,Image J 软件测定各显色条带的灰度。以β-actin为内参,分析目的蛋白质的表达水平,用 LC3-Ⅱ和 LC3-Ⅰ的灰度值比值做为 LC3-Ⅱ/LC3-Ⅰ的比值结果。
1.2.6 生物信息学预测及双荧光素酶报告基因实验验证 miR-135a-5p与CXCL12关系:利用生物信息学预测工具 TargetScan (http://www.targetscan.org/vert _71/)预测 miR-135a-5p和CXCL12的结合位点。设计合成含有 CXCL12 3′-UTR 野生型 (CXCL12-Wt) 或突变型 (CXCL12-Mut) 片段的psicheck2-CXCL12 3′-UTR 重组报告质粒。将质粒与miR-135a-5p mimic或NC mimic共转染至 HEK-293T 细胞中,设置分组为 miR-135a-5p mimics+CXCL12 Wt组、 mimics-NC+CXCL12 Wt组、 miR-135a-5p mimics+CXCL12 Mut组和 mimics-NC+CXCL12 Mut组,48 h后采用双荧光素酶报告基因检测系统检测荧光素酶活性。
1.3 统计学分析

2 结果
2.1 吗啡耐受模型的建立
皮下注射吗啡后MT组的%MPE显著高于同时间点的NS组(P<0.05)(图1A),随着吗啡给药时间的延长,MT组的%MPE逐渐降低,直至第7天恢复至基线值(图1A)。与对照组相比,模型组小鼠L4~L5脊髓CXC12的mRNA、蛋白表达较对照组均升高(P<0.05)(图1B~D),而miR-135a-5p表达下显著降(P<0.05)(图1E)。
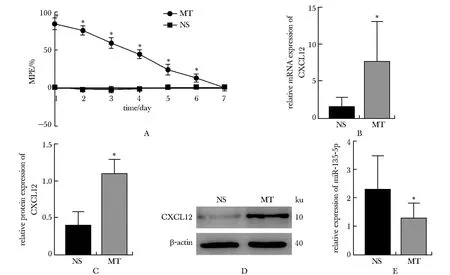
A.the percent of maximal potential effect (MPE) in the two groups; B.relative expression of CXCL12 mRNA in the two groups; C,D.Western blot assay of CXCL12 in the two groups;E.relative expression of miR-135a-5p in the two groups;NS: normal saline group;MT: morphine tolerance group;*P<0.05 compared with NS.
2.2 下调CXCL12表达可缓解吗啡耐受小鼠的热痛刺激
相比于NC-siRNA组,CXCL12 siRNA组CXCL12 mRNA及蛋白水平均下降(P<0.05)(图2A~C)。温水甩尾法测试结果显示,连续皮下注射吗啡后,NC-siRNA组%MPE逐渐减低,第7天恢复至基线值。然而,CXCL12-siRNA 组%MPE从第3天开始高于同时点的NC-siRNA组(P<0.05)(图2D)。

A.relative expression of CXCL12 mRNA in the two groups; B,C.Western blot assay of CXCL12 in the two groups;D.the percent of maximal potential effect (MPE) in the two groups;CXCL12-siRNA:silence CXCL12 group;NC-siRNA: negative control group of CXCL12-siRNA;*P<0.05 compared with NC-siRNA.
2.3 上调miR-135a-5p可缓解吗啡耐受小鼠的热痛刺激
与miR-NC组相比,miR-agomir组miR-135a-5p 表达明显升高(P<0.05)(图3A)。连续皮下注射吗啡后,miR-NC组%MPE升高,但在第7天降至基线值。与miR-NC组相比, miR-agomir组%MPE从第2天开始升高(P<0.05)(图3B),持续至第7天。与miR-NC组相比,miR-agomir组CXCL12 mRNA、蛋白表达下降(P<0.05)(图3C~E)。

A.relative expression of miR-135a-5p in the two groups; B.the percent of maximal potential effect (MPE) in the two groups; C.relative expression of CXCL12 mRNA in the two groups;D,E.Western blot assay of CXCL12 in the two groups; miR-agomir: overexpression miR-135a-5p group;miR-NC.negative control group of miR-agomir;*P<0.05 compared with miR-NC.
2.4 Cxcl12与miR-135a-5p的靶向关系
生物信息学预测到 miR-135a-5p和Cxcl123′-UTR存在结合位点(图4A)。miR-135a-5p过表达显著降低了含有预测的野生型Cxcl123′-UTR质粒相对荧光素酶活性(P<0.05)(图4B),而在Cxcl123′-UTR翻译区含有突变结合位点的质粒未观察到该效应。

A.prediction of the targeting relationship between miR-135a-5p and Cxcl12 3′-UTR; B.dual-luciferase reporter gene assay to detect the targeting relationship between miR-135a-5p and Cxcl12; miR-135a-5p mimic: over-expression miR-135a-5p group;mimic NC.negative control group of miR-135a-5p mimic;Wt.wide type;Mut.mutant; *P<0.05 compared with mimic NC.
2.5 miR-135a-5p通过CXCL12缓解小鼠热痛刺激
与agomir+LV-control组相比,agomir+LV-CXCL12组的CXCL12 mRNA与蛋白表达均显著上升(P<0.05)(图5A~C)。温水甩尾法测试结果显示,与agomir+LV-control组相比,agomir+LV-CXCL12组 %MPE从第4天开始下降(P<0.05)(图5D)。

A.relative expression of CXCL12 mRNA in the two groups; B,C.Western blot assay of CXCL12 in the two groups;D.the percent of maximal potential effect (MPE) in the two groups; miR-agomir: overexpression miR-135a-5p;LV-CXCL12: overexpression CXCL12;LV-control: negative control of LV-CXCL12; *P<0.05 compared with miR-agomir+LV-control.
3 讨论
在中重度癌痛患者中吗啡使用率占89.7%,1周内出现吗啡増量的占35.1%,2个月内出现吗啡增量的达 71.4%[8]。随着吗啡耐受的发生发展,为达到满意的镇痛效果,患者需不断增加吗啡剂量,然而剂量的增加不仅会加速耐受的形成,还会提升不良反应的发生,造成恶性循环[9]。故除了疾病本身进展导致疼痛以外,阿片药物耐受也是目前最亟待解决的难点,寻求预防及治疗吗啡耐受的方法,对提高癌痛吗啡耐受患者的生活质量有重要意义。既往研究认为MT与MOR的内吞、脱敏、下调;阿片受体亚型的异聚化;细胞内信号分子及信号通路的改变和神经炎性反应等机制相关[10-11],但目前仍无统一定论。
吗啡耐受通常与痛觉过敏同时出现,并且两者的发生机制十分相似,故可通过使用无痛生理状态下动物建立疼痛模型,测试其痛阈的变化,根据疼痛阈值下降这一特征性表现来表征吗啡耐受[12-13]。CXCL12是CXC趋化因子受体4(CXC chemokine receptor 4,CXCR4)唯一的配体,研究表明CXCR4与MOR在疼痛传递的神经解剖结构中共定位,包括背根神经节、脊髓背角和中脑导水管周围灰质,用CXCR4拮抗剂预处理能显著增强吗啡镇痛[14]。本研究建立吗啡耐受小鼠模型,检测了吗啡耐受小鼠脊髓组织中CXCL12的表达,结果发现CXCL12表达升高,敲低Cxcl12表达可缓解吗啡耐受小鼠的热痛觉刺激,这与先前的研究一致。
为明确CXCL12的调控机制,本研究基于microRNA作用机理进行了进一步的预测和研究,利用生物信息学网站预测发现Cxcl12的3′-UTR与miR-135a-5p存在结合位点,最终选择miR-135a-5p作为Cxcl12的上游研究对象。既往文献报道miR-135a-5p在骨癌痛小鼠疼痛中起到重要作用[15],故有理由推测miR-135a-5p参与吗啡耐受的发生,本研究检测发现吗啡耐受小鼠脊髓中miR-135a-5p表达水平下降,增加miR-135a-5p表达可缓解MT小鼠的热痛刺激,从而减缓耐受形成。为验证CXCL12与miR-135a-5p的靶向关系,本研究检测了过表达miR-135a-5p的模型组织中CXCL12的表达,发现过表达miR-135a-5p可导致CXCL12表达下降,说明它们存在负向调控关系。此外,进行了双荧光素酶基因实验,结果证实了Cxcl12是miR-135a-5p的下游靶基因。为验证CXCL12对吗啡耐受的影响是受miR-135a-5p的调控的,进行了回复验证实验,结果显示,miR-135a-5p对吗啡耐受小鼠的热痛保护作用可以被CXCL12的过表达所消除。
综上所述,本实验初步明确了miR-135a-5p能靶向调控CXCL12的表达从而减缓吗啡耐受的形成,为寻求吗啡耐受潜在的机制提供新的见解,并为吗啡耐受的临床治疗提供潜在的靶点。
