胶质瘤条件培养基促进巨噬细胞糖酵解及表型转化
2024-04-26张迪雅李云帆郭泓江仇佳星王钰铖
张迪雅,李云帆,郭泓江,仇佳星,王钰铖,鞠 瑞,郭 磊
中国医学科学院基础医学研究所 北京协和医学院基础学院 药理系,北京 100005
胶质母细胞瘤(glioblastoma, GBM)是成人中最常见的恶性胶质瘤(glioma)形式,其肿瘤微环境(tumor microenvironment, TME)具有高度异质性并且处于一种免疫抑制的状态,导致目前免疫治疗的效果不佳[1-2]。值得注意的是,在胶质瘤TME中,单核细胞来源的胶质瘤相关巨噬细胞(glioma associated macrophages, GAMs)占肿瘤质量的三分之一以上,其浸润比例与胶质瘤的恶性进展呈正相关[3-4]。
巨噬细胞的可塑性使其能在不同的刺激下极化成不同的表型,通常被简化为促炎的M1表型与抗炎的M2表型。然而越来越多的证据表明,在TME中并不存在M1/M2巨噬细胞表型的明显划分,GAMs能够同时表达M1与M2相关促癌介质如IL-1β、IL-6、诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)、精氨酸酶(arginase 1, ARG1),塑造了免疫抑制的微环境[5-8]。有研究发现,巨噬细胞在TME刺激下,葡萄糖摄取与糖酵解代谢速率增加,但是糖酵解是否以及如何影响GAMs进而调控肿瘤免疫抑制微环境尚不清楚[9-10]。因此,本研究旨在探索胶质瘤条件培养基对巨噬细胞表型与糖酵解代谢的影响,并利用乳酸脱氢酶抑制剂stiripentol(STP)初步验证糖酵解对GAMs促癌表型的支持作用。
1 材料与方法
1.1 材料
1.1.1 细胞:小鼠结缔组织细胞系L929(中国医学科学院基础医学研究所细胞资源中心);小鼠胶质瘤细胞系GL261(上海赛百慷生物技术股份有限公司)。
1.1.2 动物:C57BL/6J小鼠[6周龄,SPF级,雄性,体质量(18±20)g,中国医学科学院基础医学研究所动物中心]。
1.1.3 试剂:Stiripentol(STP)(上海皓元生物医药科技有限公司);二甲基亚砜(dimethyl sulfoxide, DMSO)(Sigma-Aldrich公司);红细胞裂解液、RIPA裂解液、PMSF(北京索莱宝生物科技有限公司);引物(北京擎科生物科技股份有限公司);SYBR Green Pro Taq HS 预混型 qPCR 试剂盒、AG RNAex Pro RNA 提取试剂、Evo M-MLV 反转录试剂预混液(湖南艾科瑞生物工程有限公司);Seahorse XF 糖酵解压力测试试剂盒(Agilent公司);STAT3抗体、羊抗兔IgG二抗、羊抗鼠IgG二抗(Proteintech公司);β-actin抗体、p-STAT3抗体、STAT6抗体、p-STAT6抗体(Cell Signaling Technology公司)。
1.2 方法
1.2.1 细胞培养与处理:L929细胞与GL261细胞使用含10%胎牛血清、1%青霉素-链霉素和1% L-谷氨酰胺的DMEM高糖完全培养基,在37 ℃、含5% CO2的常氧培养箱中培养。GL261细胞条件培养基(GL261 cell conditioned medium, GCM)上清收集:将2×106个GL261细胞接种于10 cm大皿,在常氧培养箱中培养48 h后,更换含3% 胎牛血清的DMEM高糖完全培养基,在低氧(5% O2)培养箱继续培养24 h,收集细胞培养基上清。小鼠骨髓来源巨噬细胞(bone marrow derived macrophage, BMDM)分离与诱导:小鼠脱颈处死后,分离胫骨与股骨,收集骨髓内BMDM细胞,使用含10% L929细胞培养上清的条件培养基诱导分化BMDM细胞6 d(培养3 d后换液1次)为成熟巨噬细胞。将成熟的BMDM细胞分为对照(BMDM)组(No GCM)、肿瘤诱导(GCM-BMDM)组(GCM)与500 μmol/L STP诱导给药组(GCM STP)。No GCM组更换为含5%胎牛血清的DMEM高糖完全培养基,GCM组与GCM STP组更换为含50% GL261上清的肿瘤条件培养基,在常氧培养箱中培养24 h后更换为含药或溶剂对照(DMSO)的条件培养基,在低氧(5% O2)培养箱中继续培养24 h。
1.2.2 实时荧光定量PCR检测促癌介质与糖酵解代谢相关基因的mRNA表达水平:收集低氧与药物处理后的细胞,按照AG RNAex Pro RNA 提取试剂说明书提取细胞RNA,NanoDrop One超微量紫外分光光度计测定浓度和纯度,按照Evo M-MLV 反转录试剂盒说明书进行反转录反应合成cDNA,按照SYBR Green Pro Taq HS 预混型 qPCR 试剂盒说明书配置反应液进行qPCR检测。以β-actin为内参基因计算目的基因mRNA的相对表达量。引物序列见表1。

表1 引物序列Table 1 Sequence of primers
1.2.3 Seahorse细胞能量实验检测细胞外酸化率(extracellular acidification rate,ECAR):取诱导分化后的BMDM细胞,No GCM组按2.5×105个/孔,GCM与GCM STP组按1.5×105个/孔接种于24孔板,过夜贴壁后,更换为肿瘤条件培养基,在常氧培养箱培养24 h后更换含药肿瘤条件培养基,在低氧(5% O2)培养箱继续培养24 h,按照Seahorse XF 糖酵解压力测试试剂盒说明书进行操作,使用Seahorse XF分析仪检测。
1.2.4 Western blot检测STAT3、p-STAT3、STAT6、p-STAT6蛋白表达水平:收集低氧与药物处理后的细胞,冰上裂解,离心,取蛋白质上清,进行BCA蛋白质浓度测定,按比例加入5×蛋白质上样缓冲液,98℃煮样10 min使蛋白质变性,-80 ℃保存。计算每组30 μg蛋白质所需上样体积,进行SDS-PAGE,冰上转膜2 h,PVDF膜经5%脱脂奶粉-TBST溶液封闭2~3 h,一抗4 ℃孵育过夜,二抗孵育1~2 h,显影。
1.3 统计学分析

2 结果
2.1 GCM刺激BMDM Hif-1α与多种促癌介质mRNA表达
与对照组相比,BMDM细胞经过GCM诱导后Hif-1α,M1介质Il-1β、Il-6、iNOS,M2介质Ido、Il-10、Arg1、Cd163、Cd274mRNA表达均升高(P<0.01,P<0.001)(图1)。

*P<0.01, **P<0.001 compared with No GCM group.
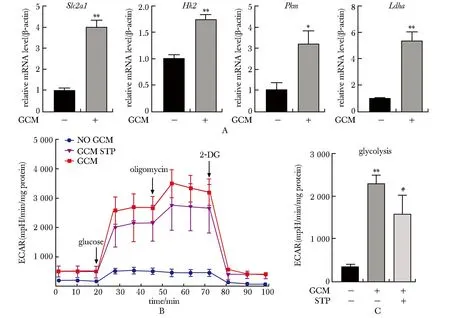
A.Bar chart of mRNA level of glycolysis associated genes; B.Seahorse glycolysis stress test with sequential addition of glucose, oligomycin, and 2-DG in BMDM; C.quantification of ECAR in various groups after the addition of glucose; 2-DG.2-deoxy-D-glucose;*P<0.01, **P<0.001 compared with No GCM group; #P<0.05 compared with GCM group.
2.2 GCM上调BMDM糖酵解水平
与对照组相比,GCM组BMDM细胞葡萄糖摄取基因Slc2a1与糖酵解代谢关键酶基因Hk2、Pkm与LdhamRNA表达升高。在Seahorse糖酵解压力测试实验中,与对照组相比,GCM组ECAR水平升高,GCM STP组BMDM细胞经GCM与STP处理后, ECAR水平降低(P<0.05,P<0.01,P<0.001)(图2)。
2.3 STP下调GCM-BMDM促癌介质mRNA表达
与GCM组相比,GCM STP组Hif-1α与促癌介质Il-1β、Il-6、Ido、Cd163mRNA水平均降低(P<0.01,P<0.001)(图3)。

*P<0.01, **P<0.001 compared with No GCM group; #P<0.01, ##P<0.001 compared with GCM group.
2.4 STP抑制GCM-BMDM炎性转录因子活化
与对照组相比,GCM组炎性转录因子STAT3与STAT6磷酸化水平增加,p-STAT3/STAT3与p-STAT6/STAT6的比值升高。加入STP处理后,GCM-BMDM中p-STAT3/STAT3与p-STAT6/STAT6的比值降低(P<0.05,P<0.001)(图4)。

*P<0.05, **P<0.001 compared with No GCM group; #P<0.05 compared with GCM group.
3 讨论
长期以来,肿瘤细胞一直被认为是TME中葡萄糖的主要消耗者,通过有氧糖酵解为自身增殖和转移提供能量[11]。然而最近的研究发现,骨髓来源的肿瘤相关巨噬细胞是TME中葡萄糖摄取最多的免疫细胞亚群,糖代谢需求的增加可能与其免疫抑制的促癌表型相关[12]。单核来源的巨噬细胞被招募到肿瘤组织后,在TME的刺激下发生特定代谢与功能的改变。例如,组织内缺氧与肿瘤细胞产生的乳酸蓄积都将稳定缺氧诱导因子HIF-1α的表达,而HIF-1α作为一种重要的转录因子,能调控多种糖酵解途径关键酶与若干促癌介质的表达[13-15]。此外,JAK/STAT通路是调控巨噬细胞M2表型的重要调控通路。IL-4与IL-13通过受体IL-4Rα激活STAT6,IL-10通过其受体IL-10R激活STAT3,诱导M2表型的经典活化[16]。有研究报道IL-4还通过不同的表观遗传修饰诱导出具有促炎特性的M2巨噬细胞(M2IFN),糖酵解与HIF-1α是这种非经典M2巨噬细胞活化的决定因素[14]。基于以上背景,本研究推测在低氧TME中,GAMs可能更依赖糖酵解,这一代谢偏好可能与其促癌介质表达相关。
在本研究中,经过缺氧与GL261肿瘤上清诱导后,GCM-BMDM中M1与M2促癌介质在转录水平表达上调,M2活化转录因子p-STAT3与p-STAT6表达增加。同时,GCM-BMDMHif-1α与其下游葡萄糖转运体基因Slc2a1,糖酵解关键酶基因Hk2、Pkm、Ldha表达增加,糖酵解水平升高。
STP是一种FDA批准用于治疗Dravet综合征的抗癫痫药物, 能有效抑制乳酸脱氢酶(lactate dehydrogenase, LDH)的活性,生物安全性高且能透过血脑屏障。最近有研究表明STP能够抑制GBM细胞增殖与侵袭,提高荷瘤小鼠的生存率,是治疗GBM的潜在药物[17]。本研究初步检测了STP调控GAMs的作用,GCM-BMDM经STP处理后,Hif-1α表达下降,糖酵解水平降低,STAT3与STAT6的活化受到抑制,最终导致了促癌介质Il-1β、Il-6、Ido、Cd163表达下调。但是糖酵解抑制未能干预iNOS、Il-10、Arg1、Cd274的表达(数据未显示),表明其他代谢通路或转录机制更多地参与了这些促癌介质的调控,对这一部分将继续深入探索。
综上所述,本研究在体外模型中证实了GAMs在转录水平多种促癌介质表达升高并偏向糖酵解代谢,乳酸脱氢酶抑制剂能有效降低糖酵解水平与促癌介质相关基因Il-1β、Il-6、Ido、Cd163的表达,糖酵解对促癌表型的支持作用可能是由转录因子HIF-1α、STAT3与STAT6介导的。
