苍术素调节腺苷酸活化蛋白激酶/沉默信息调节因子1信号通路对白细胞介素-1β诱导软骨细胞自噬和凋亡的影响
2024-04-24沈晓娟程磊刘琳
沈晓娟,程磊,刘琳
作者单位:上海中医药大学附属龙华医院药学部,上海200032
骨关节炎(osteoarthritis,OA)是一种慢性退行性疾病,主要病理改变表现为软骨退化、骨赘形成、滑膜炎症,随着年龄的增长,患病率呈升高趋势,严重影响病人身心健康,OA 的发病机制尚不完全清楚,软骨细胞凋亡在OA 的发展中发挥重要作用,抑制细胞凋亡是治疗OA 的一个方向[1-2]。自噬又称Ⅱ型程序性细胞死亡,研究显示,自噬参与OA 的进展,增强自噬可以抑制软骨细胞凋亡,延缓骨关节炎的进展[3]。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是一种能量传感器,可激活Unc-51 样自噬激活蛋白酶(Unc-51 like autophagy activating kinase 1,ULK1)正调控自噬,激活AMPK 增强自噬,抑制OA 软骨细胞凋亡[4]。沉默信息调节因子1(silent message modulator 1,SIRT1)是一种烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)依赖的去乙酰化酶,磷酸化的AMPK 可提高细胞内NAD+浓度,激活SIRT1 的表达,激活AMPK/SIRT1 信号通路,可抑制炎症反应,改善OA 症状[5]。苍术素(atractylodin,ATR)是从苍术中提取有效物质,具有降糖、抗炎、抗氧化及抗肿瘤的作用[6]。研究显示,苍术素可抑制白细胞介素1β(interleukin 1β,IL-1β)诱导的软骨细胞炎症反应[7],但其具体作用机制尚不清楚,本研究2022 年1—8 月通过观察苍术素对IL-1β 诱导的软骨细胞自噬及对AMPK/SIRT1信号通路的影响,探索苍术素对IL-1β 诱导的软骨细胞凋亡与自噬可能的作用机制。
1 材料与方法
1.1 细胞与试剂1 周龄SD 雄性乳鼠购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2021-0011。苍术素(HPLC≥98%)购自四川成都/思克生物;重组大鼠IL-1β(GS4468)购自北京百奥莱博科技有限公司;AMPK 抑制剂compound C(纯度99.91%)购自美国MCE 公司;Annexin VFITC/PI 凋亡试剂盒(CA1020)、噻唑蓝(methyl thiazolyl tetrazolium,MTT)试剂盒(M1020)、单丹磺酰尸胺(montane sulfonyl cadaverine,MDC)试剂盒(G0170)、TUNEL 凋亡检测试剂盒(绿色荧光)(T2130)购自北京索莱宝生物科技有限公司;LC3(AL221)、Beclin-1(AF5123)、Atg5(AF2269)、AMPK(AF1627)、p-AMPK(AF2677)、SIRT1(AF5300)抗体购自碧云天生物科技有限公司,ULK1(ab167139)、p-ULK1(ab203207)抗体购自美国Abcam公司。
1.2 方法
1.2.1软骨细胞的分离与鉴定 1 周龄SD 乳鼠麻醉后处死,根据参考文献[8],无菌条件下取软骨组织,采用胰蛋白酶和Ⅱ型胶原酶两步酶消化法提取软骨细胞,原代细胞培养3 d 后,显微镜观察细胞生长情况,采用甲苯胺蓝染色与Ⅱ型胶原蛋白(collagen Ⅱ)免疫荧光染色进行鉴定,鉴定过的细胞传代培养,选取第3代细胞进行后续实验。
1.2.2苍术素浓度的筛选 第3代软骨细胞融合至80%左右时,按照4×104个接种于96 孔板中,使用不同浓度的苍术素(0、5.0、10.0、20.0、40.0、80.0 μmol/L)处理软骨细胞,同时加入10 μg/L 的IL-1β 共同处理24 h 后,另设正常培养的细胞为对照组,加入20 μL 的MTT 溶液,孵育4 h 后,加入DMSO 终止反应,检测490 nm处的光密度值(OD值)。
1.2.3细胞培养及分组 将软骨细胞随机分成4组,分别为对照组、IL-1β 组、苍术素组(苍术素组)、苍术素+AMPK 抑制剂组(苍术素+compound C 组),其中IL-1β 组使用10 μg/L 的IL-1β[8]诱导24 h,建立细胞模型;苍术素组使用20 μmol/L 的苍术素与10 μg/L 的IL-1β 共同处理细胞24 h,苍术素+compound C 组在建立细胞模型前,使用50 μmol/L 的compound C[9]预处理2h,再使用20 μmol/L 的苍术素与10 μg/L 的IL-1β 共同处理细胞24 h,对照组用等量的PBS处理细胞。
1.2.4细胞凋亡检测 将各组处理的软骨细胞按照4×104个接种于96 孔板中,培养24 h 后,使用Annexin V-FITC/PI试剂盒检测细胞凋亡。
另取各组处理的软骨细胞按照1×104个细胞接种于无菌盖玻片上,培养24 h 后,使用预冷的甲醇固定10 min,加入TUNEL 反应液,37 ℃,染色1 h,光显微镜下观察并拍照。
1.2.5MDC 染色观察自噬小体 收集各组处理的软骨细胞800 ×g离心5 min,使用Wash buffer 将细胞制成109个/升的细胞悬液,取90 μL细胞悬液加入10 μL的MDC 染色液,避光染色30 min,荧光显微镜下观察并拍照。
1.2.6蛋白质印迹法检测细胞中自噬及AMPK/SIRT1 通路相关蛋白表达 使用RIPA 裂解液从各组处理的细胞中提取总蛋白,取30 μg 蛋白SDSPAGE电泳、转膜后封闭,LC3(1∶1 000)、Beclin-1(1∶1 000)、Atg5(1∶1 500)、p-AMPK(1∶1 000)、AMPK(1∶1 500)、SIRT1(1∶1 000)、ULK1(1∶1 500)、p-ULK1(1∶1 500)抗体,4 ℃孵育过夜,再加入酶标二抗(1∶1 000)室温孵育2 h,ECL 试剂显色,以β-actin为内参,利用Image J软件分析蛋白相对表达。
1.3 统计学方法采用SPSS 25.0 软件进行统计分析,计量资料符以±s表示,数据分布的正态性和方差齐性分别通过Kolmogorov-Smirnov 检验和Levene 检验进行分析(P>0.05);方差齐(P>0.05)时,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验;方差不齐时,组间两两比较采用Games-Howell检验。P<0.05为差异有统计学意义。
2 结果
2.1 软骨细胞的分离与鉴定显微镜下观察显示,分离的原代大鼠软骨细胞培养3 d 后,细胞呈椭圆形或梭形,细胞贴壁生长(图1A),甲苯胺蓝染色显示,细胞核被染成深蓝色,核仁呈蓝紫色,细胞质褐红色(图1B),collagen Ⅱ免疫荧光染色显示,细胞呈绿色(图1C),经DAPI染色细胞核呈蓝色,证明分离的细胞为软骨细胞。
2.2 苍术素对IL-1β诱导的软骨细胞增殖活性的影响与对照组(1.22±0.11)比较,IL-1β 组软骨细胞增殖活性(0.60±0.07)显著降低(F=45.91,P<0.001);使用不同浓度苍术素(5.0、10.0、20.0、40.0、80.0 μmol/L)预处理软骨细胞后,细胞增殖活性增加(0.63±0.07、0.65±0.08、0.78±0.08、0.95±0.09、1.06±0.10),且苍术素浓度在20 μmol/L 以上,可显著促进细胞增殖,因此选择苍术素浓度20 μmol/L进行后续实验。
2.3 苍术素对IL-1β诱导的软骨细胞凋亡的影响与对照组(2.54±0.82)%比较,IL-1β 组软骨细胞凋亡率(28.46±3.55)%显著升高(P<0.05);与IL-1β 组比较,苍术素组软骨细胞凋亡率(14.26±2.45)%显著降低(P<0.05);与苍术素组比较,苍术素+compound C组软骨细胞凋亡率(22.36±2.71)%显著升高(P<0.05)。
TUNEL 染色结果显示,凋亡细胞为绿色,细胞核为蓝色,与对照组比较,IL-1β 组细胞绿色荧光增多,与IL-1β 组比较,苍术素组绿色荧光减少;与苍术素组比较,苍术素+compound C 组绿色荧光增多,见图2。

图2 TUNEL染色观察苍术素对IL-1β诱导的乳鼠软骨细胞凋亡的影响(×1 000)
2.4 苍术素对IL-1β诱导的软骨细胞自噬的影响荧光显微镜下观察显示,MDC 染色自噬小体呈绿色,与对照组相比,IL-1β 组软骨细胞绿色荧光强度减弱;与IL-1β 组相比,苍术素组细胞绿色荧光强度显著增强;与苍术素组比较,苍术素+compound C 组细胞绿色荧光强度减弱,见图3。
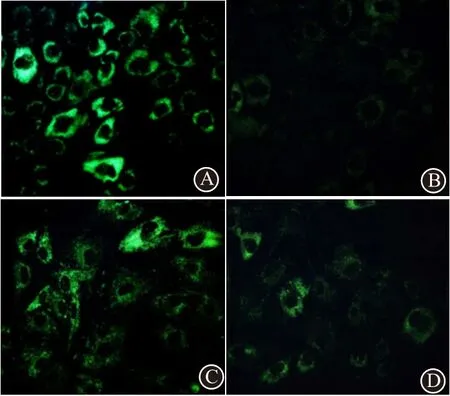
图3 乳鼠软骨细胞自噬小体(MDC染色×400):A为对照组;B为I L-1 β组;C为苍术素组;D为苍术素+C o m p o u n d 组
2.5 苍术素对IL-1β诱导的软骨细胞自噬相关蛋白的影响与对照组比较,IL-1β 组软骨细胞LC3Ⅱ/LC3Ⅰ、Beclin-1、Atg5 蛋白表达水平显著降低(P<0.05);与IL-1β 组相比,苍术素组软骨细胞LC3Ⅱ/LC3Ⅰ、Beclin-1、Atg5 蛋白表达水平显著升高(P<0.05);与IL-1β+苍术素组比较,苍术素+compound C组软骨细胞LC3Ⅱ/LC3Ⅰ、Beclin-1、Atg5 蛋白表达水平显著降低(P<0.05)。见图4;表1。
表1 苍术素对IL-1β诱导的软骨细胞LC3、Beclin-1、Atg5表达的影响/± s

表1 苍术素对IL-1β诱导的软骨细胞LC3、Beclin-1、Atg5表达的影响/± s
注:LC3为微管相关蛋白轻链3,Atg5为自噬相关基因-5。①与对照组比较,P<0.05。②与IL-1β 组比较,P<0.05。③与苍术素组比较,P<0.05。
?

图4 各组软骨细胞LC3、Atg5、Beclin-1蛋白表达情况
2.6 苍术素对IL-1β诱导的软骨细胞AMPK/SIRT1通路相关蛋白的影响与对照组相比,IL-1β组软骨细胞中p-AMPK、SIRT1、p-ULK1 蛋白表达水平显著降低(P<0.05);与IL-1β 组相比,苍术素组软骨细胞中p-AMPK、SIRT1、p-ULK1 蛋白表达水平显著升高(P<0.05);与苍术素组比较,苍术素+compound C 组细胞p-AMPK、SIRT1、p-ULK1 蛋白表达水平显著降低(P<0.05),各组之间AMPK、ULK1表达水平比较差异无统计学意义(P>0.05)。见图5和表2。
表2 各组软骨细胞SIRT1、p-ULK1/ULK1、p-AMPK/AMPK蛋白表达/± s
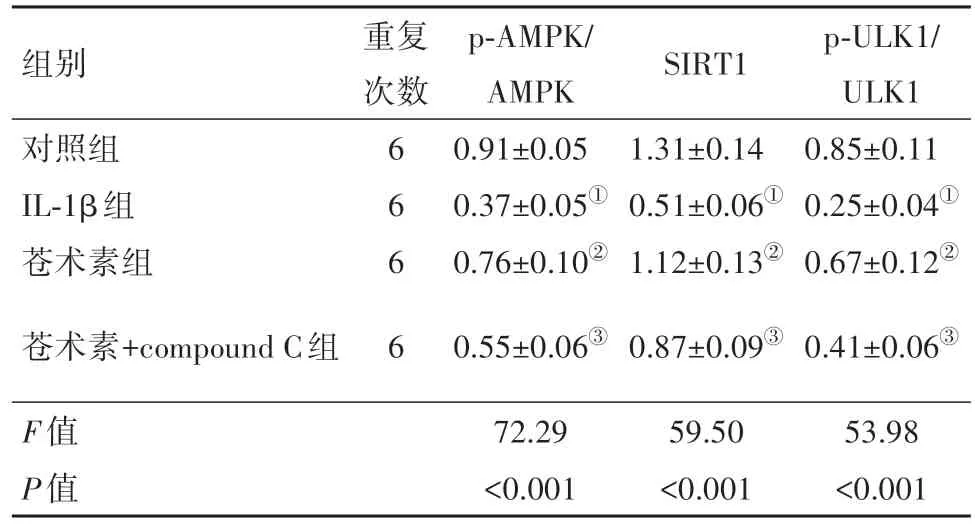
表2 各组软骨细胞SIRT1、p-ULK1/ULK1、p-AMPK/AMPK蛋白表达/± s
注:AMPK 为腺苷酸活化蛋白激酶,SIRT1 为沉默信息调节因子1,ULK1为Unc-51样自噬激活蛋白酶。①与对照组比较,P<0.05。②与IL-1β 组比较,P<0.05。③与苍术素组比较,P<0.05。
?

图5 各组软骨细胞SIRT1、ULK1、p-ULK1、AMPK、p-AMPK蛋白表达情况
3 讨论
IL-1β 是一种促炎细胞因子,可通过调节基质金属蛋白酶与炎症因子表达,诱导软骨细胞凋亡,参与OA 进展,常作为诱导OA 细胞模型的因子[10]。本研究从乳鼠软骨组织分离软骨细胞,经甲苯胺蓝染色和collagen Ⅱ免疫荧光染色证明成功分离软骨细胞。使用IL-1β 处理软骨细胞后,细胞增殖活性降低,凋亡率升高,表明OA 细胞模型建模成功。苍术素为苍术提取物,可以调控炎症反应、氧化应激、肿瘤细胞增殖与迁移等,具有多种药理学作用[11]。研究显示,苍术素抑制核苷酸结合结构域-(nucleotide binding domain,NOD-)样受体蛋白3(like receptor protein 3,NLRP3)炎性体和toll 样受体4(toll-like receptor 4,TLR4)激活,抑制炎症反应,减轻脂多糖(lipopolysaccharide,LPS)诱导的急性肺损伤[12]。蒲博强等[13]发现,苍术提取物可通过下调miR-378c 表达,抑制IL-1β 诱导的软骨细胞凋亡,促进细胞增殖。本研究使用不同浓度苍术素预处理细胞24h,再使用IL-1β 处理细胞,结果显示细胞增殖活性增加,且在20 μmol/L以上时,细胞增殖活性显著增加,选择20 μmol/L 的苍术素进行后续实验,发现20 μmol/L 的苍术素可显著抑制IL-1β 诱导的软骨细胞凋亡。这与既往的研究结果[13]一致,再次证实苍术素是OA的潜在治疗药物。
自噬是依赖溶酶体途径对细胞器及大分子物质进行降解的过程,具有维持细胞内稳态的作用,参与细胞凋亡过程[14]。研究显示,自噬参与维持软骨内平衡,参与OA 进展,激活自噬可减轻OA 严重程度[15]。LC3、Beclin-1、Atg5 是自噬通路相关的调控因子,LC3 有LC3-Ⅰ和LC3-Ⅱ两种形式,发生自噬时,LC3-I 转化为LC3-Ⅱ,Beclin-1 可调控自噬前体的形成,Atg5 是自噬活性标志物,与Beclin-1 共同参与正向调控自噬[16]。苍术素参与自噬调节,如在胆管癌细胞中,苍术素可通过诱导自噬,抑制细胞增殖与迁移[17]。本研究结果显示,在10 μg/L IL-1β刺激24 h 后,软骨细胞中自噬小体水平和LC3Ⅱ/LC3Ⅰ、Beclin-1、Atg5 蛋白表达水平显著降低,表明IL-1β 诱导的软骨细胞中自噬被抑制;使用20 μmol/L 的苍术素处理细胞后,IL-1β 诱导的软骨细胞自噬小体水平及LC3Ⅱ/LC3Ⅰ、Beclin-1、Atg5 蛋白表达水平显著升高,提示苍术素可促进IL-1β 诱导的软骨细胞自噬,降低IL-1β诱导的软骨细胞凋亡。
AMPK 是细胞ATP 水平的代谢传感器,参与调节细胞能量代谢,AMPK 激活可使其下游底物磷酸化,ULK1 是AMPK 通路的下游分子,参与自噬的起始,SIRT1是NAD+依赖性组蛋白脱乙酰酶,AMPK可促进NAD+的生成,激活SIRT1 因子[18]。研究显示,白果内酯通过激活AMPK/SIRT1/mTOR 通路,抑制IL-1β 诱导的软骨细胞中诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、环氧合酶2(Cyclooxygenase 2,COX-2)和基质金属蛋白酶13(Matrix metalloproteinase 13,MMP-13)的产生[19]。苍术素也参与AMPK/SIRT1 通路的调节,如苍术素通过Sirt1/AMPK 轴诱导的自噬调节减轻癌症厌食恶病质综合征[20]。本研究发现,使用苍术素处理软骨细胞后,p-AMPK、SIRT1、p-ULK1蛋白表达水平显著升高,表明苍术素可能激活SIRT1/AMPK 信号通路。本研究进一步使用AMPK 抑制剂compound C 与苍术素共同处理软骨细胞,结果发现compound C 可逆转苍术素对软骨细胞凋亡的抑制作用,提示苍术素可能通过激活AMPK/SIRT1 信号通路提高IL-1β 诱导的软骨细胞自噬,降低细胞凋亡。
综上所述,苍术素通过激活AMPK/SIRT1 信号通路促进IL-1β 诱导的大鼠软骨细胞自噬,抑制细胞凋亡。但本研究局限于AMPK/SIRT1 信号通路相关的部分蛋白,苍术素的具体作用机制仍须结合动物模型做更深入的研究。
