环状RNA 在2 型糖尿病和非酒精性脂肪性肝病中的作用研究进展
2024-04-24胡丹怡苏钡严海燕麦一峰
胡丹怡,苏钡,严海燕,麦一峰
研究表明,非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)在糖尿病(DM)患者人群中的患病率是非DM 患者的5 倍,2 型糖尿病(T2DM)作为最常见的DM,显示出与NAFLD 极强的相关性[1]。环状RNA(circRNA)作为一类具有共价闭环结构的新型RNA,已被证实参与了多种代谢性疾病的发生发展,这意味着circRNA具有成为此类疾病新型生物标志物和治疗工具的潜在作用[2]。本综述拟简要介绍circRNA 特征和功能,并总结部分circRNA在T2DM以及NAFLD病程中的作用研究进展。
1 circRNA 概述
1.1 circRNA 的生源论 最早在1976 年通过电子显微镜在真核细胞中观察到了circRNA 的存在[3]。起初被认为是一类转录废料,直到30 年后在小鼠中发现了Sry 基因的环状转录本[4],证据表明circRNA是多种生物过程中重要的调节因子[5]。根据原始序列,circRNA 可分为3 种:外显子环状RNA(ecircRNA)、内含子环状RNA(ciRNA)和外显子-内含子环状RNA(EIcircRNA),并主要通过直接反向剪接机制和套索参与的反向剪接机制驱动成环[2]。
1.2 circRNA 的生物学功能(1)circRNA 的miRNA 海绵样作用。该作用与它含有许多miRNA 结合位点密切相关,circRNA 通过特异性地结合一个或多个miRNA,发挥竞争性内源性RNA的功能,影响miRNA 对下游mRNA 的调控。首个被报道miRNA 海绵是CDR1as,它含有70 多个miR-7 保守结合位点,并作为miR-7 分子海绵阻断miR-7 对下游基因的表达抑制,从而间接调节转录后水平的基因表达[6]。(2)circRNA 和蛋白质的相互作用。①具有蛋白质海绵的作用。如circANRIL 与鱼素同系物1结合,破坏前体核糖体RNA的加工及核糖体的生物发生,诱导细胞凋亡[7]。②可以充当蛋白支架。如circAmotl1 通过与3-磷酸肌醇依赖蛋白激酶1(3-phosphoinositide dependent kinase-1,PDK1)和蛋白激酶B(Protein kinase B,PKB/AKT)物理性结合,激活PDK1 依赖的AKT1 磷酸化,从而触发pAKT 心脏保护性的核易位[2]。③circRNA 还具有招募蛋白质作用。如FECR1 可以招募TET1 以调节CpG 位点的去甲基化和转录活性,进一步增强癌细胞的侵袭性[8]。(3)circRNA 调节基因表达。研究证明,细胞核中的EIcircRNA 和ciRNA 可以通过与上游启动子、RNA 聚合酶II(RNA polymerase II,Pol II)和其他转录相关蛋白相互作用来调节基因的表达。一项研究报道了circEIF3J 和circPAIP2 通过U1 snRNA的结合位点与U1 snRNP 和Pol II相互作用,从而增强其亲本基因的表达[2]。(4)circRNA 的翻译能力。研究发现,circRNA 可以通过其内部核糖体进入位点(internal ribosome entry site,IRES)或N6-甲基腺苷修饰进行“无帽”翻译。目前尽管只有少数内源性circRNA(如circFAM188B、circMbl)被证明可以作为蛋白模板,数千种circRNA 被预测包含一个假定存在的开放阅读框和上游IRES[9],但大部分circRNA翻译成多肽或蛋白质的功能相关性仍不十分清楚,也有可能因为“无帽”翻译的特殊性,在缺乏必要功能域的情况下,它们可能作为显性负蛋白变异、诱饵或替代蛋白复合物的调节剂存在[10]。
2 circRNA 与T2DM
2.1 circRNA 在调节胰岛素抵抗(IR)和细胞功能中的作用 传统认为T2DM 以IR和细胞缺陷作为病理生理基础,在与高血糖和IR 的长期对抗中,胰岛素的代偿性增加也是有限的,最终将会出现细胞功能障碍、衰竭和高血糖共存的局面。现有证据表明,circRNA 积极参与调节细胞功能和T2DM 的发展。如circLRP6 在高糖处理的系膜细胞中上调,并通过海绵miR-205 介导细胞损伤,沉默circLRP6后,细胞凋亡减少,胰岛素分泌改善[11]。另外,circANKRD36 被发现在T2DM 大鼠模型中大量表达,沉默circANKRD36 可通过靶向miR-145-XBP1 降低血糖并抑制IR和炎症[12]。此外,研究表明circGlis3的表达上调可以降低细胞活力和增殖,同时加重胰岛内皮细胞功能障碍。敲除circGlis3 后,上述症状得到改善[13]。
2.2 circRNA在缓解内皮细胞受损中的作用 微血管内皮细胞是高血糖损害的主要靶点。Shi 等[14]在研究DM 小鼠伤口愈合情况时发现,circSnhg11 在内皮祖细胞(endothelial progenitor cells,EPCs)中的表达降低,circSnhg11 过表达可以通过miR-144-3p/HIF-1 轴抑制高糖诱导的内皮细胞损伤,缓解血管分化异常和炎症因子分泌增加。同样还发现,含有高浓度circ_0000250 的外泌体在高糖条件下通过促进自噬活化对恢复EPCs功能具有更大的治疗效果。过表达circ_0000250 通过海绵化miR-1-128p 来上调沉默信息调节因子1(Silent Information Regulator 1,SIRT1)的表达,影响伤口愈合[15]。因此,可以将circ_0000250/miR-128-3p/SIRT1 轴靶向内皮细胞功能障碍,作为糖尿病溃疡的候选治疗方案。T2DM病程中发挥作用的circRNA 见表1。

表1 在T2DM 病程中发挥作用的部分circRNA
3 circRNA 与NAFLD
3.1 circRNA 在脂质代谢中的作用 研究证明circScd1 可以通过激活JAK2/STAT5 途径,抑制脂滴形,降低三酰甘油(TG)水平,改善肝脂肪变性,抑制NAFLD 进展[16]。一项新的研究在NAFLD 啮齿动物模型的circRNA 表达谱中发现有28 个circRNA 显著下调,其中 circ_0001452、circ_0001453 和circ_0001454 通过靶向miR-466i-3p 和miR-669c-3p恢复AMP 依赖的蛋白激酶(adenosine 5’-monophosphate-activated protein kinase,AMPK)信号通路活性,从而抑制脂肪生成基因的转录和翻译[17]。类似的实验在游离脂肪酸(free fatty acids,FFA)处理的HepG2 细胞中发现circ_0048179 表达水平明显降低。过表达circ_0048179 后,细胞中谷胱甘肽过氧化物酶4(Glutathione Peroxidase 4,GPX4)的水平显著增加,miR-188-3p 受到抑制,细胞的氧化损伤得到改善[18]。
3.2 circRNA 通过调节自噬通量在NAFLD 中发挥作用 自噬是通过降解错误折叠的蛋白质、受损的细胞器和脂滴来保持细胞和组织稳态的重要过程,恢复自噬能力可以改善NAFLD 症状[19]。研究表明,哺乳动物的线粒体自噬亦是由PTEN诱导的假定蛋白激酶1(PTEN-induced putative kinase 1,PINK1)组成的通路介导的,该通路是目前与线粒体自噬相关的最受关注的信号通路之一[20]。相关性实验中,在受损肝细胞内过表达 circ_0000608 可以通过miR222/PINK1 轴增加线粒体自噬通量,抑制肝星状细胞增殖来改善肝纤维化,从而达到防止肝纤维化进一步恶化或治疗的目的[21]。同年,Yuan 等[22]发现NAFLD模型的自噬信号通路在上调circLDLR表达时被激活,脂质沉积程度减轻。加入miR-667-5p 模拟物可以逆转上述过程,并直接靶向SIRT1抑制自噬信号通路。在NAFLD病程中发挥作用的circRNA见表2。
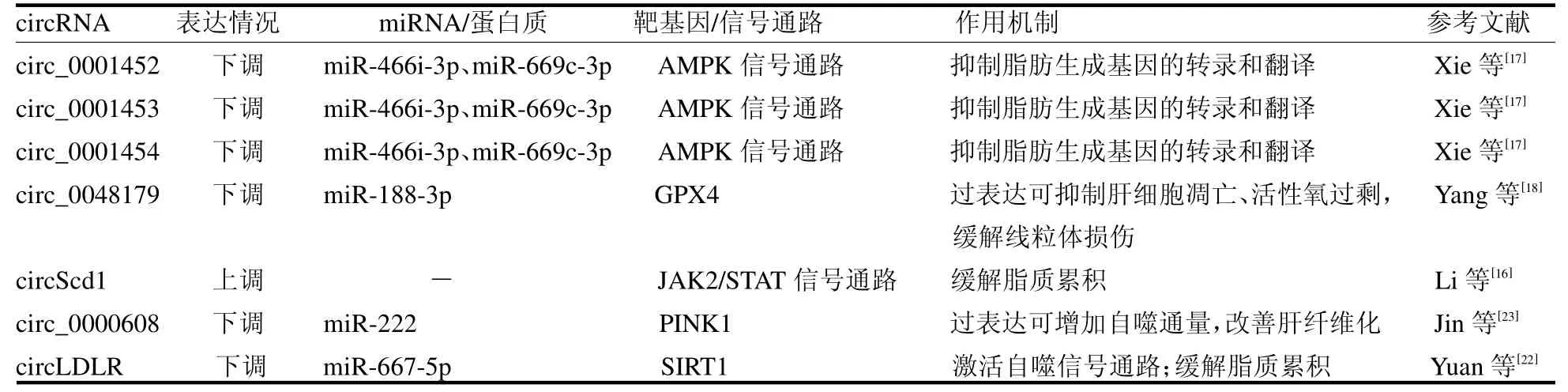
表2 在NAFLD 病程中发挥作用的部分circRNA
4 DM 与NAFLD 共享的部分circRNA
Li 等[24]通过差异分析得到circ_0004535 和CASP8 在NAFLD 及T2DM 患者中的表达水平低于对照组,在T2DM 合并NAFLD 的患者中甚至更低,而miR-1827 在合并组中的表达却远高于其他患者。过表达circ_0004535 和CASP8 导致miR-1827表达降低,同时改善了葡萄糖处理的LO2 细胞中脂肪变性的现象。另外,经生物功能富集分析,ceRNA网络中的特异性miRNA 主要富集在Toll 样受体(toll-like receptor,TLR)信号通路和细胞凋亡中。TLR 作为炎症反应关键的参与者,除了驱动炎症细胞因子的产生,还会导致胰岛细胞功能障碍,加速胰岛细胞凋亡,增强IR[25]。结合上述研究表明,circ_0004535 可以靶向结合miR-1827 调节CASP8以及TLR 信号通路和细胞凋亡相关功能,参与DM合并NAFLD 的发展。在另一研究中,相比于对照组,NAFLD 患者血清中的circHIPK3 和miR-34a 水平上调,circ_0046367、miR-29a水平以及Wnt/ -连环蛋白通路下调,并且检出TG、TC、低密度脂蛋白以及空腹和餐后2 h 血糖、糖尿病患病率均明显升高[26]。其中,-连环蛋白已被证实具有调节糖脂质代谢基因表达的作用[27]。经相关性分析,可以假设c irc_0046367/miR-34a 轴和circHIPK3/miR-29a 通过靶向Wnt/ -连环蛋白通路来调节DM和NAFLD发展过程中葡萄糖耐量、胰岛素敏感性以及脂质代谢过程。虽然该假设涉及的具体机制尚不十分明确,但给予的前期思路依旧有助于DM 合并NAFLD 患者的治疗。
此外,近年有研究团队确定了一种线粒体特异性circDNA,即脂肪性肝炎相关的circRNA ATP5B调节因子(steatohepatitis-associated circRNA ATP5B regulator,SCAR),经实验发现在小鼠体内可以靶向circSCAR 来缓解高脂饮食引起的肝硬化和IR[28],另有研究在糖尿病视网膜微血管病变的模型中发现circSCAR 表达显著下调,其靶向的线粒体功能相关蛋白(Drp1 和Fis1)上调和细胞通透性相关蛋白(claudin-5、occludin 和ZO-1)下调,抑制了细胞增殖。因此,circSCAR 不仅可以改善高脂引起的肝纤维化和IR,还可以缓解高糖诱导的氧化应激,缓解高浓度葡萄糖下人视网膜微血管内皮细胞的增殖抑制,改善线粒体功能和通透性损伤。在DM 和NAFLD 病程中均发挥作用的circRNA 见表3。

表3 在DM 和NAFLD 病程中均发挥作用的部分circRNA
5 总结
证据表明,circRNA 与DM、NAFLD 及其并发症的发展密切相关,主要表现为病理状态下circRNA的表达上调、下调或与正常生理状态下出现的差异表达。借此,可以将circRNA 在疾病中的作用初步分为3 种:参与疾病的发病机制,作为发现疾病的生物标记物,以及作为疾病的治疗靶点。通过纠正这些在疾病期间表达异常的circRNA 来扭转代谢紊乱的局面或许可以为临床治疗应用提供启示。并且这种基于circRNA 的基因疗法旨在通过影响circRNA/miRNA/下游基因信号转导轴来恢复糖脂代谢稳态,进一步说明了特定的circRNA 有望成为预防或挽救疾病进展以及恶化的治疗靶点。
利益冲突 所有作者声明无利益冲突
