基于3D生物打印构建结直肠癌个体化药物预测模型的研究
2024-04-24周波俞甲子孙佳泽郑宇鹏杨沔
周波,俞甲子,孙佳泽,郑宇鹏,杨沔
近年来,我国结直肠癌(colorectal cancer,CRC)发病率及病死率均呈逐年上升趋势[1]。大多数CRC患者确诊时已是中晚期,其中15%~25%发生肝转移,因此以化疗和靶向治疗为主的辅助治疗手段愈发重要[2-3]。由于肿瘤的异质性及肿瘤微环境的复杂性,不同患者对相同药物反应不同[4]。3D 生物打印(three-dimensional bioprinting,3DP)技术的兴起为肿瘤模型的研究提供了新的具有临床意义的平台。依赖计算机辅助的3DP可将肿瘤细胞作为“细胞种子”,根据研究人员设计的模型精确打印,通过使用生物墨水中的活细胞快速建立具有复杂三维结构的体外“器官”,并能模拟体内的微环境[5-6]。本研究拟探讨3DP技术构建的CRC个体化药物预测模型的可靠性及指导临床精准化治疗的可行性,现报道如下。
1 资料与方法
1.1 一般资料 收集2023 年7—11 月宁波市医疗中心李惠利医院收治的行CRC 根治术并行术后辅助化疗患者的临床信息和肿瘤样本,纳入标准:(1)年龄18 ~80 岁;(2)组织病理学确诊CRC,且可接受放化疗;(3)肿瘤标本体积较大,足够常规病理及本研究采集;(4)术后恢复良好,无严重并发症。排除标准:(1)孕妇或哺乳期妇女;(2)放化疗、手术后严重器官损伤或无法继续全身化疗者;(3)术后无需辅助化疗者。本研究获得宁波市医疗中心李惠利医院医学伦理委员会批准(KY2023SL167-01),所有研究对象均同意参加本研究并签署书面知情同意书。
1.2 模型构建 肿瘤标本切除后立刻取样,至少1cm3,并迅速置于4℃保存液中保存,运输至实验室后于超净台中将体积较大的肿瘤样品分成两份,一份保存于4%多聚甲醛中备做组织学检测,一份进行肿瘤细胞分离提取。体积较小的肿瘤样本直接进行细胞分离提取:将样品在含有0.2% 原代细胞抗菌剂Primocin(Invivogen,USA),1%抗生素-抗真菌剂(Gibco,USA)和10mol/L Y-27632(Sigma-Aldrich,USA)的冷磷酸盐缓冲溶液(PBS)中洗涤5 min×3 以避免微生物的污染,然后在冰上低温下切成直径<3 mm的碎片。将样品碎片置于冷的PBS 中转移到15 ml 离心管中,并以1 000 r/min 离心3 min,直到上清液变得清晰。弃去上清,加入用DEME/F12 培养基配制含有1.5 mg/ml 胶原酶II 型(Gibco),1 mg/ml 分散酶II 型(Sigma-Aldrich),20g/ml 透明质酸酶(Sigma-Aldrich),0.2%原代细胞抗菌剂Primocin,1%抗生素-抗真菌剂,10mol/L Y27632 的组织消化液中,置于轨道振荡器中在37 ℃下消化30 ~60 min。消化结束后用100m 细胞滤网(BioSharp,USA)过滤,以3 000 r/min离心5 min收集肿瘤细胞沉淀,用CRC 3DP 培养基:Advanced DMEM/F12(Gibco)培养基中含有1×B27 Supplement(Gibco)、1×N2 Supplement(Gibco)、1× GlutaMAX Supplement(Gibco)、10 mmon/L Hepes(Gibco)、50 ng/ml Human EGF(PeproTech,USA)、1.25 mM N-acetyl-L-cysteine(Sigma-Aldrich)、10 ng/ml Prostaglandin E2(Sigma-Al drich)、500 ng/ml A8301(Sigma-Aldrich)、3mol/L SB202190(Sigma-Aldrich)、10 nmol/L Gastrin (ISigma-Aldrich)、1%抗生素-抗真菌剂及0.2%Primocin)重悬后进行细胞计数。
将肿瘤细胞悬液、4%海藻酸钠(Sigma-Aldrich)和12% 明胶(Sigma-Aldrich) 以2∶1∶2 的体积比混合配制成含有肿瘤细胞的生物墨水,其中肿瘤细胞最终密度为5×106/ml,海藻酸钠和明胶的最终浓度为4.8% 和0.8%。将生物墨水置入装有23 G 针头的3 ml 螺口注射器(BD,USA)中,于4 ℃静置30 min 使生物墨水具有可打印性。将注射器装载于3D生物打印机(SunP Biotech,USA)的打印喷头中,打印机喷头和打印平台的温度分别预设置为20 ℃和10 ℃。在计算机中将3DP 模型设计为尺寸为6 mm×6 mm×1.2 mm 的网格状立体结构,使用1.5 mm3/s 的打印速度按模型结构在48 孔板中进行打印,打印结束后加入3%氯化钙溶液浸泡打印体3 min 进行化学交联固化,用HBSS 溶液清洗1 遍后加入CRC 3DP 培养基进行培养。
1.3 CRC 3DP 模型细胞活性染色 按照Calcein/PI细胞活性与细胞毒性检测试剂盒对培养2周的CRC3DP模型进行细胞染色,于荧光显微镜下观察并拍照。
1.4 染色(1)HE染色:新鲜肿瘤标本及CRC 3DP模型在培养10 d 收集用于HE染色,于5%多聚甲醛钙溶液中固定24 h后进行常规脱水,石蜡包埋,制成石蜡切片,进行HE 染色,镜下观察拍照。(2)免疫荧光染色:新鲜肿瘤标本于5%多聚甲醛钙溶液中固定24 h 后进行常规蔗糖梯度脱水,OCT 包埋制成冰冻切片用于免疫荧光染色,CRC 3DP 模型培养10 d后用明胶-海藻酸钠裂解液将打印体进行物理裂解,对打印体中形成的细胞球进行免疫荧光染色;免疫荧光染色具体步骤按免疫荧光的试剂盒说明书操作,5%山羊血清(索莱宝,中国)封闭后加入一抗小鼠抗CK7(Abcam, USA)、兔抗CK20 (Abcam),兔抗-catenin(Abcam), 鼠抗Ki-67(Abcam),工作浓度为1∶200,4 ℃孵育过夜,PBS 冲洗,相对应加入荧光二抗抗兔IgG Alexa Fluor 488(Abcam)和抗兔IgG Alexa Fluor 594(Abcam),工作浓度为1∶300,室温孵育2 h,DAPI(Sigma-Aldrich)染核10 min,于激光共聚焦显微镜下观察拍照。
1.5 化疗药物敏感性检测 在CRC 3DP 模型培养7 d 后,对3DP 模型进行化疗药物敏感性测试,所用化疗药物为氟尿嘧啶(5-Fluorouracil)、奥沙利铂(Oxaliplatin)、伊利替康(Irinotecan)3 种CRC 一线化疗用药。体外给药浓度梯度均设置为0、0.1、1、10、50、100mol/L。使用CellTiter-Glo3DCellViabilityAssay(Promega,USA)进行细胞活性测试。
1.6 统计方法 数据采用R 软件4.0.1 版及Graphpad prism 9.0 版分析,根据药物剂量-反应曲线计算化疗药物的半数抑制浓度(IC50)值,根据Simpson 法则推断AUC 值,通过将相应的AUC 值除以每个浓度范围的最大面积来获得归一化的AUC。
2 结果
2.1 3DP 模型建立及形态特征 纳入CRC 患者20例,成功构建3DP 模型19 例,因提取细胞量不足培养失败1 例;肿瘤术后病理均为腺癌。体外培养发现原代CRC细胞在3DP模型中的明胶-海藻酸钠生物墨水和CRC 3DP 培养基支持下生长状态良好,1周内可以形成3D细胞团结构,可持续生长培养保持高度细胞活性,见图1。
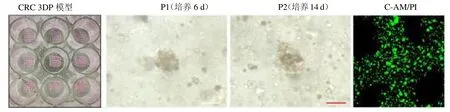
图1 CRC 3DP 模型大体形态及活细胞染色图(标尺=100 m,P1 及P2 为光镜亮场,C-AM/PI 为荧光染色)
2.2 CRC 3DP 模型病理学特征与亲本组织的对比 CRC 3DP 模型中CRC 细胞团染色特征与亲本组织HE 染色潜在相关,从病理学层面判断两者具有相似同源性,见图2A;两者在肿瘤标记物的表达上高度一致,见图2B。
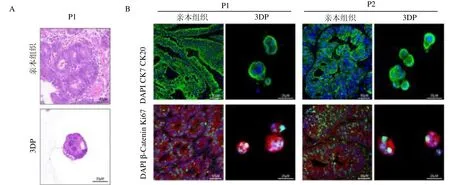
图2 CRC 3DP 模型病理学特征与亲本组织的对比图
2.3 CRC 3DP 模型化疗药物测试 对不同CRC 患者的3DP 肿瘤模型体外给予化疗药物Oxaliplatin、CPT-11 及5-Fu 作用72 h 后检测细胞活性,根据检测结果进行药物剂量-反应曲线分析药物敏感性,见图3A。根据药物剂量-反应曲线计算标准化的AUC值可发现3DP 肿瘤模型药物敏感性具有显著异质性,见图3B。

图3 CRC 3DP 药物药物剂量-反应曲线及药物敏感性异质性
2.4 CRC 3DP 模型化疗药物敏感性分析 将IC50<25%药物浓度(test drug concentration,TDC)定义为敏感(3 种药物均无抑制的定义为耐药型,否则定义为敏感型),筛选出化疗药物敏感型12 例,耐药型7 例。初步发现2 例3DP 肿瘤模型提示耐药的伴肝转移的患者行肠癌根治术+辅助化疗2 ~3 个疗程后病情进展迅速,影像学提示肝转移灶明显增大,见封三图5A;2 例3DP肿瘤模型提示敏感的伴肝转移的患者术后行辅助化疗病情明显缓解,影像学提示肝转移灶明显缩小,见封三图5B。

图5 2例化疗后进展及2例化疗后缓解患者影像学检查结果
3 讨论
目前二维(2D)培养是一种重要的药物筛选模型,但在实践中,在2D 培养模型中具有显著抑瘤作用的抗肿瘤药物应用到人体后,其药理作用并不好[7]。3D培养模型在一定程度上克服了2D培养的平面结构在空间上的局限性,但肿瘤细胞只是一层一层堆叠的,细胞之间没有建立真正的空间结构,细胞之间仍然缺乏真正3D 结构意义上的相互作用[8]。患者衍生的异种移植(patient-derived xenografts,PDX)模型保持了原始异质性患者肿瘤的特征,已被证明有助于预测肿瘤的药物敏感性或耐药性。然而,PDX模型具有周期长、成功率低、价格高、异种肿瘤微环境等难以理想化的缺点。近年来,患者来源的肿瘤器官(patient-derived tumor organoid,PDTO)作为临床前癌症模型被广泛研究,用于药物筛选[9-10]。PDTO 的主要问题包括缺乏标准化的方法,类器官培养复杂,操作不可重复性以及较高的成本都是不容忽视的[9-12]。
3DP 以细胞和生物材料为基本单元,按仿生形态学、细胞特定微环境等要求打印独特的三维生物结构体。在打印过程中,活细胞、细胞外基质成分、生物材料和生长因子通过打印实现空间可控排列组装,体外制造可模拟体内微环境的复杂结构[13-14]。3DP 技术可根据不同个体、不同组织的微环境特征定制打印个性化的体外生物学模型。这就克服了传统类器官技术的限制,并且在构建多细胞微环境方面具有天然优势。
本研究结果显示,3DP 预测模型中的原代肿瘤细胞具有3D结构生成能力,肿瘤体积变化小且均匀分布。3DP 技术的优势在于更低的成本、更简洁有效的建模过程、更好地保持肿瘤细胞的活力和更高的建模成功率,使得3DP 预测模型更有希望应用于癌症基础研究和临床药物预测。本研究中,亲本肿瘤细胞的数量过少是建模的最大制约,1 例患者因内镜下钳取肿瘤标本少导致原始肿瘤细胞不足而建模失败。病理层面发现CRC 3DP 模型中CRC 细胞团染色特征与亲本组织HE 染色潜在相关,进一步的免疫荧光检测发现结直肠癌3DP 体外肿瘤模型保留了配对的亲本肿瘤的组织学特征,两者相似表达CK7、CK20、Ki-67、-Catenin等标志物,提示3DP预测模型具备良好可靠性,其药物反应能较好地代表亲本肿瘤。本研究临床药物敏感性实验提示,3DP预测模型对各种化疗药物的反应存在显著异质性,这跟临床实际情况也是符合的。本研究发现2 例对应3DP 肿瘤模型提示3 种药物均耐药的伴有肝转移的患者行肠癌根治术后行辅助化疗后病情进展迅速,影像学提示肝转移灶明显增大;2 例3DP肿瘤模型提示敏感的伴肝转移的患者行肠癌根治术+辅助化疗(XELOX)2 ~3 个疗程后病情进展迅速,影像学提示肝转移灶明显增大;另外2 例3DP 肿瘤模型提示CPT-11、5-Fu双药敏感的伴肝转移的患者术后行辅助化疗(XELOX)病情明显缓解,影像学提示肝转移灶明显缩小。
综上所述,基于3DP 技术成功构建CRC 个体化药物预测模型,该模型高度保留亲本肿瘤的组织学特征,并对临床药物反应具有异质性。
利益冲突 所有作者声明无利益冲突
作者贡献声明 周波、孙佳泽:实验操作、论文撰写;俞甲子、郑宇鹏:数据整理、统计学分析;杨沔:研究指导、论文修改、经费支持
