基于RNA测序探究发热对巨噬细胞吞噬沙门菌极化状态的影响
2024-04-24戴婷婷马雪寒詹晔斐许兆军
戴婷婷,马雪寒,詹晔斐,许兆军
伤寒是由伤寒沙门菌引起的全身性感染性疾病,包括持续性高热(40 ~41 ℃)、特殊中毒面容及皮肤玫瑰疹等多种临床表现,其中持续性高热(稽留热)为其重要的表现之一[1]。伤寒沙门菌通过污染的食物到达小肠,穿过肠黏膜进入肠系膜淋巴结,并进入血液、肝、脾和骨髓中,被巨噬细胞吞噬并大量繁殖。伤寒沙门菌感染巨噬细胞初期,细胞向M1 型分化,导致以M1 型为特征的多种细胞因子转录水平改变,对机体启动急性感染期的炎症发应和清除病原菌具有重要作用,但过度的M1 型巨噬细胞反应会引发炎症瀑布,导致败血症[2]。在感染后期,巨噬细胞由M1 型转变为以免疫修复和调节为主的M2型。引起慢性感染的细胞内细菌也可诱导巨噬细胞提前向M2 型分化,从而逃避机体的免疫反应[3-4]。伤寒患者发热时体内感染沙门菌的巨噬细胞其极化状态如何改变,一直以来并不清楚。因此本研究通过高通量RNA测序技术探究发热温度对吞噬伤寒沙门菌的巨噬细胞极化的影响,现报道如下。
1 资料与方法
1.1 材料 小鼠单核-巨噬细胞株(J774A.1)购自中国科学院上海细胞生物学研究所细胞库,鼠伤寒沙门菌[CMCC(B)50071]由宁波市疾病预防控制中心病原微生物实验室赠送。
1.2 巨噬细胞处理 在37、38、39 和40 ℃4 种温度条件下制备巨噬细胞感染和未感染伤寒沙门菌的模型,共得到8 组分别为M37、M37CK、M38、M38CK、M39、M39CK、M40 和M40CK,其中CK 为对照组。伤寒沙门菌培养和荧光标记:采用营养肉汤震荡培养至对数期,用PBS(pH 值7.2)制备1×108/ml 菌悬液。将一定细菌浓度的菌悬液与CFDA-SE染料溶液混合一定时间后,洗掉未结合的CFDA-SE,在荧光显微镜下观察可明显看见细菌发出绿色荧光。单核-巨噬细胞培养并感染伤寒沙门菌:以100∶1 的感染复数将荧光标记的对数期伤寒沙门菌加入单核-巨噬细胞培养液中,110 g 离心5 min 以促进细胞和细菌接触,分别选择37 ~40℃4 个温度共孵育30min,再用预温(与培养温度一致,下同)的PBS 洗涤2 次,随后换成含100g/ml庆大霉素细胞培养液孵育1h以去除细胞外细菌,最后换成含10g/ml 庆大霉素细胞培养液,培养2h。巨噬细胞吞噬沙门菌率的检测采用Dx-FLEX流式细胞仪(美国BeckmanCoulter)进行,并使用CytExpert 流式细胞处理软件操作分析。
1.3 RNA 文库构建 采用TRIzol 试剂(美国Invitrogen 公司)依照说明书提取总RNA,使用Nano-Drop 2000 核酸蛋白质分析仪(美国Thermo Scientific 公司)测定总RNA 的质量和浓度,使用Agilent 2100 生物分析仪(美国安捷伦公司)评估RNA 完整性,使用VAHTS Universal V5 RNA-seq Library Prep试剂盒依照说明书构建转录组文库。
1.4 RNA 测序和差异表达基因分析 采用llumina Novaseq6000 测序平台对文库进行测序,并生成150bp双端读序。采用fastp 软件对fastq 格式的原始读序进行处理,去除低质量读序后获得高质量读序用于后续数据分析。使用HISAT2 软件进行参考基因组比对,并进行基因表达量(FPKM)计算,通过HTSeq-count获得每个基因的读序计数。利用DESeq2 软件进行差异表达基因分析,其中符合q值<0.05 且|log2FC|>1 阈值的基因被定义为差异表达基因(DEGs)。
1.5 共同差异表达基因分析 利用韦恩图找出不同温度条件下共同表达的差异基因,分为上调和下调。
1.6 巨噬细胞M1、M2 极化相关基因转录分析和趋势分析 利用欧易云平台转录热图和趋势分析工具,对巨噬细胞MI、M2 极化相关基因进行转录水平热图分析和趋势分析。
2 结果
2.1 共同差异表达基因分析 通过不同温度处理获得各温度条件下的共同差异表达基因2487条,利用韦恩图找出1256条共同上调基因,1231条共同下调基因,见图1。
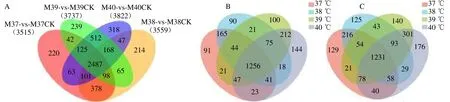
图1 差异表达基因的共表达分析
2.2 M1 和M2 极化相关基因的转录分析 将共同上调基因按温度上升作出其转录水平变化的热图,存在三簇基因对温度的处理呈现规律变化,基因簇Ⅰ随温度升高表达水平逐渐下调,而与之相反,基因簇Ⅱ和基因簇Ⅲ随温度升高表达逐渐升高,见图2。

图2 不同温度条件共同上调和下调基因的转录热图
将这些基因进行GO 和KEGG 富集分析,基因簇Ⅰ基因参与凋亡、模式识别受体信号通路、NF- B信号正向调控、免疫反应等过程,KEGG分析中主要参与肿瘤坏死因子(TNF)通路、Toll样受体信号通路等过程。基因簇Ⅱ和基因簇Ⅲ则参与炎症反应、免疫系统过程、抗病毒防御反应、干扰素IFN- 细胞反应和对LPS的细胞反应等与促炎反应相关的生物学过程。而KEGG 富集显示这些基因参与调控细胞因子-细胞因子受体相互作用、TNF 信号通路、NOD 样受体信号通路、NF- B 信号通路和JAK-STAT 通路等与M1 极化相关的信号通路过程,见图3。

图3 共同上调基因基因簇基因GO 和KEGG 分析
与共同上调基因不同,共同下调基因中基因簇Ⅰ基因参与IL-6 的负调控过程、B 细胞的增殖等过程,但主要参与固醇和胆固醇等生物合成及脂质代谢过程。KEGG 富集分析主要有HIF-1 缺氧信号通路、脂肪酸代谢与合成信号通路,此外还包括B细胞受体信号通路、Fcy R 介导的巨噬细胞吞噬过程。而基因簇Ⅱ基因簇则主要参与细胞周期、细胞分裂、染色体分离和组装以及DNA 损伤的细胞反应等过程,见图4。
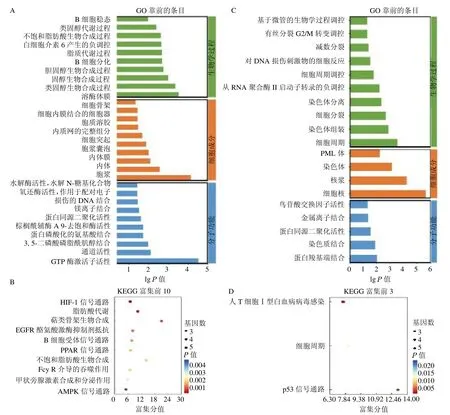
图4 共同下调基因簇基因GO 和KEGG 分析
通过将促进巨噬细胞向M1 极化的信号通路组分以及下游标志性分子与以上基因簇比对,发现与M1 极化有关的大多数基因都在共同上调基因的基因簇Ⅱ和基因簇Ⅲ中富集,只有少数的基因在基因簇Ⅰ富集,将这些基因作转录水平随温度升高的热图,见图5A,除少数基因包括TNF- 、IRF1 和CD80/CD86外随温度升高呈先升高后逐渐下降或持续下降趋势,绝大多数基因随温度升高均逐渐上调,包括JAKSTAT1/2 信号通路组分、干扰素调节因子IRF9、诱导型一氧化氮合酶Nos2、细胞因子IL-12b和趋化因子CCL-5、CXCL-9 和CXCL-16。

图5 与激活巨噬细胞M1 和M2 极化相关的基因变化热图
IL-4/IL-13-JAK1/JAK3-STAT6 信号通路、IL-10-STAT3-TGF /IL-1Ra/Arg1 和JMJD3-IRF4 通路可诱导巨噬细胞M2 极化,并抑制M1 极化。通过比对分析发现大多数M2 极化相关基因存在于共同上调基因中,而且大多数存在于基因簇Ⅱ和基因簇Ⅲ中,绘制转录水平热图,见图5B。
2.3 M1 和M2 极化相关基因的趋势分析 M1 极化相关基因表达水平随温度升高(低于39℃)而逐渐升高,39 ~40℃,其总体表达水平不再改变,且部分基因发生下调。与M2 极化相关的基因表达水平随温度升高而逐渐升高(39℃),40℃时不再增加,见图6。

图6 与M1 和M2 极化相关基因的显著模块趋势图
3 讨论
伤寒是沙门菌感染引起的一种全身性疾病,巨噬细胞一方面在清除病原体和特异性免疫应答中发挥不可或缺的作用,但也容易成为沙门菌免疫逃逸和繁殖的场所。伤寒患者伴随严重的发热症状,目前尚不清楚发热对于巨噬细胞极化的影响,探究温度影响巨噬细胞极化状态的调控机理,对于认识和处置伤寒热具有重要意义。本研究通过体外感染沙门菌的小鼠单核巨噬细胞,利用不同温度处理模拟体内发热状态,发现沙门菌的感染均会诱导各温度条件下的巨噬细胞向M1 状态极化,且随着温度升高(低于39℃),大多数与M1 极化相关的基因转录水平逐渐升高,而温度继续升高(40 ℃),这些基因不再发生上调,且少数发生下调。此外,温度升高的同时,也会逐渐诱导与M2 极化相关基因的表达。因此,适当的发热(低于39 ℃)有利于巨噬细胞发挥病原体清除的能力,而温度过高则可能造成巨噬细胞过早向M2极化,抑制巨噬细胞的促炎功能。
以往研究发现,巨噬细胞极化为M1 状态时,会分泌TNF,作为标志性分子发挥杀伤细菌功能[5];同时上调细胞表面共刺激分子CD80 和CD86 的表达,促进与T 细胞的接触并使之活化[6]。在沙门菌感染巨噬细胞早期,TNF- 信号通路也会被激活,促进巨噬细胞向M1 极化,发挥促炎功能[7]。本研究表明,较低发热温度(37 ~38 ℃)下沙门菌感染早期,TNF 表达量较未感染组升高,这与之前的研究一致。但随温度继续升高,其表达量开始下降,提示巨噬细胞M1极化被抑制。许多微生物都有利用巨噬细胞极化过程实现免疫逃逸的能力[8],其中沙门菌能够诱导巨噬细胞向M2 极化,王耀楠等[9]发现肠炎沙门菌能够通过促进PKM2-JAK2-STAT3-IL10 通路诱导巨噬细胞M2 型极化,同时鼠沙门菌能够拮抗TNF- 通路而促进巨噬细胞向M2 极化。本研究中过高的发热温度(39 ~40 ℃)使TNF 转录水平下降,表明沙门菌可能通过拮抗TNF-通路而促进巨噬细胞M2 极化,从而逃逸免疫杀伤,这与以往的研究一致。此外,巨噬细胞作为一种抗原递呈细胞,其表面的CD80/CD86 共刺激分子是M1 极化的标志性分子。本研究结果显示随发热温度上升,也呈现出先升高后降低的趋势,与TNF 的变化相似。以上结果表明,不同的发热温度能够激活或抑制巨噬细胞极化信号通路,从而导致不同的巨噬细胞分化命运,而这一过程是否是沙门菌所独有的,则需要更多的证据支撑。
在伤寒感染过程中,临床上对如何处置发热症状存在一定的争议。对一些侵袭性细菌感染,发热一般有利于清除病原菌,抑制细菌生长[10],也可以诱导淋巴器官中淋巴细胞动员,特别是IL-6 活化,增强免疫防御[11],同时也能增强Ⅰ型干扰素反应,促进杀菌功能[12]。但在目前医疗实践中,即使在程度较低的发热状态下,也常常进行退热干预治疗。但在小鼠脓毒症模型中,发热未干预组比发热干预组可以获得更好的呼吸功能、较低的血乳酸浓度和更长的生存期[13]。临床上存在着“最有利于疾病恢复的发热温度”等疑问[14]。因此,正确对待和处置发热有重要的临床意义。本研究初步发现,对于鼠沙门菌感染巨噬细胞模型,较低的发热温度有利于巨噬细胞M1 极化,发挥杀菌能力,而温度过高则可能诱导巨噬细胞M2 极化,使沙门菌发生免疫逃逸。这些进一步为临床上如何处理发热症状提供有益的参考。
致谢 感谢宁波市第二医院医学实验部对本研究的支持
利益冲突 所有作者声明无利益冲突
作者贡献声明 戴婷婷:数据整理、论文撰写;马雪寒:数据分析、论文修改;詹晔斐:实验操作、论文修改;许兆军:实验设计、研究指导、经费支持
