乳酸脱氢酶与白蛋白比值与脓毒性休克患者预后的关系
2024-04-24孙越晨叶莉莉严双凤
孙越晨,叶莉莉,严双凤
脓毒症是由于宿主对各种原因引起的感染反应功能失调所导致的危及生命的器官功能障碍[1];而脓毒症休克是由于早期脓毒症病情未得到有效控制而导致,其病情进展迅速,死亡率高[2]。虽然近年来关于脓毒症及脓毒性休克诊疗的指南不断更新,治疗手段及方法不断改进,但其死亡率仍居高不下[3]。有研究报道,约30%的重症患者可能会发展为脓毒症甚至是脓毒性休克,而脓毒性休克患者的病死率更高达40%左右[4-5]。乳酸脱氢酶与白蛋白比值(lactate dehydrogenase to albumin ratio,LAR)是一种新型的炎症标志物,易于获得且价格低廉,已证实在下呼吸道感染、恶性肿瘤等患者预后的预测价值[6-8]。本研究探讨LAR与重症监护病房(ICU)住院的脓毒性休克患者28 d 全因死亡率之间的关系,现报道如下。
1 资料与方法
1.1 资料来源 本研究采用回顾性研究方法,纳入的病例来自美国重症监护医学信息数据库(MIMICIV),研究的起止时间为2008―2019 年。贝斯以色列迪康医疗中心和麻省理工学院附属机构审查委员会批准了该数据库的建立和发布。本研究一名作者完成了美国国立卫生研究院的在线培训课程,以获得使用该数据库的权限(ID:51832843)。纳入标准:(1)脓毒性休克患者,年龄≥18 周岁;(2)首次在ICU住院。排除标准:(1)ICU 住院时间<24 h;(2)ICU住院当天死亡;(3)LAR 值等关键变量缺失。
1.2 方法 获得数据提取资质的研究人员使用Postgre SQL 软件进入MIMIC-IV数据库,根据纳入及排除标准提取患者的相关数据资料,包括患者年龄,性别,序贯器官衰竭评分(SOFA),急性生理与慢性健康(APACHEII)评分,实验室指标(阴离子间隙、乳酸脱氢酶、白蛋白、LAR、尿素氮、肌酐、乳酸、天冬氨酸氨基转移酶、总胆红素、血糖、白细胞、血红蛋白、血小板、血钾、血镁、血磷、血总钙、国际标准化比值),治疗情况[机械通气、连续肾脏替代治疗(CRRT)、使用去甲肾上腺素、使用新鲜冰冻血浆],合并症(恶性肿瘤、心源性休克、急性胰腺炎、慢性肾脏病及急性肾损伤等),ICU 住院时间。依据患者28 d 预后情况,分为存活组和死亡组。根据限制性立方样条(RCS)分析获得的最佳截断值,将患者分为低LAR 组(LAR <11.08)和高LAR 组(LAR≥11.08)。研究结局指标是患者28 d全因死亡率。
1.3 统计方法 采用Stata 14.0 统计软件进行数据分析,正态分布连续变量以均数±标准差表示,采用t检验;非正态分布连续变量以中位数(四分位数间距)表示,采用秩和检验;分类变量以百分比表示,采用2检验。应用RCS 分析LAR 与脓毒性休克患者28 d全因死亡风险的整体关系;采用Kaplan-Meier 生存曲线和log-rank 检验比较低LAR 组和高LAR 组患者28 d 累积生存率的差异。影响因素分析采用多因素Cox 回归分析。P <0.05 表示差异有统计学意义。
2 结果
2.1 基本临床特征 最终纳入患者1 659 例,死亡643 例,占38.76%。死亡组患者年龄,SOFA,APACHEII 评分,阴离子间隙,乳酸脱氢酶,LAR,肌酐,尿素氮,乳酸,天冬氨酸氨基转移酶,总胆红素,血钾,血镁,血磷,国际标准化比值,机械通气、CRRT、使用去甲肾上腺素、新鲜冰冻血浆占比,合并恶性肿瘤、心源性休克、急性肾损伤和慢性肾脏病的比例均高于存活组;而血白蛋白、血红蛋白、血小板及合并急性胰腺炎的比例低于存活组(均P<0.05),见表1。
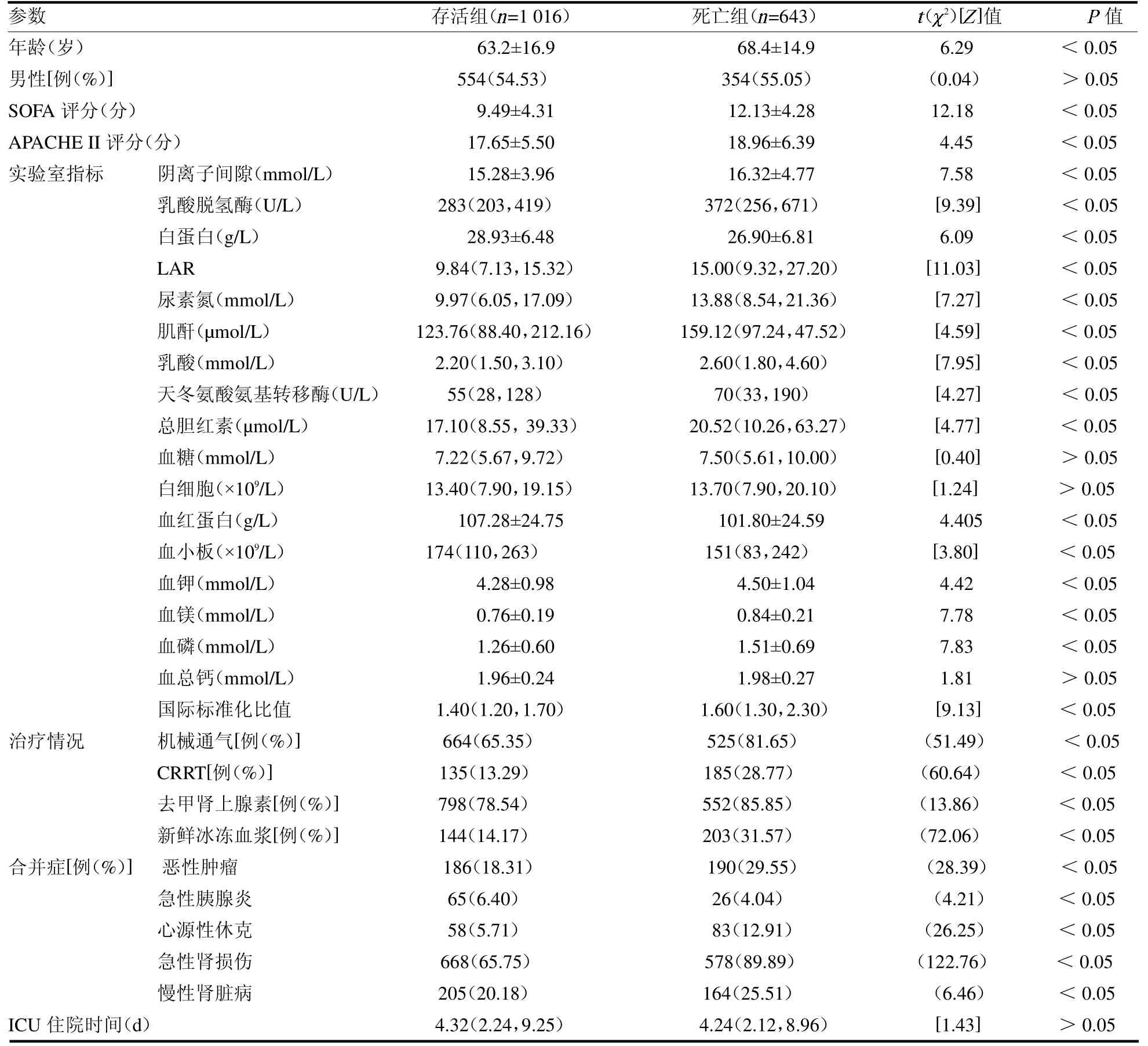
表1 存活组和死亡组患者基本临床特征比较
2.2 LAR 与脓毒性休克患者28 d 全因死亡风险的整体关系 RCS 显示,LAR 与脓毒性休克患者28 d全因死亡风险整体呈非线性趋势关系(2=46.93,P<0.05),当LAR 约为11.08 时,其HR 约为1,见图1。
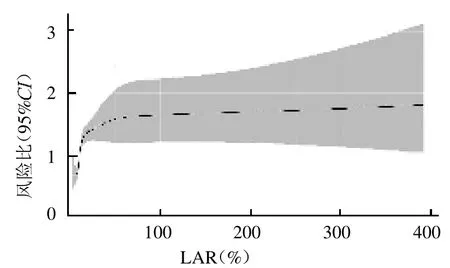
图1 LAR 与脓毒性休克患者28 d 全因死亡风险的关系
2.3 生存曲线分析 依据RCS 分析确定的最佳截断值,将所有研究对象分为低LAR 组和高LAR 组,高LAR 组患者的累积生存率明显低于低LAR 组(log-rank2=104.23,P <0.05),见图2。

图2 脓毒性休克患者28 d 累积生存率Kaplan-Meier 生存曲线
2.4 危险因素分析 LAR、年龄、SOFA 评分、APACHE II 评分、肌酐、乳酸、天冬氨酸氨基转移酶、血镁、国际标准化比值以及合并恶性肿瘤、心源性休克及急性肾损伤均是脓毒性休克患者28 d全因死亡率的独立危险因素(均P <0.05),见表2。
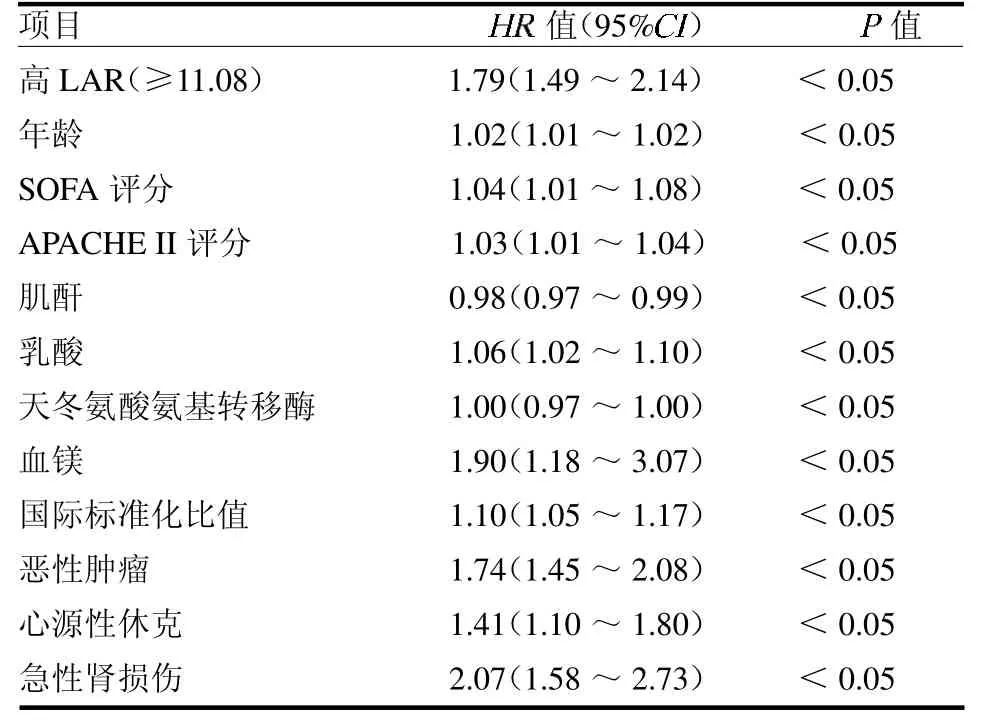
表2 脓毒性休克患者28 d 全因死亡率Cox 回归分析
3 讨论
脓毒症是各种致病微生物引起,伴随内毒素及炎症因子大量释放的系统性炎症反应[9]。作为其严重形式,脓毒性休克常导致多器官功能障碍和细胞代谢紊乱,具有高死亡率和极差的预后[10]。早期诊断和及时治疗,包括尽早抗感染和液体复苏,是改善患者预后的关键[11]。因此,识别可靠、经济且方便的生物标志物来预测脓毒性休克患者的预后是当前重症医学的一个紧迫需求。
乳酸脱氢酶是关键的糖酵解酶,参与丙酮酸转化为乳酸的过程,并且乳酸脱氢酶水平升高通常提示组织缺血或及炎症,反映损伤程度。乳酸脱氢酶在预测感染和肿瘤患者预后方面已有应用[12-13]。而血清白蛋白作为阴性急性期反应物,其水平的降低与脓毒症患者的不良预后密切相关[14],可能是由全身炎症引起的毛细管渗透导致[15]。尽管乳酸脱氢酶和白蛋白是重要生物标志物,但它们受多种因素影响,可能限制了它们单独预测预后的能力。因此,一些研究提出将LAR 作为预后的新指标。其中一项关于1 334 例结肠癌患者的研究表明,LAR预测总生存时间和无疾病进展生存时间比传统TNM 分期更准确[16]。LAR 还与ICU 重症感染患者的院内死亡率相关[17],并且在一项涉及6 453 例脓毒症的研究中,被证明是较高的28d 及90d 死亡率的独立预测因素[18]。然而,关于LAR与脓毒性休克患者预后的关系,目前少有报道。
本研究旨在探讨LAR 与脓毒性休克患者短期预后之间的关系。比较生存和死亡患者群体,发现LAR、SOFA 评分、APACHE II 评分在死亡患者中更高。此外,死亡患者更可能伴有恶性肿瘤、心源性休克、急性肾损伤和慢性肾脏病。随着LAR值的增加,患者28 d 全因死亡风险也随升高。Cox 回归分析显示,LAR 是28 d 全因死亡风险的独立危险因素。虽然研究结果也表明SOFA 评分和APACHE II 评分是预后的独立危险因素,与既往研究结果类似[19];但相对于LAR,这些评分更为复杂,且LAR 的风险比更加突出,这也间接说明了LAR在预测患者预后方面有更大的优势。
综上所述,LAR升高(≥11.08)是入住ICU的脓毒性休克患者28 d 全因死亡率增加的独立危险因素,对于预测该类患者的短期预后具有潜在的临床应用价值。
利益冲突 所有作者声明无利益冲突
作者贡献声明 孙越晨、叶莉莉、严双凤:论文构思、研究设计、论文撰写和论文修改等;叶莉莉:数据提取、整理和统计学分析;叶莉莉、严双凤:经费支持
