NAFLD患者肝纤维化影响因素的风险预测模型构建与效能评价
2024-04-24施晓英傅思华傅怡悦
施晓英,傅思华,傅怡悦
非酒精性脂肪性肝病(NAFLD)是一种与胰岛素抵抗和遗传易感性密切相关的代谢性肝病,其病理学特征为肝细胞脂肪变性[1]。近年来,随着人们生活水平的提高和生活方式的改变,NAFLD发病率逐年上升,且逐渐呈现出年轻化的趋势[2]。肝纤维化是一种病理过程,是肝脏受损后纤维组织增生和沉积的结果[3]。肝纤维化是NAFLD 进展的重要阶段,也是影响患者预后的关键因素之一[4]。因此,早期预测和诊断肝纤维化对于NAFLD 的治疗和预后具有重要意义。本研究旨在探讨NAFLD 患者肝纤维化的危险因素,并构建预测模型,以期为NAFLD 早期预测肝纤维化提供参考,现报道如下。
1 资料与方法
1.1 一般资料 选取2020 年6 月至2023 年6 月金华市人民医院收治的NAFLD 患者188 例。纳入标准:符合2018 年更新版《非酒精性脂肪肝病防治指南》[5]中NAFLD 的诊断标准;无其他肝脏疾病;年龄18 ~65 岁。排除标准:酒精性肝损伤;有精神疾病史的患者;合并有其他疾病如恶性肿瘤等;资料不完整。本研究经金华市人民医院医学伦理委员会审批,所有研究者均同意参加本研究并签署书面知情同意书。
1.2 方法 收集纳入对象一般资料,包括性别、年龄、体质量指数(BMI)、高血压、吸烟、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDLC)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖(FBG)、餐后2h 血糖(2 hBG)、空腹胰岛素(FINS)、白介素(IL)-17、IL-18、IL-22、肿瘤坏死因子(TNF)-、25(OH)D。IL-17、IL-18、IL-22、TNF- 水平采用酶联免疫吸附试验测定,IL-17、IL-18 试剂盒购自上海烜雅生物科技有限公司,IL-22、TNF- 试剂盒购自美捷科技有限公司。血清中的25(OH)D 水平采用全自动免疫分析仪进行检测。所有操作均遵循严格的质量控制和标准化操作程序,检测结果由专业实验室人员以双盲方式评估,以确保数据的准确性和可靠性。
1.3 肝纤维化诊断标准 采用非酒精性脂肪性肝纤维化评分(NAFLDFS)进行评价。NAFLDFS=-1.675+0.037×年龄(岁)+0.094×BMI(kg/m2)+1.13×空腹血糖调节受损/糖尿病(是+1,否+0)+0.99×AST/ALT(比值)-0.013×PLT-0.66×白蛋白(g/dl)。积分>0.676 考虑存在肝纤维化,积分<-1.455 考虑排除纤维化[6]。
1.4 统计方法 采用SPSS 26.0 软件进行数据分析。计量资料以均数±标准差表示,采用t 检验;计数资料采用2检验。多因素分析采用Logistic 回归分析。建立ROC 曲线,分析模型预测NAFLD 患者合并肝纤维化的效能。用rms 包绘制列线图模型和校准曲线,利用Rstudio 中rmda 程序包绘制临床决策曲线。P <0.05 表示差异有统计学意义。
2 结果
2.1 两组临床资料比较 根据NAFLDFS评分分为分为合并组(n=56)与未合并组(n=132)。两组TG、HDL-C、LDL-C、FBG、FINS、IL-17、IL-18、IL-22、TNF- 及25(OH)D 水平差异均有统计学意义(均P<0.05),见表1。
2.2 多因素Logistic分析 将表1 中有统计学意义的指标作为自变量,将NAFLD 患者是否合并肝纤维化作为状态变量,纳入多因素Logistic 回归模型,结果显示,高TG、HDL-C、FINS、IL-22、TNF- 水平,低25(OH)D 水平为NAFLD 患者合并肝纤维化的独立危险因素(均P <0.05),见表2。

表2 多因素Logistic 回归分析
2.3 列线图预测模型构建 基于多因素Logistic分析结果,依据危险因素构建NAFLD 患者合并肝纤维化风险列线图预测模型,见图1。

图1 NAFLD 患者合并肝纤维化发生风险的列线图
2.4 NAFLD 患者合并肝纤维化风险预测多模型分析 依据列线图风险预测模型得到列线图预测模型指标,建立ROC 曲线分析各项模型的区分度,结果显示,TG、HDL-C、FINS、IL-22、TNF- 、25(OH)D及列线图预测模型的AUC 分别为0.87、0.65、0.75、0.69、0.85、0.76、0.98,列线图预测模型均优于单指标模型。当取cut-off 时,列线图预测模型的灵敏度、特异度分别为0.87、0.96,见表3。Bootstrap 法(B=1000)对列线图预测模型进行内部验证显示,Bias-corrected预测曲线与Ideal 线基本重合,C-index 为0.96,该模型预测能力较好,见图2。决策曲线显示,该模型的阈值概率范围为0.02~0.98,其净收益率>0,见图3。
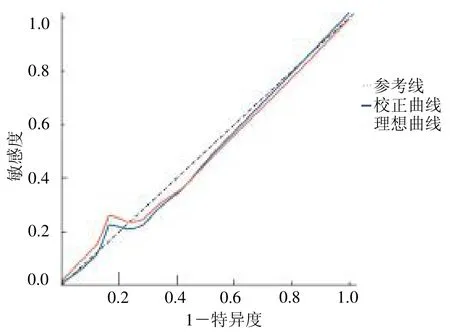
图2 列线图风险预测模型的校准曲线

图3 列线图风险预测模型的决策曲线
3 讨论
NAFLD发病率逐年上升,已成为全球范围内最常见的慢性肝病之一[7]。据报道,NAFLD 在西方国家的患病率为20%~30%,而在亚洲国家的患病率也在逐年上升[8]。肝纤维化是NAFLD 预后不良的重要因素之一,指肝脏中细胞外基质(ECM)的过度沉积和异常分布,导致肝脏结构和功能发生改变[9]。本研究188 例NAFLD 患者,合并肝纤维化患者56例,占比29.8%,这与章雅南等[10]研究结果接近。
本研究对两组的临床资料进行比较,并进一步二元Logistic 回归分析,结果显示,高TG、HDL-C、FINS、IL-22、TNF- 水平,低25(OH)D 水平为NAFLD 患者合并肝纤维化的独立危险因素(均P <0.05)。高TG 水平可能导致脂肪在肝脏中沉积,从而引发脂肪肝,脂肪肝是NAFLD 的一个关键特征,而持续的脂肪肝可能导致肝纤维化。高水平的HDLC可能与其他血脂异常有关,例如血脂异常、代谢综合征和胰岛素抵抗等[11]。这些状况可能导致肝脏脂肪沉积和肝纤维化的风险增加。在NAFLD 患者中,高FINS 水平可能预示着胰岛素抵抗的严重程度。胰岛素抵抗可能导致脂肪在肝脏中沉积,进而引发肝纤维化,长期的肝纤维化可能导致肝硬化和其他严重的肝脏疾病[12]。升高的IL-22 可能通过刺激肝细胞增殖和促进胶原合成等途径,加剧肝脏炎症和纤维化的发展。此外,IL-22 还可能与其他细胞因子和炎症介质相互作用,共同促进NAFLD 的炎症反应和肝纤维化的进展。高水平TNF- 可以加剧肝脏炎症反应,促进肝细胞损伤和纤维化的形成。TNF-还可以诱导其他细胞因子的产生,如IL-6 和IL-1 ,进一步加剧炎症反应和纤维化的进展[13]。低水平的25(OH)D可能导致钙和磷的吸收不足,进而导致骨骼疾病和骨折等风险增加[14]。此外,维生素D 还具有免疫调节的作用,它可以帮助身体抵抗感染和炎症,并增强免疫系统的功能[15]。低水平的25(OH)D可能导致免疫系统功能减弱,增加感染和炎症的风险,从而促进肝纤维化的进展。
本研究结果显示,TG、HDL-C、FINS、IL-22、TNF- 、25(OH)D 及列线图预测模型的分别为0.87、0.65、0.75、0.69、0.85、0.76、0.98,显示出这些指标对NAFLD 患者合并肝纤维化有较好的预测价值。其中,列线图预测模型的最高,表明它对肝纤维化的预测能力更好。当取cut-off 时,预测模型的灵敏度、特异度分别为0.87、0.96,这表明这些指标在预测NAFLD 患者合并肝纤维化方面都有一定的价值,且本研究建立的列线图在预测NAFLD 患者合并肝纤维化方面具有较高的收益。
综上所述,高TG、HDL-C、FINS、IL-22、TNF-水平,低25(OH)D 水平为NAFLD 患者合并肝纤维化的独立危险因素,通过这些指标构建的风险预测模型具有较好的预测价值。但本研究仅选取了一家医院的患者作为研究对象,样本量相对较小因此存在一定的局限性,未来研究可考虑扩大样本量,进行多中心研究,以进一步验证模型的可靠性和准确性。
利益冲突 所有作者声明无利益冲突
作者贡献声明 施晓英:实验操作、论文撰写;傅思华:数据整理、统计学分析;傅怡悦:研究指导、论文修改、经费支持
