晒田环境胁迫对克氏原螯虾卵巢组织、卵黄蛋白原及营养物质代谢的影响
2024-04-24黄玉英何苹萍郑玉斯卢智发张圣杰李文红彭金霞王大鹏
袁 畅,李 蔚,黄玉英,何苹萍,郑玉斯,李 鑫,卢智发,张圣杰,李文红 , 彭金霞,王大鹏
(1.广西水产科学研究院/广西水产遗传育种与健康养殖重点实验室,南宁 530021;2.广西大学动物科学技术学院,南宁 530004)
【研究意义】克氏原螯虾(Procambarusclarkii)又称小龙虾,原产于北美洲,最早于1929年由日本传入中国南京,已成为重要养殖经济虾类[1],但目前面临苗种繁育能力低、品质退化、提质增效空间受限等问题[2]。晒田通过环境胁迫影响生物生长、繁殖、储存等活动的能量最佳分配[3],近年来在生产上使用较多,但目前该技术尚未标准化,晒田起始时间和晒田时长主要依靠生产经验。因此,了解晒田环境胁迫后的克氏原螯虾卵巢组织学特点与体内营养相关调节机制,可为生产操作的改进提供参考依据。【前人研究进展】目前对于克氏原螯虾卵巢发育阶段的研究较多,根据颜色和组织学特点,国内学者主要将卵巢发育分为7个(未发育期、发育早期、卵黄发生前期、卵黄发生期、成熟期、产卵后期和恢复期)[4]、6个(I期、II期、III期、IV期、V期和VI期)[5]、5个(卵黄发生前期、卵黄发生初期、卵黄发生中期、成熟期和产后恢复期)[6]或4个(卵黄发生前阶段、早期卵黄发生阶段、中期卵黄发生阶段和成熟阶段)[1]阶段。卵黄积累是甲壳类动物卵母细胞发育成熟的必要前提,促使卵巢产生变化,进入下一个发育阶段[7]。卵黄发生可为卵母细胞生长及胚胎发育供给所需的氨基酸、脂、钙和能量等营养和功能性物质,对生殖至关重要[8]。虾蟹类动物胚胎以及开口前仔体都属于卵黄营养,作为卵黄主要成分,卵黄蛋白对维持早期虾类生命具有关键作用[9]。卵黄蛋白原是卵黄蛋白主要成分卵黄磷蛋白的前体,对于卵母细胞发育成熟具有重要意义[10]。不同环境胁迫下甲壳动物体内卵黄蛋白原浓度或mRNA水平存在差异。在盐度胁迫脊尾白虾(Exopalaemoncarinicauda)中,卵黄蛋白原浓度随着盐度升高呈先上升后下降趋势[11];在农药阿特拉津胁迫克氏原螯虾中,卵黄蛋白原浓度及mRNA水平随阿特拉津浓度升高而下降[12];在重金属镉胁迫淡水蟹(Sinopotamonhenanense)中,卵黄蛋白原浓度及mRNA水平随镉浓度增加而下降[13];在4-壬基酚胁迫贻贝(Mytilusgalloprovincialis)和螃蟹(Carcinusaestuarii)中,卵黄蛋白原浓度随着4-壬基酚浓度增加而上升[14]。卵黄蛋白原被称为卵巢发育的生物学标准物,但评价卵巢发育仅卵黄蛋白原这一个指标并不充分。营养代谢水平与卵巢发育相辅相成,也是评价水产动物生长与繁殖的重要指标,受环境胁迫影响会发生相应变化。如高温胁迫下,三疣梭子蟹(Portunustrituberculatus)血蓝蛋白(Hem)含量低于低温胁迫[15];凡纳滨对虾(LitopenaeusVannamei)在急冷与空气暴露联合胁迫下,随着胁迫时间延长,乳酸(LA)和葡萄糖(Glu)均呈先上升后下降趋势[16]。【本研究切入点】已有研究表明晒田环境胁迫可促熟克氏原螯虾卵巢[17],但晒田胁迫期间的卵巢组织学特点及促使卵巢发育的卵黄蛋白原和营养物质代谢相关情况尚未见报道。【拟解决的关键问题】对比分析克氏原螯虾在晒田环境胁迫期间的卵巢组织学特征、卵黄蛋白原和营养物质代谢的变化过程,进一步探索其变化机制,为晒田环境胁迫促进克氏原螯虾卵巢成熟这一生产操作的改良和标准化提供理论参考。
1 材料与方法
1.1 试验材料
供试克氏原螯虾采自广西来宾市兴宾区的一个稻虾养殖场。试验使用2个池塘,即晒田池塘和对照池塘。晒田池塘将池塘田面(300 m2)用塑料围子和铁管围牢,防止逃逸,池内所有试验虾为晒田组。对照池塘不需要改造,池内所有试验虾为对照组。晒田池塘中克氏原螯虾为穴居,在晒田胁迫开始1~2 d内掘穴,用刨出的泥土将洞口封住,在洞内昼夜栖居。对照池塘中克氏原螯虾白天在环沟底部随机爬行或隐蔽,光照条件适宜时觅食。
1.2 试验方法
1.2.1 试验设计 于2022年9月将2个池塘田面上水30~40 cm,分别选取50 kg克氏原螯虾投至2个池塘田面,持续1周,正常养殖投喂。克氏原螯虾雌雄比1∶1;2个池塘中随机挑选30只虾进行测量与解剖,晒田池塘中克氏原螯虾平均规格为(24.61±6.36)g,对照池塘中克氏原螯虾平均规格为(23.56±5.67)g,二者规格接近。雌性克氏原螯虾卵巢I期、II期、III期、IV期均有发现。正式试验开始后,将晒田池塘的田面水排干,使田面自然曝晒,促使雌性克氏原螯虾在田面掘穴并封口,正式试验开始后停止投喂;对照池塘正常养殖,每天继续投喂适量人工配合饲料。
1.2.2 样品采集 晒田胁迫0、3、7、10 d时分别从2个池塘随机采集30只雌性克氏原螯虾,晒田池塘于采集当天在田面使用铁铲挖掘虾洞,将虾钳探入洞中捕捉采集,对照池塘于采集前一天在环沟中放置多个虾笼,定时收笼起捕。将每个时间段的30只雌性克氏原螯虾解剖,记录卵巢颜色并拍照。晒田池塘与对照池塘每个时间段随机取10只雌性克氏原螯虾卵巢,制作石蜡切片及HE染色,分析其卵巢组织学特点并计算卵巢成熟率(卵巢生长至IV期鉴定为卵巢成熟)。在晒田组与对照组中,每个采样时间段随机取5只虾的组织作为一个混样,并设置3个平行。将雌性克氏原螯虾置于冰上,取出其肝胰腺和卵巢分别放入冻存管,所有组织均置于液氮保存备用。从5只雌性克氏原螯虾的围心腔各取1 mL血淋巴放入抗凝管,将其进行混合,于4 ℃冰箱静置20 min,4 ℃下2500 r/min离心10 min,取其上清液分装至离心管,得到血清。进一步检测卵巢、肝胰腺和血清的卵黄蛋白原浓度及卵巢和肝胰腺mRNA表达水平,并检测血清营养物质代谢水平。
卵巢成熟率(%)=IV期卵巢数量/总卵巢数量×100
组织表达量=该时间段组织(卵巢或肝胰腺)的mRNA相对表达量×该时间段组织(卵巢或肝胰腺)的平均质量
组织表达总量=该组织的不同时间段组织表达量的总和
个体表达总量=不同组织的组织表达总量的总和
组织贡献率=该组织的组织表达总量占个体表达总量的百分比
1.2.3 制作卵巢石蜡切片和HE染色 将各时间段采集的雌性克氏原螯虾解剖,在各时间段雌性克氏原螯虾中随机采集10只虾的卵巢,每个卵巢均利用4%多聚甲醛固定液固定24 h以上,通过75%~95%梯度酒精以及无水乙醇脱水、二甲苯透明、石蜡包埋以及切片等步骤制作组织切片,再脱蜡,使用苏木素和伊红进行HE染色及脱水封片,经显微镜镜检、测量和拍照。
1.2.4 卵黄蛋白原mRNA表达水平和浓度检测 提取RNA:使用总RNA提取试剂盒(天根,DP419)从克氏原螯虾卵巢和肝胰腺样品中提取总RNA,测定样品吸光度值(OD),通过260和280 nm的OD值确定RNA质量,再进行琼脂糖凝胶电泳检测,确定提取RNA的完整性和污染情况。RNA反转录:取200 ng 样本RNA,添加RNase-free ddH2O至12 μL,加入3 μL 5×gDNA digester Mix,42 ℃孵育2 min,再加入5 μL 4×Hifair III SuperMix Plus,配出20 μL 反应体系上机(PCR程序设置:25 ℃ 5 min,55 ℃ 15 min,85 ℃ 5 min),得到cDNA产物。
实时荧光定量检测:取10 μL SYBR Premix ExTaq(2×),加入正向引物(10 μmol/L)和反向引物(10 μmol/L)各1 μL,加入1 μL模板(cDNA),再添加ddH2O至20 μL,配出20 μL反应体系上机,设置两步法荧光定量PCR扩增条件(扩增曲线:95 ℃ 5 min,循环1次;95 ℃ 10 s,60 ℃ 30 s,循环40次,72℃单点检测信号;熔解曲线:95 ℃ 15 s,60 ℃ 60s,95 ℃ 15 s,连续检测信号),下机得到CT值。每个样品重复测定3次,采用2-△△Ct法对数据进行相对定量分析,获得卵黄蛋白原mRNA相对表达量。使用18S基因作为内参基因,18S基因与卵黄蛋白原基因的引物序列如表1所示。
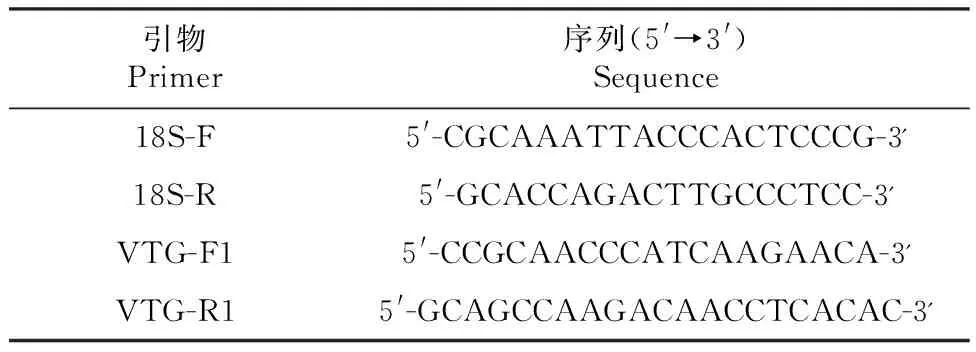
表1 试验引物与序列Table 1 Experimental primers and sequences
卵黄蛋白原浓度采用江苏晶美生物科技有限公司的ELISA 试剂盒检测,进行3次重复。
1.2.5 营养物质代谢水平检测 Hem和总蛋白(TP)采用江苏晶美生物科技有限公司的ELISA试剂盒和BCA法蛋白含量试剂盒检测。Glu采用高效液相法检测。LA、甘油三酯(TG)和胆固醇(TC)采用苏州科铭生物技术有限公司试剂盒检测。以上每个指标检测均进行3次重复。
1.3 统计分析
数据整理分析使用Excel 2019、SPSS 26.0和GraphPad Prism 8.0.2软件。
2 结果与分析
2.1 晒田环境胁迫下克氏原螯虾卵巢组织学特点及成熟率变化
如图1所示,根据形态和颜色,在晒田组与对照组雌性克氏原螯虾中分别鉴定出4个卵巢发育阶段,包括卵黄发生前阶段(I期)、初级卵黄发生阶段(II期)、次级卵黄发生阶段(III期)、成熟阶段(IV期)。I期卵巢为黄色,肉眼可观察到细小颗粒,壁膜较厚(图1-A);II期卵巢为橙色,外观轮廓清楚,壁膜变薄,卵粒增大但不饱满,排列紧凑(图1-B);III期卵巢为棕色,体积明显变大,且卵粒饱满(图1-C);IV期为黑褐色,体积再次膨胀,卵粒更加饱满且易脱落(图1-D)。HE染色结果表明,鉴定的4个雌性克氏原螯虾卵巢发育阶段准确性较高。I期卵母细胞小且接近圆形或椭圆形,直径150~250 μm,细胞核与细胞质呈淡蓝偏紫色(图1-E);II期卵母细胞外形变化不大,直径250~600 μm,出现卵黄颗粒,胞浆大部分为紫红色,少许蓝色(图1-F);III期卵母细胞直径大于600 μm,胞浆呈紫红色且红色程度增加,卵黄颗粒增加且体积变大(图1-G);IV期卵母细胞直径大于1000 μm,卵黄颗粒呈紫红色且尺寸明显增加,排列略微疏散(图1-H)。如图2所示,晒田胁迫0 d时,晒田组与对照组雌性克氏原螯虾卵巢成熟率相似;晒田胁迫10 d时,晒田组的雌性克氏原螯虾卵巢成熟率上升至96.67%,而对照组仅上升至60.00%。
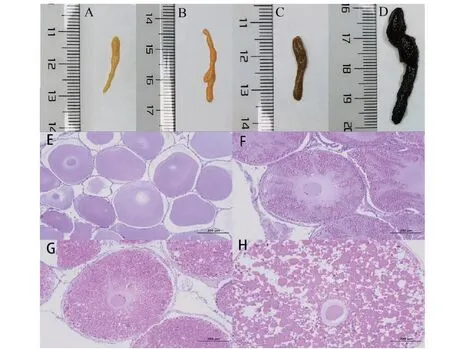
A~D:卵巢外部形态;A:I期;B:II期;C:III期;D:IV期。E~H:卵巢组织形态学HE染色;E:I期卵母细胞,F:II期卵母细胞,G:III期卵母细胞,H:IV期卵母细胞。A-D: External morphology of ovary; A: Phase I; B:Phase II; C:Phase III; D: Phase IV. E-H: Histomorphology HE staining of ovary; E: Phase I oocytes, F: Phase II oocytes, G: Phase III oocytes, H: Phase IV oocytes.图1 克氏原螯虾卵巢发育阶段鉴定Fig.1 Identification of ovarian development stage of P. clarkii
2.2 晒田环境胁迫对克氏原螯虾卵黄蛋白原mRNA表达水平和浓度的影响
如表2所示,晒田胁迫0、3、7和10 d时,晒田组雌性克氏原螯虾卵巢中卵黄蛋白原mRNA相对表达量、卵巢质量、肝胰腺中卵黄蛋白原的mRNA相对表达量和肝胰腺质量与对照组均不存在显著差异(P>0.05,下同)。随着胁迫时间增加,晒田组和对照组雌性克氏原螯虾不同组织中卵黄蛋白原的mRNA相对表达量均呈上升趋势。如表3所示,晒田胁迫0、3、7和10 d时,晒田组雌性克氏原螯虾卵黄蛋白原的卵巢表达量与对照组均不存在显著差异;晒田胁迫0和10 d时,晒田组雌性克氏原螯虾卵黄蛋白原在肝胰腺的表达量与对照组不存在显著差异;晒田胁迫3和7 d时,晒田组雌性克氏原螯虾卵黄蛋白原在肝胰腺的表达量显著大于对照组(P<0.05,下同)。晒田组和对照组雌性克氏原螯虾卵黄蛋白原在肝胰腺的表达总量均大于卵巢表达总量,肝胰腺贡献率均大于卵巢贡献率,2组肝胰腺贡献率均大于60.00%,卵巢贡献率均大于25.00%,且晒田组雌性克氏原螯虾卵巢贡献率低于对照组,肝胰腺贡献率高于对照组。如图3所示,晒田胁迫0、3、7和10 d时,晒田组雌性克氏原螯虾卵巢、血液中卵黄蛋白原浓度与对照组不存在显著差异;晒田胁迫0、7和10 d时,晒田组雌性克氏原螯虾肝胰腺中卵黄蛋白原浓度与对照组不存在显著差异;晒田胁迫3 d时,晒田组雌性克氏原螯虾肝胰腺中卵黄蛋白原浓度显著大于对照组。随胁迫时间增加,晒田组和对照组雌性克氏原螯虾卵巢、肝胰腺和血液中的卵黄蛋白原浓度均呈上升趋势。如表4所示,Pearson相关系数表明,肝胰腺卵黄蛋白原浓度与卵巢卵黄蛋白原浓度、肝胰腺卵黄蛋白原浓度与血清卵黄蛋白原浓度、卵巢卵黄蛋白原浓度与血清卵黄蛋白原浓度间呈极显著正相关(P<0.01,下同),相关系数分别为0.985、0.954和0.918。

表2 不同晒田时间克氏原螯虾卵巢与肝胰腺质量以及该组织卵黄蛋白原的mRNA相对表达量Table 2 The mass of ovaries and hepatopancreas and the relative mRNA expression of vitellogenin in the tissues of P. clarkii at different sunning field time

折线上不同小写字母表示同一晒田时间下不同处理组间差异显著(P<0.05),下同。Different lowercase letters on the polyline indicate significant differences between treatment groups at the same time (P<0.05). The same as below.图3 不同晒田时间克氏原螯虾各组织卵黄蛋白原浓度变化Fig.3 Changes of vitellogenin concentration in different tissues of P. clarkii at different sunning field time
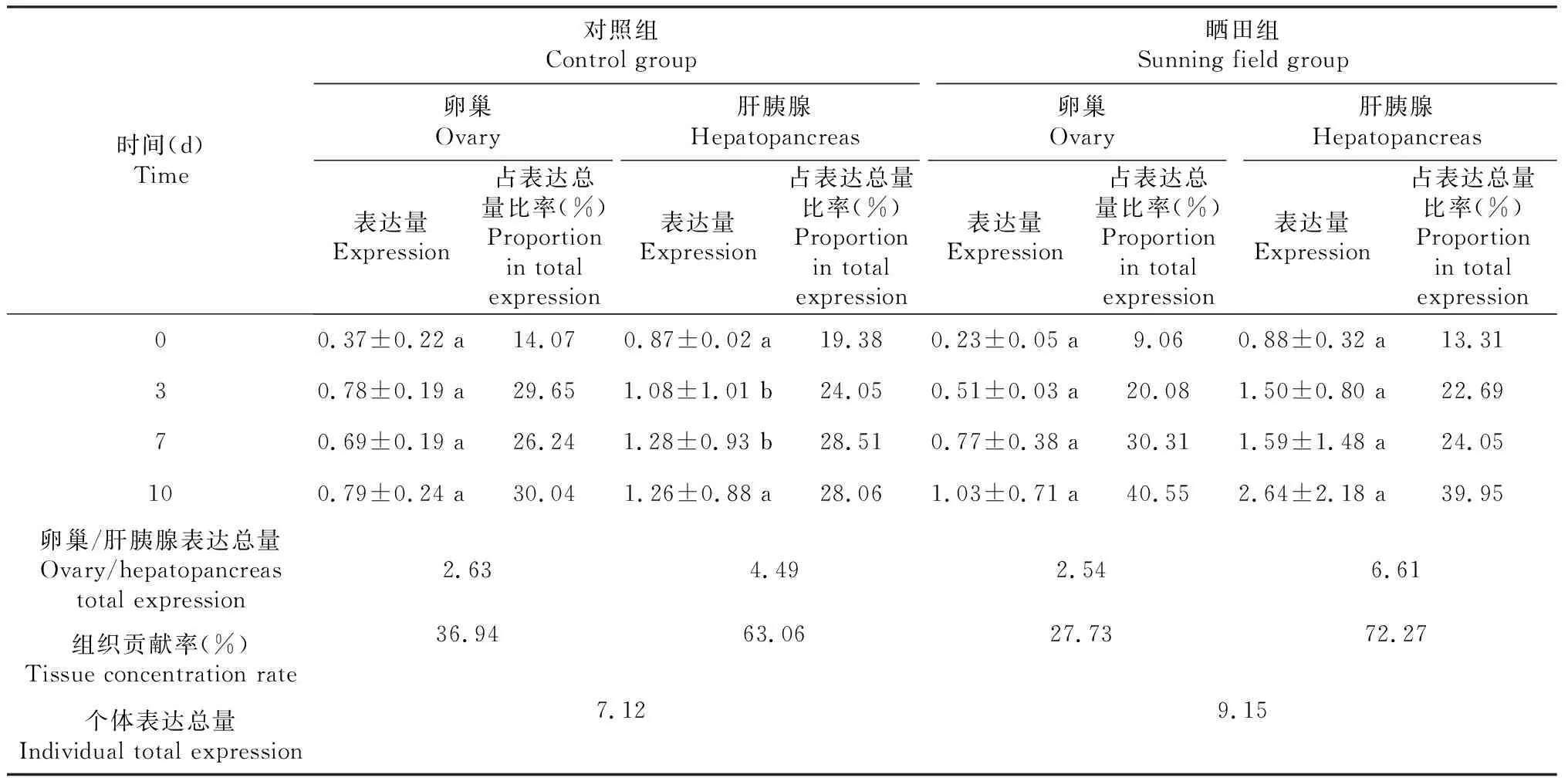
表3 不同晒田时间克氏原螯虾卵黄蛋白原在卵巢和肝胰腺中的表达量及贡献率Table 3 The expression and contribution rate of vitellogenin in the ovary and hepatopancreas of P. clarkii at different sunning field time

表4 晒田环境胁迫下克氏原螯虾各组织卵黄蛋白原浓度的相关性Table 4 Correlation of vitellogenin concentrations in various tissues of P. clarkii under sunning field environmental stress
2.3 晒田环境胁迫对克氏原螯虾营养物质代谢的影响
如图4所示,晒田胁迫0、3、7和10 d时,晒田组雌性克氏原螯虾血液中的Hem和TP含量与对照组不存在显著差异,随着胁迫时间增加,晒田组和对照组雌性克氏原螯虾血液中Hem和TP含量均呈下降趋势,晒田组雌性克氏原螯虾血液中Hem和TP含量下降幅度大于对照组。晒田胁迫0和3 d时,晒田组雌性克氏原螯虾血液中的TG含量与对照组不存在显著差异;晒田胁迫7和10 d时,晒田组雌性克氏原螯虾血液中TG含量显著大于对照组。晒田胁迫0、3和7 d时,晒田组雌性克氏原螯虾血液中TC含量与对照组不存在显著差异,晒田胁迫10 d时,晒田组雌性克氏原螯虾血液中TC含量显著大于对照组。随着时间增加,晒田组和对照组雌性克氏原螯虾血液中TG和TC含量呈上升趋势,晒田组TG与TC含量上升幅度大于对照组。晒田胁迫0、3、7和10 d时,晒田组雌性克氏原螯虾血液中LA含量与对照组不存在显著差异。晒田胁迫0、3和7 d时,2组雌性克氏原螯虾血液中Glu含量不存在显著差异;晒田胁迫10 d时,晒田组雌性克氏原螯虾血液中Glu含量显著低于对照组。随着胁迫时间增加,晒田组和对照组雌性克氏原螯虾血液中LA和Glu含量呈下降趋势,晒田组雌性克氏原螯虾血液中LA和Glu含量下降幅度大于对照组。

图4 不同晒田时间克氏原螯虾营养物质代谢指标变化Fig.4 Changes of nutrient metabolism indexes of P. clarkii at different sunning field time
3 讨 论
3.1 晒田环境胁迫对克氏原螯虾卵巢发育分期及成熟率的影响
随着卵母细胞增殖和卵黄及脂卵黄的摄取,克氏原螯虾卵巢发育成熟,期间卵巢体积增大,颜色发生白色、黄色、棕色和深棕色的变化[1]。因此,根据形态和颜色可初步判断克氏原螯虾卵巢发育阶段。在晒田胁迫期间发现4种不同颜色卵巢,分别为黄色的卵黄发生前阶段(I)、橙色的初级卵黄发生阶段(II)、棕色的次级卵黄发生阶段(III)、黑褐色的成熟阶段(IV),由黄色到黑褐色的变化过程中,卵巢体积不断增大。本研究中晒田环境胁迫雌性克氏原螯虾卵巢颜色与正常养殖下一致,但却不同于Zhong等[1]正常养殖下的卵巢颜色,推测可能与地域环境条件有关。将采集的雌性克氏原螯虾卵巢分为4个阶段,与前人研究中的分期方法基本一致,而I~IV期卵母细胞直径大小与其相应阶段的细胞大小有所差异,可能与卵巢成熟时间和成熟方式有关[1,9,18]。
本研究中,晒田胁迫10 d时,对照组雌性克氏原螯虾卵巢发育分期主要为III期和IV期,而晒田组雌性克氏原螯虾卵巢发育分期主要为IV期,表明正常养殖下卵巢从III期发育至IV期还需较长时间,而晒田环境胁迫仅需10 d即可将卵巢发育至IV期,大幅度提高卵巢发育成熟速度。晒田胁迫0 d时,晒田组雌性克氏原螯虾卵巢成熟率与对照组相似,晒田胁迫10 d时,晒田组雌性克氏原螯虾卵巢成熟率升至96.67%,但对照组雌性克氏原螯虾卵巢成熟率仅升至60.00%。这也再次验证了生产上晒田环境胁迫可提高克氏原螯虾卵巢发育成熟速度的结论。本研究雌性克氏原螯虾卵巢成熟率结果与广西水产科学研究院王大鹏科研团队前期研究的晒田环境胁迫雌性克氏原螯虾卵巢成熟率结果(7.5%~92.5%)有所差异,但晒田胁迫10 d时雌性克氏原螯虾卵巢成熟率均在90%.00以上,推测是天气状况、暴晒情况及克氏原螯虾种质优劣不同而导致雌性克氏原螯虾卵巢成熟率有所差异。
3.2 晒田环境胁迫对克氏原螯虾卵黄蛋白原的影响
甲壳动物内分泌系统的性类固醇相关激素[19]、高血糖家族激素[20]、甲基法尼酯[21]以及蜕皮激素[22]都能影响卵黄蛋白原合成。本研究晒田组和对照组雌性克氏原螯虾卵巢与肝胰腺卵黄蛋白原mRNA相对表达量及卵巢、肝胰腺和血液卵黄蛋白原浓度均随胁迫时间增加呈上升趋势,表明晒田环境胁迫可影响内分泌系统相关激素分泌,使克氏原螯虾体内不同组织卵黄蛋白原合成随时间增加均得到不同程度提高。然而研究表明,随着环境胁迫时间增加,机体的能量储备消耗越发明显[12],慢性胁迫可能导致水生无脊椎动物糖原、脂质和蛋白质作为最终能量被消耗[3],卵黄蛋白原作为成熟卵母细胞中主要蛋白质,将在慢性胁迫下发挥作用而被消耗[12],表现为浓度或mRNA水平降低。这与本研究结果存在差异,产生差异的原因推测为卵黄蛋白原在晒田环境胁迫下本身存在一定消耗,但消耗量远远低于合成量,因此在数据上表现为上升趋势。此外,甲壳动物卵黄蛋白原外源性合成部位为肝胰腺,内源性合成部位为卵巢,血液仅具有运输功能[23]。关于克氏原螯虾卵黄蛋白原合成部位的研究较少,相关报道显示,克氏原螯虾卵黄蛋白原合成器官仅涉及肝胰腺和卵巢,主要合成器官为肝胰腺,其贡献率在80%以上[9]。本研究晒田组和对照组雌性克氏原螯虾卵黄蛋白原的肝胰腺表达总量均大于卵巢表达总量,肝胰腺贡献率均大于卵巢贡献率,2组肝胰腺贡献率均大于60.00%,卵巢贡献率均大于25.00%,说明晒田环境胁迫与正常养殖下雌性克氏原螯虾卵黄蛋白原合成部位都以肝胰腺为主,卵巢为辅。然而晒田组雌性克氏原螯虾卵巢贡献率低于对照组,肝胰腺贡献率高于对照组,表明晒田环境胁迫可增加外源性卵黄蛋白原合成,降低内源性卵黄蛋白原合成。Pearson相关系数显示,晒田组雌性克氏原螯虾肝胰腺卵黄蛋白原浓度与卵巢和血淋巴呈极显著正相关,相关系数分别为0.985和0.954,表明晒田环境胁迫可促进克氏原螯虾肝胰腺向卵巢转运卵黄蛋白原。
3.3 晒田环境胁迫对克氏原螯虾营养物质代谢指标的影响
克氏原螯虾具有特殊习性,当生活环境发生巨大变化(如干旱、高温酷暑等)时,其种族延续与繁殖需求将变成生存下首要选择,繁殖性能将发生变化,因此体内营养能量将优先供给繁殖相关活动[24]。甲壳动物卵巢发育及能量代谢所必需的营养物质为糖类、脂质和蛋白[25]。TP和Hem可反映甲壳动物蛋白质代谢。TP在甲壳动物体液免疫过程中起关键作用,是重要能量来源[26]。Hem具有载氧、酚氧化物酶活性、转运金属离子、储存蛋白质、渗透压调节、蜕皮激素载体、表皮固化等作用[27-28]。甲壳动物将体内富余蛋白质以Hem形式储存,作为存储蛋白能量的有效途径[29]。本研究晒田组和对照组雌性克氏原螯虾Hem和TP含量均随胁迫时间延长呈下降趋势,晒田组雌性克氏原螯虾Hem和TP含量下降幅度大于对照组,表明与正常养殖相比,晒田环境胁迫下克氏原螯虾体液免疫能力下降,机体对环境的防御反应能力降低,同时存储蛋白能量的效率降低,体内富余蛋白质减少,且对渗透压、蜕皮激素等生理指标的调控能力降低,推测是因为受恶劣环境影响,克氏原螯虾体内能量储备消耗较严重,同时供给繁殖相关活动能量较多。
TC和TG可反映甲壳动物脂质代谢。TC是甲壳动物体内性类固醇激素及多种激素合成的重要原料,可调控卵巢发育的重要营养与能量物质,对性腺发育等功能活动具有重要作用[30]。TG是甲壳动物生殖和代谢过程中重要的营养和能量来源,作为成体、卵和开口前幼体能量贮存的主要方式,对促进卵巢发育和繁殖具有关键作用[31-32]。本研究中,晒田组雌性克氏原螯虾TG和TC含量上升幅度大于对照组,在晒田胁迫10 d时,晒田组TG和TC含量显高于对照组,表明晒田环境胁迫可增加克氏原螯虾体内能量贮存,用于合成卵巢发育相关激素,调控卵巢发育及繁殖相关活动。
LA和Glu可反映甲壳动物糖类代谢。LA能刺激甲壳类动物分泌高血糖激素,将Glu输送到血淋巴作为厌氧菌底物,影响无氧代谢水平[33]。Glu作为甲壳动物代谢过程中主要的能量物质,可释放大量能量,有利于应对不同环境胁迫[34-35]。本研究中,晒田组和对照组雌性克氏原螯虾LA和Glu含量随胁迫时间延长呈下降趋势,在晒田胁迫10 d时达到最低值,晒田组下降幅度大于对照组,表明与正常养殖相比,晒田环境胁迫克氏原螯虾可减少高血糖激素分泌,降低无氧代谢水平,且为应对晒田环境胁迫,克氏原螯虾将减少能量释放,将能量优先供给繁殖活动。这一变化可能与克氏原螯虾特殊习性有关。
4 结 论
晒田环境胁迫期间共鉴定出4个克氏原螯虾卵巢发育阶段。随胁迫时间增加,克氏原螯虾不同组织卵黄蛋白原mRNA相对表达量及浓度均呈上升趋势,卵黄蛋白原在肝胰腺的贡献率大于卵巢贡献率。克氏原螯虾体内Hem、TP、LA和Glu含量降低,TG和TC含量升高,说明晒田环境胁迫对卵巢发育具有积极作用。
