基于高通量测序分析天麻种植土壤的真菌变化
2024-04-24杨德强赵长林
陈 瑞,杨德强,赵长林
(1.西南林业大学生物多样性保护学院,昆明 650224;2.云南国诚农业发展有限公司,云南 昭通 657000)
【研究意义】天麻(GastrodiaelataBlume)又名定风草,为兰科天麻属多年生共生草本植物。天麻主产于中国陕西、四川、云南、贵州、湖南、湖北等省份,其中云南省彝良县、永善县等地为公认的道地药材天麻产区[1-3]。天麻有镇静、抗衰老的作用,临床医学上主治肝阳上亢所致的头痛眩晕、惊厥抽搐等症[3]。天麻被广泛用于药食领域,其块茎中独有的天麻素、香荚兰醇、酚性化合物等化学成分具有镇痛、抗抑郁、抗衰老、增强细胞免疫力等作用[4-6]。然而,天麻栽培一直受连作障碍的困扰,其机理与药用植物连作障碍相似,连作产生的化感自毒物质引起土壤微生态的变化是天麻发生连作障碍的重要原因[7-9]。药用植物栽培中的连作障碍问题严重影响了中药材的规范化种植,随着天麻栽培面积的不断扩大及中药材规范化种植的推行,连作障碍已成为限制天麻高产、优产的重要因素[8-14],因此研究消除或减轻天麻连作障碍的方法具有重要现实意义。【前人研究进展】近年来,中国农作物与药用植物连作障碍问题备受关注,其中土壤微生物在连作障碍问题中扮演重要角色,更多学者致力于植物种植土壤微生态研究,当土壤中营养成分、微生物组成结构改变,导致土壤中病原菌的大量繁殖,有益微生物的生长受到抑制,植株将无法正常生长发育[13-16]。土壤中微生物生存数量巨大、种类繁多,是土壤生态系统的组成部分,亦存在缓解作物连作障碍及其他土壤障碍因子的重要因素,如重茬大豆土壤中病原真菌镰刀菌是导致大豆生长发育障碍的主要原因之一,而木霉菌可用作拮抗菌研究[11,17-18]。土壤中微生物的种类和数量受土壤类型、季节变化、土层厚度等因素影响,大量研究结果表明植株发病率或发病指数与土壤中病原微生物数量呈正比,在农作物重茬种植土壤中,主要病原菌增多[15,18-20]。高通量测序技术在土壤微生物群落结构研究、土壤微生物多样性研究及土壤生态功能研究方面有较大的影响,土壤真菌群落结构组成及其多样性对植物根际生态系统的平衡起着重要作用[21]。崔纪超等[22]基于高通量测序技术分析苎麻根际土壤真菌物种多样性;劳承英等[23]基于高通量测序技术分析黄连病株和健株根际土壤真菌,揭示黄连根际土壤真菌组成关系;蒋靖怡等[24]基于高通量测序分析紫花丹参、白花丹参根际土壤真菌群落结构与差异物种组成。【本研究切入点】目前对天麻连作障碍研究较少,因此,本研究从天麻种植土壤微生物变化着手,采集天麻种植前后及方竹修复后的土样进行研究。【拟解决的关键问题】基于高通量测序方法揭示天麻种植土壤真菌的群落结构,为明晰天麻连作障碍产生的原因及开发解除或减轻天麻连作障碍的生物菌剂提供理论依据。
1 材料与方法
1.1 供试材料
试验地点位于云南省彝良县荞山镇(104°16′14′′ E,27°39′33′′ N),为昭通地区天麻主产地,该镇平均海拔1650 m,年均气温11 ℃,年均降水量860 mm,土壤呈酸性或微酸性,富含腐殖质,气候和土壤条件皆适宜天麻生长[9]。本研究分别于2020年、2021年分批次采样,每年10月收获商品麻时进行采样。分别在种植天麻前和收获天麻后采集菌塘土壤,样本以“Z”形状采集,用取样铲将天麻及菌材全部挖出,去除土块与杂物,使用康宁离心管(50 mL)进行分装,样本低温保藏带回实验室后置于-80 ℃冰箱中保存。采样区域为天麻原始土、天麻一年土和方竹修复土[9],每种土样设置3个重复(表1)。

表1 采集土壤样品编号及分组Table 1 Soil sample number and assigned group
1.2 试验方法
1.2.1 DNA提取 使用TGrinder H24组织研磨均质仪 (OSE-TH-01,6 m/s的速度振荡30 s,间隔30 s,共2个循环)将样本与缓冲液充分混匀,用特定的DNA提取试剂盒 (Magnetic Soil And Stool DNA Kit)提取样本的总基因组,用0.8%琼脂糖凝胶电泳检测所提取的DNA。
1.2.2 PCR扩增、产物检测、纯化和定量 采用通用引物ITS1-1F-F和ITS1-1F-R对样本真菌进行PCR扩增[16],具体扩增区域如表2所示。

表2 PCR扩增引物信息Table 2 Primer information amplified by PCR
1.2.3 高通量测序及数据分析 首先使用 Trimmomatic v0.33软件对测序得到的 Raw reads进行过滤[25];然后使用cutadapt 1.9.1软件进行引物序列的识别与去除,得到不包含引物序列的Clean reads;使用 Usearch v10软件,通过overlap对每个样品的Clean reads 进行拼接[26],然后根据不同区域的长度范围对拼接后数据进行长度过滤[27];使用 QIIME2 2020.6软件中的dada2方法进行去噪并去除嵌合体序列[28],得到最终有效数据(Non-chimeric reads),用于后续的ASVs (Amplicon sequence variants)划分、多样性分析以及差异分析[29-33]。
2 结果与分析
2.1 土样真菌OTU组成与分析
通过去噪得到的各个样本真菌ASV,由图1可知,一麻壤样本Zhaochangl 017真菌ASV最大,为312,原壤样本Zhaochangl 019真菌ASV最小,为132,样本的真菌总ASV为720。

图1 各样本ASVFig.1 ASV number of each sample
将丰度小于0.001的ASV过滤后,比较3组样本真菌ASV (图2),3组样本共含真菌ASV 49个,基于3组特有真菌ASV分析结果显示,一麻壤charlle002特有真菌数量最多,达28个;其次是方壤charlle006,有20个,二者均高于原壤charlle001特有真菌数量。上述研究结果表明:一麻壤中特有真菌数目明显高于原壤,且方壤特有真菌数量高于原壤低于一麻壤;经天麻种植后,一麻壤真菌ASV明显上升,然而一麻壤经种植方竹后,方壤真菌ASV数量高于原壤,但低于一麻壤。

图2 3组样本ASV花瓣图Fig.2 ASV petal maps of three groups
3组样本真菌系统发育分类阶元上相对丰度分析表明 (图3),3组样本真菌按门分为Ascomycota、Basidiomycota、Mortierellomycota;按纲分为Agaricomycetes、Eurotiomycetes、Leotiomycetes、Mortierellomy-cetes、Sordariomycetes和Tremellomycetes;按目分为Agaricales、Chaetothyriales、Filobasidiales、Helotiales、Hypocreales、Mortierellales、Polyporales、Sordariales和Xylariales;按科分为Bolbitiaceae、Ceratobasidiaceae、Clavicipitaceae、Herpotrichiellaceae、Hyaloscyphaceae、Hydnangiaceae、Hypocreaceae、Leotiaceae、Meruliaceae、Mortierellaceae、Sordariaceae、Strophsrisceae、Tricholomataceae和Xylariaceae;按属分为Cadophora、Camarophyllopsis、Cladophialophora、Clavaria、Clavulinopsis、Conocybe、Deconica、Gorgomyces、Hyaloscypha、Laccaria、Metapochonia、Neurospora、Rosellinia、Scopuloides、Thanatephorus和Trichoderma。

图3 样本真菌系统发育树Fig.3 The phylogenetic tree of the sample fungi
由图3中饼图色块和大小可知隶属于Mortierellomycota的Mortierellomycetes、Mortierellales、Mortierellaceae和Mortierella真菌在charlle001 (原壤)中占比极高,隶属于子囊菌门 (Ascomycota)的Eurotiomycetes、Chaetothyriales和Sordariomycetes、Xylariales真菌在charlle002 (一麻壤)中占比极高,隶属于担子菌门 (Basidiomycota)的Tremellomycetes在charlle006 (方壤)中占比极高。科水平下:Tricholomataceae、Sordariaceae在charlle001中丰度极大,在charlle002和charlle006中丰度极小;Bolbitiaceae、Xylariaceae在charlle002中丰度极大,在charlle001和charlle006中丰度极小;Hydnangiaceae、Meruliaceae在charlle006中丰度极大,在charlle001和charlle002中丰度极小。属水平下:Camarophyllopsis、Clavaria、Deconica和Neurospora在charlle001中丰度极大;Conocybe、Metapochonia和Rosellinia在charlle002中丰度极大;Laccaria、Thanatephorus和Trichoderma在charlle006中丰度极大。
2.2 土样真菌群落结构及相对丰度
将丰度低的样本合并为Others作单个样本在科水平及种水平的样本丰度 (图4~5),分析结果表明,样本丰度按科等级,除未注释到科的类群外,样本真菌主要隶属于Clavicipitaceae、Xylariaceae、Leotiacene、Hydnangiaceae、Tricholomataceae、Ceratobasidiaceae、Hyaloscyphaceae、Herpotrichiellacene、Hypocreacene、Piskurezymaceae、Mortierellaceac、Clavariaceae和Helotiales fam Incertae sedis,其中每组土样的优势菌科有所差异。注释到种水平的真菌主要隶属于Clavulinopsis、Hyaloscypha、Mortierella、Spirosphaera、Cadophora、Trichoderma、Rosellinia、Clitocybe和Solicoccozyma属,各样本中优势菌存在差异,原壤中Clitorybetrulliformis在Zhaochangl 021组占据优势地位,一麻壤中Rosellinienecatrix、Spirospheeracaricigraminis和Solicoccozymaterricola分别在Zhaochangl 015、Zhaochangl 016和Zhaochangl 017 3个样本中明显占据优势地位,Trichodermarifaii在方壤的Zhaochangl 032样本中占据优势地位。

图4 科水平单个样本相对丰度Fig.4 Relative abundance of a single sample(family)

图5 种水平单个样本相对丰度Fig.5 Relative abundance of a single sample (species)
物种丰度与样本相互关系图通过Circos绘制[33],其筛选相对丰度大于1%的物种以family水平绘图,揭示各分组样本中不同物种所占的比例及物种在不同分组中的比例关系。由图6可知,3组土样优势菌组成较为相似,均以Agaricales、Cantharellales、Chaetothyriales、Filobasidiales、Helotiales、Hyporeales、Mortierellales、Pezizales、Polyporales、Sordariales、Trechisporales和Xylariales为优势菌,且各优势菌相对丰度存在差异。charlle001科水平相对丰度较大优势菌有8类,依次为Helotiales>Agaricales>Mortierellales>Sordariales>Chaetothyriales>Filobasidiales>Hyporeales>Pezizales;charlle002科水平相对丰度较大优势菌有11类,依次为Helotiales>Agaricales>Trechisporales>Chaetothyriales>Filobasidiales>Xylariales>Hyporeales>Mortierellales>Sordariales>Cantharellales>Pezizales;charlle006科水平相对丰度较大优势菌有9类,依次为Helotiales>Agaricales>Cantharellales>Hyporeales>Polporales>Sordariales>Chaetothyriales>Filobasidiales>Pezizales。Helotiales和Agaricales真菌丰度在3组土样中占比都较大,在charlle001和charlle006内Helotiales真菌丰度均为35%,charlle002为20%;Polyporales真菌为charlle006独有,charlle002中真菌种类明显多于charlle001和charlle006,结合取样点信息推断一麻壤charlle002中真菌种类变多,且其丰度也有所改变,分析其原因与种植过一年天麻有直接关系;一麻壤经过种植方竹后,方壤charlle006比一麻壤charlle002真菌种类减少,分析其原因可能种植方竹不利于天麻病原菌生存和生长。

图6 样本与物种丰度circos图 (科)Fig.6 Circos plots of samples and species abundance(family)
基于科水平Heatmap聚类分析 (图7),在热图聚类结果中,颜色代表物种丰度;分析结果显示,方壤中Hydnangiaceae、Meruliaceae、Rickenellaceae、Psathyrellaceae和Sebacinaceae 5个科类群真菌在Zhaochangl 033样本中占比极高,Cantharellales fam Incertae sedis、Ceratobasidiaceae、Helotiales fam Incertae sedis和Hypocreaceae 4个类群在Zhaochangl 032样本中占比极高。一麻壤charlle002组3个样本Zhaochangl 015、Zhaochangl 016和Zhaochangl 017占比较高的类群不同,分别为Zhaochangl 015:Xylariaceae和Ascobolaceae,Zhaochangl 016:Atheliaceae和Diaporthaceae Chactosphacriaceae;Zhaochangl 017:Bolbitiaceae、Pezizales fam Incertae sedis和Piskurozymaceae。原壤charlle001组Zhaochangl 019占比较高的类群有Coniochaetaceae、fam Incertaesedis、Pyronemataceae和Sordariaceae Sordariales,Zhaochangl 020占比较高的类群有Entolomataceae、Mortierellaceae、Strophariaceae和Tricholomataceae 4个类群,Hyaloscyphaceae则在Zhaochangl 021中占比较高,上述结果表明不同土样的组内差异较大。
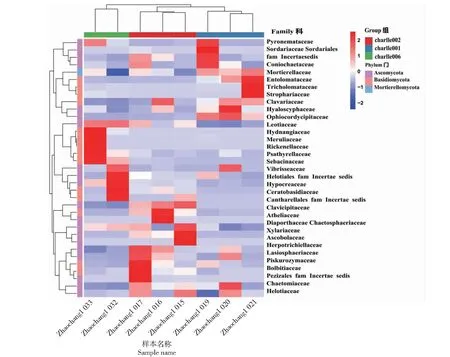
图7 物种相对丰度聚类热图 (科)Fig.7 Clustering heatmap of relative species abundance(family)
2.3 土样真菌群落多样性分析
样本Alpha多样性指数采用Qiime2[25]软件进行评估。
由表3可知,不同处理土壤真菌多样性指数覆盖率分别在99%以上,说明土壤样本测序数据足够真实,可反映其真菌群落的多样性。Observed species结果显示原壤charlle001物种数最少,仅166个,一麻壤charlle002中样本物种数最多,分析真菌群落多样性Shannon指数和Simpson指数发现,原壤charlle001和一麻壤charlle002样本真菌多样性较高,方壤charlle003多样性指数最低,该结果表明方竹轮作修复后,土壤真菌多样性降低。Chao1指数和Ace1指数在一麻壤charlle002中表现最高,原壤charlle001中表现最低,该结果表明天麻种植后真菌物种丰富度会增加,方竹轮作后会降低土壤真菌物种丰富度但仍高于原壤。
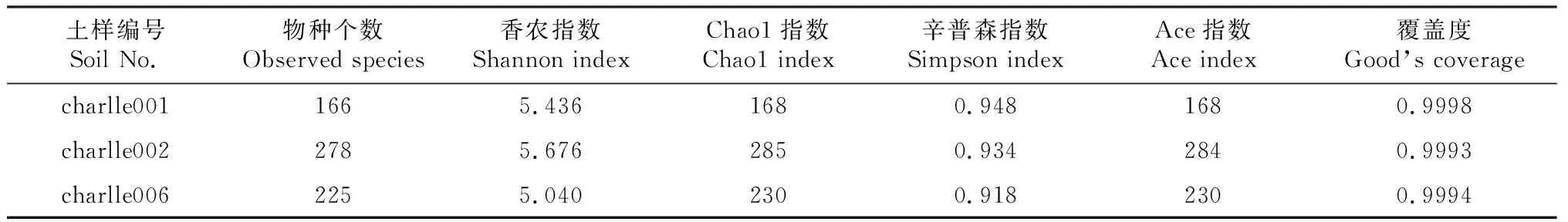
表3 样本真菌 Alpha 多样性指数统计Table 3 Statistics of the fungal Alpha diversity index of the samples
运用R语言ggplot2包绘制PCA散点图(图8),PCA分析结果表明,原壤charlle001、一麻壤charlle002和方壤charlle003此3组样本组内土壤真菌差异较小,而组间土壤真菌差异较大。

图8 样本PCA散点图Fig.8 PCA scatter plot of samples
由图9可知,Ascomycota、Basidiomycota和Mortierellomycota 3门真菌丰度较大,为所有样本中的主要优势菌,其中Ascomycota真菌丰度普遍最大。原壤3个样本Zhaochangl 019、Zhaochangl 020、Zhaochangl 021中Mortierellomycota门真菌丰度明显高于一麻壤内3个样本,推测Mortierellomycota真菌可能是天麻种植土壤中的有益真菌。原壤、一麻壤、方壤各样本均分别聚为一支,表明各组样本真菌的组成与丰度较相似;方壤2个样本聚一支,其样本中Ascomycota真菌丰度最大。

图9 UPGMA样本聚类树分析 (门)Fig.9 Clustering tree analysis of UPGMA sample(phylum)
2.4 样本真菌差异分析
基于属水平组间Welch’st-test检验,原壤(charlle001)、一麻壤(charlle002)、方壤(charlle006)3组样本两两比较做组间物种差异分析图(图10~15,图中左边为组间差异物种丰度展示,右边为组间差异置信度展示)。由图10可知,原壤(charlle001)和一麻壤(charlle002)组间真菌Camarophyllopsis和Conocybe相对丰度差异显著,Camarophyllopsis内真菌在charlle001中丰度更高,而Conocybe内真菌在charlle002中丰度更高。

图10 样本微生物群落差异比较charlle001 vs charlle002 (属)Fig.10 Comparison of microbial community differences between charlle001 and charlle002 (genus)
由图11可知,原壤(charlle001)和方壤(charlle006)差异物种分析表明,Camarophyllopsis内真菌组间相对丰度差异显著,在charlle001中丰度极高,两组样本均有Trimmatostroma。

图11 样本微生物群落差异比较charlle001 vs charlle006 (属)Fig.11 Comparison of microbial community differences between charlle001 and charlle006 (genus)
由图12可知,一麻壤charlle002和方壤charlle006组间物种差异分析揭示,Byssonectria和Solicoccozyma内真菌相对丰度差异显著,Byssonectria在charlle006中丰度更高,而Solicoccozyma在charlle002中丰度更高。

图12 样本微生物群落差异比较charlle006 vs charlle002 (属)Fig.12 Comparison of microbial community differences between charlle006 and charlle002(genus)
基于种水平组间Welch’st-test检验,原壤(charlle001)、一麻壤(charlle002)、方壤(charlle006)3组样本两两比较作组间物种差异分析图。一麻壤(charlle002)和方壤(charlle006)组间物种差异分析揭示 (图13),在一麻壤和方壤中均表现为Solicoccozyma>Byssonectria,但Byssonectria和Solicoccozyma在一麻壤和方壤中相对丰度存在显著差异,Byssonectria表现为charlle006>charlle002,Solicoccozyma表现为charlle002>charlle006。

图13 样本微生物群落差异比较charlle006 vs charlle002 (种)Fig.13 Comparison of microbial community differences between charlle006 and charlle002 (species)
由图14可知,原壤(charlle001)和一麻壤(charlle002)组间被孢霉属真菌相对丰度存在差异,Mortierellaalpina和M.simplex两组样本中相对丰度均表现为charlle001>charlle002,且土壤中高山被孢霉M.alpina相对丰度高于M.simplex。

图14 样本微生物群落差异比较charlle001 vs charlle002 (种)Fig.14 Comparison of microbial community differences between charlle001 and charlle002(species)
由图15可知,原壤(charlle001)和方壤(char lle006)差异物种分析表明,Mortierella和Penicillium相对丰度差异显著,且高山被孢霉M.alpina和M.simplex在charlle001中丰度极高,显著高于charlle006,而Penicilliumlineatum相对丰度较其他2种真菌低,在原壤和方壤中表现为charlle006>charlle001。

图15 样本微生物群落差异比较charlle001 vs charlle006 (种)Fig.15 Comparison of microbial community differences between charlle001 and charlle006 (species)
3 讨 论
连作障碍在农业生产中已成为农业经济可持续发展的无形障碍,研究表明农作物连作障碍会提升致病真菌数量和使真菌群落发生显著增加,如豌豆[34]、大蒜[35]、大豆[36]、黄瓜[37-38]、燕麦[39]、马铃薯[40]等;药用植物连作障碍导致真菌数量显著增加,如人参[41]、西洋参[42]、太子参[43]、丹参[44]、半夏[45-46]、三七[47-48]、白术[49]、地黄[50-52]等,因此搞清天麻种植土壤微生物变化,是破除天麻连作障碍基础且必要的前提工作,本研究旨在揭示天麻种植土壤真菌群落组成结构,天麻种植前后土壤真菌群落结构的变化及种完天麻种方竹后土壤真菌群落结构的变化,为研究天麻根际土壤微生态提供理论依据并为解决天麻连作障碍提供技术支持。李自博[41]基于高通量测序技术研究人参根际土壤真菌群落结构及多样性,人参根际真菌群落以子囊菌门 (Ascomycota),接合菌门 (Zygomycota)和担子菌门 (Basidiomycota)为主要群体,在人参连作土壤中,病原真菌显著增加,被孢霉属Mortierellasp.和镰刀菌Fusariumsp.成为优势真菌。太子参连作土壤微生物研究结果显示连作土壤中有益细菌数量减少,真菌数量增多,其中具有致病作用或属于病原体的真菌种 (属)随太子参连作年限增加而增加[43]。本研究采用高通量测序技术揭示3种类型天麻土壤 (原壤、一麻壤、方壤)真菌在种群组成、数量和分布上存在差异,一麻壤中真菌种类、数量明显多于原壤和方壤,即种过一茬天麻后土壤中真菌数量增多。孙雪婷等[47]基于前人研究探讨三七连作障碍研究进展,证明三七连作障碍产生的原因并非单一,主要与根际土壤微生物群落变化有关,此外还与土传病虫害的增加、化感物质的积累和三七本身的自毒物质有关,本研究主要聚焦天麻不同种植土壤的真菌群落结构,种过一年天麻后土壤中病原菌增多,再种植方竹呈现修复作用,但具体修复机制还有待后续深入研究。柏秋月[53]基于高通量测序技术研究病害天麻内生真菌群落变化,病株天麻的真菌OTU数量增多,主要为子囊菌门 (Ascomycota)和担子菌门 (Basidiomycota)类群,病株天麻内致病真菌增加,而本研究通过开展天麻种植前后土壤真菌群落结构的变化,表明3组土样中真菌主要类群为Ascomycota、Basidiomycota和Mortierellomycota 3门真菌,其中Ascomycota真菌丰度普遍最大,一麻壤、方竹壤和原壤3组样本特有真菌OUT依次降低。大量中草药连作土壤微生物研究显示,病原菌增殖是导致作物连作障碍的主要元凶[41-52]。本研究中3组样本真菌在门、纲、目分类水平下相对丰度差异较小,在科、属分类水平下相对丰度差异较大,属分类水平下天麻种植土壤原壤中优势菌属为Clitocybe、Solicoccozyma和Spirosphaera,一麻壤中优势菌属为Clavulinopsis和Rosellinia,方壤中优势菌属为Trichoderma;前人研究表明部分Rosellinia真菌易引起植物病害[54-55],而Trichoderma多用于生防菌株筛选,可有效抑制病原真菌的增殖[56],故推测种植天麻后种方竹有改善土壤病原菌增多的作用。
4 结 论
天麻土壤样品中优势真菌主要是子囊菌门 (Ascomycota)、担子菌门 (Basidiomycota)和被孢霉门 (Mortierellomycota)3门真菌。对比3组样本特有真菌OTU从大到小排序为一麻壤>方竹壤>原壤。各组样本中优势真菌存在差异,原壤中主要优势菌为Clitocybesp.、Solicoccozymasp.和Spirosphaerasp.,一麻壤中主要优势菌为Clavulinopsissp.和Roselliniasp.,方壤中主要优势菌为Trichodermasp.。种植天麻后的土壤与原壤相比病原真菌成为优势菌,且真菌种类及OTUs显著高于原壤。
