磷添加对棉田土壤理化性质及其细菌多样性的影响
2024-04-24侯天钰张应榕王娟红陈波浪
张 曼,侯天钰,张应榕,王娟红,陈波浪, 2
(1. 新疆农业大学资源与环境学院,乌鲁木齐 830052;2. 新疆土壤与植物生态过程重点实验室,乌鲁木齐 830052)
【研究意义】新疆是我国重要的优质棉生产基地,新疆棉花生产面积、单产和调出量居全国首位,占全球棉花总产量的20%[1]。在农业生产系统中,磷是棉花产量提高的重要物质保证,由于磷在土壤中易被固定,其有效性往往较低。近30年来,尽管我国农田土壤有效磷水平通过施用磷肥得到了显著提高,全国平均耕层土壤速效磷含量 (24.7 mg/kg) 是20世纪80年代的3倍多[2],但当季磷肥利用率仅有10%~15%[3],绝大多数肥料磷以累积态磷存在,作物可利用的有效磷含量仍然不足。因此,如何提高作物对土壤累积态磷的活化利用以及提高磷肥的利用效率是保障我国作物高产与资源高效的重大问题。【前人研究进展】微生物在土壤磷循环和调节磷有效性中起着重要作用[4],尤其是在积累磷的再循环中。Dinesh等[5]发现微生物具有将土壤中有机磷转化成可供植物吸收的无机磷的能力;张玲玉等[6]研究发现微生物在促进土壤有机磷和不溶性磷向有效磷转化中起着积极作用。另外,施用磷肥对土壤微生物群落结构具有反馈作用。已有研究表明,施用磷肥可以增加土壤有效磷含量,从而改变土壤微生物群落结构和组成,促进某些特定微生物的生长[7]。廖朝选等[8]通过研究发现,短期施用磷肥可以显著增加土壤细菌、真菌和放线菌数量。罗明等[9]通过对灰漠土棉花试验地土壤连续2年进行观测,发现适宜的磷肥用量可促进微生物数量显著增加。Shi等[10]发现经过17年不同水平施磷梯度 (P2O50、17.5和35 kg/hm2) 后,土壤细菌群落结构并未发生显著改变。Tan等[11]研究发现,经过42年不同磷肥施用梯度处理后,土壤细菌多样性和土壤中溶磷性细菌的相对丰度随着磷肥施用量的增加而增加,但酸杆菌门 (Acidobacteria) 和假单胞菌属 (Pseudomonas) 等细菌相对丰度随之降低。综上,关于磷肥施用对土壤微生物群落的影响机制仍存在广泛的不确定性[12]。【本研究切入点】目前,关于施磷调控棉田土壤理化性质影响细菌群落结构的研究鲜有报道。因此,本研究通过6年定位磷添加的田间试验,采用Illumina MiSeq高通量测序技术手段,探讨不同磷添加量对棉田土壤细菌多样性及群落组成的变化,阐述环境因子对土壤细菌群落结构的影响。【拟解决的关键问题】明确调节棉田理化性质、优化土壤细菌群落结构的最佳磷添加量,以期为科学施磷、改善土壤理化性质和维持土壤微生物群落结构等提供一定理论依据。
1 材料与方法
1.1 试验地概况
试验地点位于新疆昌吉回族自治州玛纳斯县新湖农场 (44°79′ E,86°44′ N),该地区属于温带大陆性干旱半干旱气候,日照充足,最高气温40 ℃,年降雨量237.7 mm。土壤类型为灰漠土。试验田块已经连续6年进行不同磷添加梯度的定位试验。棉花品种为新陆早57号,播前土壤 (0~20 cm) 的基本理化性质见表1。
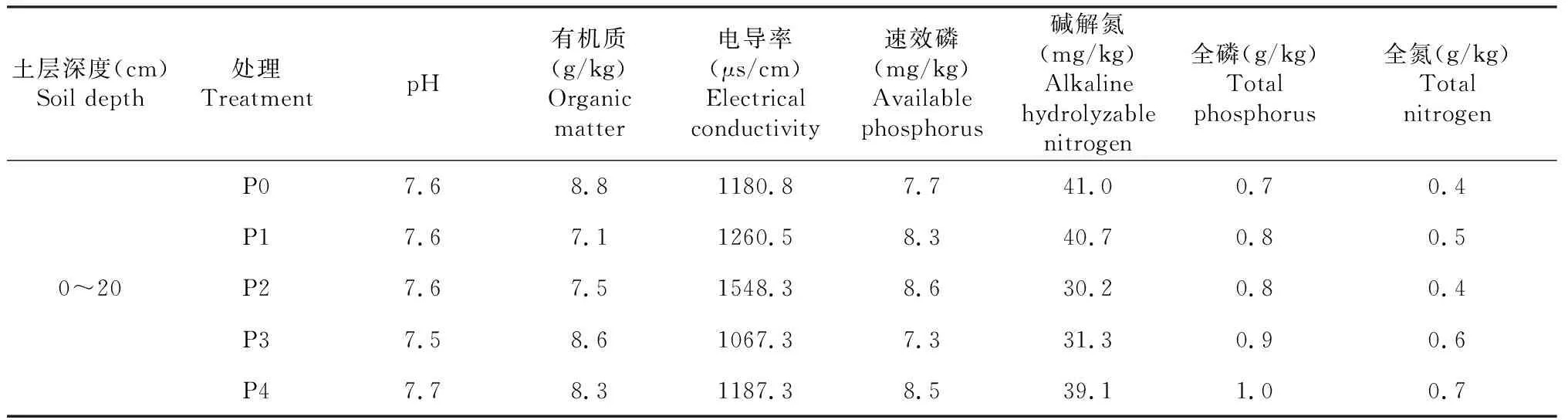
表1 土壤基本理化性质Table 1 Basic physical and chemical properties of soil
1.2 试验设计
在新湖农场一连四队棉花种植区域内进行田间试验,试验地采用随机区组设计,小区总面积为1936 m2。不同磷(P2O5)添加量分别为0、75、150、300、450 kg/hm2,记为P0、P1、P2、P3和P4,每个处理3个重复,共15个小区。施用磷肥品种为重过磷酸钙,作为基肥一次性施入,尿素(N) 300 kg/hm2,氮肥施用方式为40%播前施入,其余60%分8~10次在棉花不同生育期随水滴施,硫酸钾(K2O) 75 kg/hm2,钾肥也一次性在播前做基肥施用,其他田间管理同当地农户常规管理。
1.3 土壤样品采集
棉花根际土样于2021年8月花铃期进行采集,每个小区用抖根法采集根际土,保存于无菌的自封袋中。每个地块按“S”型随机抽取5个点,并将5个点的土样混合放入无菌袋作为1个样品,每个处理5个重复。将所采集的土样放入冰盒内冷藏带回实验室,从土样中取出30 g左右新鲜土样混匀后过2 mm筛,无菌袋封好放入-80 ℃冰箱用于土壤微生物群落结构的测定。剩下部分自然风干,研磨过1.00和0.25 mm土筛,用于测定土壤基本理化指标。用100 cm3的环刀采集0~20 cm土层土壤样品,用于土壤容重和含水量测定。
1.4 测定方法
1.4.1 土壤理化性质测定 土壤pH采用1.0∶2.5土水比,在振荡箱振荡30 min后直接用pH计测量,全盐采用1.0∶5.0土水比,通过电导率计算求得。土壤有机质采用重铬酸钾外加热法[13]测定,土壤容重和含水量采取环刀烘干法[14]测定,土壤温度采用土壤温度记录仪 (JL-04) 自动采集,每隔30 min采集记录1次数据。
1.4.2 土壤DNA提取及高通量测序 提取DNA采用MoBio/QIAGEN公司的DNeasy Power Soil Kit进行,并对抽提的DNA进行检测。采用荧光分光光度计(Quantifluor ST fluorometer, Promega,E6090 Quant iT PicoGreen dsDNA Assay Kit,Invitrogen, P7589)在260 和280 nm 处分别测定DNA的吸光值,检测DNA浓度,并用1%的琼脂糖凝胶电泳检测DNA质量。调整DNA溶液浓度,DNA工作液保存于4 ℃,储存液保存于20 ℃。
使用通用引物5’-CAGTGGGACGACCACGAGGT-3’和5’-GAGGCCGATCGGCATGTCG-3’对细菌16S rRNA基因的 V3~V4 可变区域进行PCR扩增;然后进行胶回收纯化,针对目标条带进行割胶回收,得到纯化样本,然后进行各样本定量,利用BioTek酶标仪对各个样品定量 (BioTek Flx800酶标仪;Quant-iT PicoGreen dsDNA Assay Kit, Invitrogen, P7589),最后采用标准的Illumina TruSeq DNA文库制备实验流程构建所需的上机文库。利用Pico green和荧光分光光度计方法定量文库,并使用安捷伦 (Agilent 2100) 对PCR富集片段进行质量控制,验证DNA文库的片段大小及分布。均一化并混合文库:多样品DNA文库 (Multiplexed DNA libraries) 均一化至10 nmol/L后等体积混合。将混合好的文库 (10 nmol/L) 逐步稀释定量至45 pmol/L后进行上机测序。
1.5 数据处理
土壤理化性质使用Microsoft Excel 2010进行数据整理,利用SPSS 20.0统计软件进行单因素方差分析 (ANOVA),采用Origin Pro 2018软件进行作图。
土壤细菌群落结构数据选用Silva数据库,后续基于OTU分析,进行分类组成学分析实现各样本在门、纲、目、科、属、种6个分类水平上的组成分布。还可获得样本内α-多样性指数、样本间β-多样性指数。α-多样性指数包含Chao1指数、Observed species指数、Shannon指数、Simpson指数和覆盖度 (Good’s coverage) 指数,β多样性分析包括冗余分析。
冗余分析是一种最经典的非约束排序分析方法,通过将样本距离矩阵经过投影后,在低维度空间进行展开,并最大限度地保留原始样本的距离关系。常用的β多样性距离包括Jaccard距离、Bray-Curtis距离、unweighted UniFrac距离和weighted UniFrac距离等。
2 结果与分析
2.1 磷添加对土壤理化性质的影响
由图1-a和1-b可知,不同磷添加处理对土壤容重和含水量影响较小,各处理间无显著差异。由图1-c可知,不同施肥处理对耕层土壤温度产生显著影响。随着磷添加水平的升高,土壤温度呈先增加后降低趋势,P4处理的土壤温度显著低于P1和P2处理,分别降低11.05%和11.80% (P<0.05)。由图1-d可知,不同磷添加处理对土壤pH有较大影响(P<0.05)。随着磷添加水平的增加,pH呈先减小后增加趋势;与P0处理相比,P2处理平均显著降低0.2。由图1-e可知,不同磷添加处理对土壤电导率值变化影响显著 (P<0.05),整体呈下降趋势,其中P1和P2处理土壤电导率下降较为明显,与P0处理相比分别下降27.05%和35.19%。由图1-f可以看出,土壤有机质含量随着磷添加的升高先升高后降低,整体显著高于P0处理,增幅为1.95%~19.05%,不同磷添加间差异显著。P2处理土壤有机质含量达到峰值,P4处理的有机质含量与P0处理差异不大。由图1-g可知,随着磷添加水平的增加,有效磷含量呈先增加后降低趋势,P3处理的土壤有效磷含量最高,与P0处理相比,P3处理的土壤有效磷含量增加30.92%。由图1-h可知,P2和P3处理的土壤全磷含量较P0处理土壤全磷含量分别增加33.14%和34.91%。
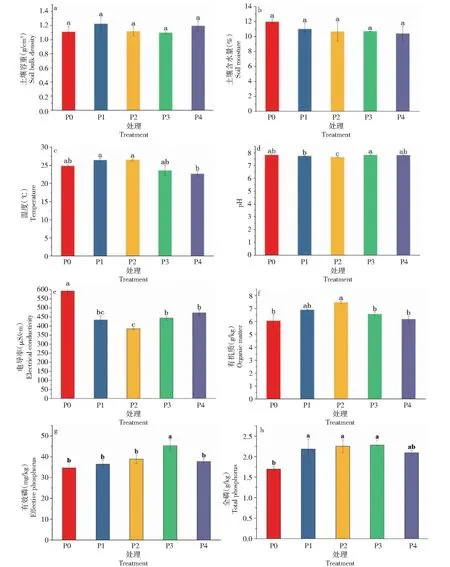
柱上不同小写字母表示处理间差异达到0.05 显著水平。Different lowercase letters on the bar indicate a significant level of 0.05 difference between treatments.图1 不同磷添加条件下棉田土壤理化性质的变化Fig.1 Changes in soil physicochemical properties of cotton field under different phosphorus addition conditions
2.2 磷添加对土壤细菌群落结构的影响
稀释曲线能反应样品文库测序数据量的合理性。由图2可知,5种不同磷添加处理的稀释曲线均平缓,表明当前测序深度足以反映样本所包含微生物多样性,说明测序数据量合理。从OTU数量可以看出,P2处理的OTU数量最多,P3次之,P1最少。Chao1指数能体现微生物群落丰富度,而Shannon和Simpson指数能够体现微生物群落多样性。由表2可知,P2、P3和P4处理的Chao1指数较P0处理分别增加13.82%、9.55%和12.48%,说明实用施磷为150 kg/hm2的菌群最丰富;而与对照相比,施磷对Shannon指数和Simpson指数无显著影响。

图2 OTUs稀疏曲线Fig.2 Sparse curves of OTUs

表2 不同磷添加处理下土壤细菌α多样性Table 2 α diversity of soil bacteria under different phosphorus addition treatments
图3~7分别挑选丰度TOP10的细菌菌门、纲、目、科和丰度TOP50的细菌菌属来分析土壤细菌群落组成的变化。由图3可知,不同磷添加下土壤细菌在门水平上的优势类群为变形菌门(Proteobacteria,53.71%) 和放线菌门 (Actinobacteria,9.08%) 的相对丰度最高,浮霉菌门 (Planctomycetes) 的平均相对丰度为0.45%,而其余相对丰度较小,在0.01%~0.11%。P2处理明显降低放线菌门的相对丰度,较P0处理下降25.44%,变形菌门的相对丰度无显著变化。由图4可知,在纲水平上以γ-变形菌纲、α-变形杆菌纲、β-变形菌纲为主,平均相对丰度分别为36.69%、28.79%和1.08%。较P0处理,P2处理中α-变形杆菌纲的相对丰度明显增加,增加11.66%。P4处理中γ-变形菌纲的相对丰度明显增加,增加36.40%,而α-变形杆菌纲的相对丰度明显降低,降低51.83%。 说明磷添加会改变纲分类水平下土壤中细菌群落结构分布和相对丰度。由图5可知,在目水平的优势类群为假单胞菌目、根瘤菌目、放线菌目和假诺卡式菌目,相对丰度分别为36.32%、24.20%、7.78%和6.08%,与P0相比,P1和P2根瘤菌目增加6.75%和17.38%,但假单胞菌目明显降低24.53%和13.35%,P3和P4假单胞菌目明显增加30.30%和36.86%,根瘤菌目明显降低52.76%和58.28%。由图6可知,在科水平的优势类群为假单胞菌科、慢生根瘤菌科、链霉菌科、根瘤菌科和假诺卡氏菌科,相对丰度分别为36.33%、20.40%、3.70%、2.87%和2.10%,其他不足1%。与P0相比,P3和P4假单胞菌科明显增加30.32%和36.85%,慢生根瘤菌科明显降低56.31%和68.27%,P1和P2慢生根瘤菌科明显增加8.22%和23.36%,假单胞菌科明显降低24.53%和13.35%。由图7可知,在属水平上相对丰度大于1%的属共有4个,分别为中华根瘤菌属、慢生根瘤菌属(Bradyrhizobium)、链霉菌属和糖多孢菌属,在P4处理的相对丰度分别为3.13%、1.43%、1.11%和1.16%,从菌属的变化可以看出在不同磷添加下,细菌菌属丰度大多数存在显著差异。

图3 不同磷添加条件下棉田土壤中细菌门水平群落组成变化Fig.3 Changes in the community composition of bacterial phylum in the cotton field soil under different phosphorus addition conditions
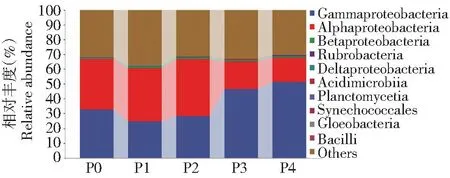
图4 不同磷添加条件下棉田土壤中细菌纲水平群落组成变化Fig.4 Changes in the community composition of bacterial class in cotton field soil under different phosphorus addition conditions

图5 不同磷添加条件下棉田土壤中细菌目水平群落组成变化Fig.5 Changes in the community composition of bacterial order in the cotton field soil under different phosphorus addition conditions

图6 不同磷添加条件下棉田土壤中细菌科水平群落组成变化Fig.6 Changes in the community composition of bacterial family in cotton field soil under different phosphorus addition conditions

图7 不同磷添加条件下棉田土壤中细菌属水平群落组成变化Fig.7 Changes in the community composition of bacterial genus in cotton field soil under different phosphorus addition conditions
2.3 土壤细菌TOP8优势菌门与土壤理化性质冗余分析
如图8所示,红色箭头代表细菌TOP8优势菌门,黑色箭头代表土壤理化性质 (SOM、T、pH、EC、MS和BD)。结果表明,RDA1和RDA2两个排序轴共解释细菌群落结构62.23%的变化,土壤pH、电导率、有机质和容重与放线菌门的相对丰度呈显著正相关 (P<0.05),与广古菌门、厚壁菌门和疣微菌门的相对丰度呈正相关,与变形菌门的相对丰度呈负相关;含水率与放线菌门呈正相关,而与变形菌门、酸杆菌门和浮霉菌门呈负相关;土壤温度与变形菌门呈正相关,而与浮霉菌门、酸杆菌门和放线菌门呈负相关;土壤pH与浮霉菌门和酸杆菌门呈正相关;土壤温度和pH均与其他8种细菌菌门呈正相关。

图8 土壤细菌优势菌门的相对丰度与土壤理化性质的冗余分析(RDA)Fig.8 Redundancy analysis (RDA) of the relative abundance of dominant bacteria and physicochemical properties of soil bacteria
3 讨 论
3.1 磷添加对土壤理化性质的影响
土壤温度不仅影响土壤中碳氮等物质的化学和生物学过程,还决定土壤资源质量高低,从而影响植物的生长发育和产量等[15-17]。不同磷添加下土壤温度在同一生育时期内,P1和P2处理的土壤温度显著高于P0处理,平均分别高1.5和2.3 ℃。P3和P4处理的土壤温度显著低于P0处理,平均分别低1.3和2.2 ℃。有研究表明,土壤温度1 ℃的差异也将显著影响作物生长[18-19]。本研究中施用磷肥条件下0~20 cm 土壤的温度在P2处理下达最高,随着磷添加量过高后会促进棉花生长尤其是地上部冠层覆盖度显著增加,减少到达地面的有效太阳辐射,从而降低土壤温度,这与前人研究结果一致[20]。
土壤pH影响土壤养分的存在状态,同时也决定肥料的施用效果,对植物的生长发育有直接影响[21]。土壤电导率是土壤的电化学特征,可表征土壤的盐分状况,是判断土壤是否盐渍化的重要指标[22]。前人研究指出,盐碱地施用磷肥可显著降低土壤pH[23]和电导率[24]。本研究结果表明,磷添加量在P2处理下最能显著降低pH和电导率,这与前人的结论基本一致,即合理的施肥量可降低土壤pH和电导率,缓解土壤盐碱压力。
土壤有机质是植物有机营养的供给源,是土壤结构形成的驱动者[1]。卢九斤等[25]认为,磷添加可提高土壤有机质含量,改善土壤养分状况。本研究中,磷添加提高了土壤有机质含量,P1、P2、P3和P4处理分别提高0.843、1.420、0.523和0.120 g/kg。在0~20 cm土层,磷添加处理土壤有机质含量均显著高于对照处理,适量磷添加能增加土壤微生物活性,促进微团聚体形成,从而提高土壤有机质含量[26]。土壤有机质含量总体低于6年前的基本值,这可能是因为无外源有机质的补充,随着种植年限的增加棉田土壤有机质矿化作用增强,其矿化产物被棉花吸收带走而消耗,而且无机养分充足更利于有机质的矿化[27]。
磷在棉花生产中起着至关重要的作用,而有效磷和全磷含量则能很好地反映出土壤供磷能力。本研究结果中,P3处理显著提高土壤有效磷含量。大量研究表明,磷添加能有效提高土壤磷水平[28]。赵亮等[29]研究结果表明,与不施磷肥或低施磷肥(75 kg/hm2)相比,施磷量为150 kg/hm2时土壤有效磷含量变化不显著,基本保持平衡;当施磷量较高(300 kg/hm2)时,土壤有效磷水平显著升高,这与本研究结果一致。本研究结果表明,P3和P4处理可显著提高土壤全磷含量,随着磷添加水平的增加,全磷含量呈先增加后降低趋势。有研究显示,土壤全磷在长期施用磷后均有一定积累,而不施磷土壤的全磷含量处于枯竭状态[22]。
3.2 施磷对土壤细菌群落组成及细菌α-多样性的影响
细菌是土壤微生物的重要组成,参与土壤养分循环,且对维持整个土壤生态系统的稳定性起着重要作用[30]。本研究从门、纲、目、科和属5个分类水平选取TOP10优势菌门、菌纲、菌目和菌科以及TOP50优势菌属进行探究。结果表明,不同处理门、纲、目、科和属水平上优势类群的相对丰度差异较显著。土壤细菌群落中变形菌门占比最大,平均丰度为55.61%,与孙瑞波等[31]对长期施肥条件下砂姜黑土细菌群落变化的研究中得到的优势菌门相同,但在相对丰度上差异较大,这可能是因为农田土壤质地、施肥类型与数量以及作物类型的不同所致[32]。在细菌门水平上,P2处理明显降低了变形菌门的相对丰度,这可能是因为向土壤中添加磷可能会降低土壤的渗透势,导致土壤微生物生长受到阻碍[33]。在细菌纲水平上,γ-变形菌纲、α-变形杆菌纲和β-变形菌纲的相对丰度较高,其中最优势的菌纲是γ-变形菌纲,平均相对丰度在35.47%,李明等[34]在研究黄瓜根际微生物群落中发现,γ-变形菌纲能够分解各类物质,是一种适应能力很强的微生物类群,从而成为大多作物根际微生物的优势种群。随着磷添加量的增加,α-变形杆菌纲的相对丰度呈先增加后降低趋势,在P2处理达到最大,说明较高的施磷水平会抑制α-变形杆菌纲的相对丰度[35]。在目水平上,主要由假单胞菌目、根瘤菌目、放线菌目、假诺卡式菌目和伯克氏菌目和细菌组成,该结果与前人报道基本一致[36-37]。有研究表明,假单胞菌目是参与磷循环的主要细菌[38],与促进植物生长紧密相关。在科水平上,磷添加对棉田土壤根际微生物影响最大的是假单胞菌科和慢生根瘤菌科。在属水平上相对丰度大于1%的属共有4个,分别为中华根瘤菌属、慢生根瘤菌属、链霉菌属和糖多孢菌属,其中慢生根瘤菌是土壤中常见的解磷微生物,帮助植物完成磷循环。本研究中,具有溶磷作用的浮霉菌门、慢生根瘤菌属和链霉菌属相对丰度随磷肥施入而明显升高。
以往有研究表明,磷添加可显著增加土壤细菌多样性[11]。Zhong和Cai[39]认为磷添加后土壤养分增加,尤其是有机质含量的增加是细菌多样性增加的主要原因。本研究中,P2处理下的OTU 数和 Chao1 指数均最高,说明磷添加可以增加物种丰富度,这与前人的研究结果一致。Islam等[40]对不同施肥措施的水稻土研究发现施用NPK肥对土壤细菌群落多样性影响较小,这与本试验研究结果一致,施磷增加了Shannon指数和Simpson指数,但无显著影响。这可能是受本试验土壤养分和质地的影响。
3.3 土壤细菌TOP8优势菌门与土壤理化性质冗余分析
本研究对细菌TOP8优势菌门与土壤理化性质进行冗余分析。研究表明,土壤理化性状能显著影响微生物的群落组成[41]。本研究中土壤pH、电导率、有机质、容重是影响土壤细菌群落丰度的主要因素。放线菌门与土壤pH、电导率、有机质、容重和含水率呈显著正相关,土壤温度与变形菌门呈正相关,土壤pH与浮霉菌门和酸杆菌门呈正相关,而土壤温度与放线菌门、浮霉菌门和酸杆菌门呈负相关,这与孙冰洁等[42]研究结果一致,土壤温度过高会抑制放线菌和霉菌的生长;而含水率与变形菌门、浮霉菌门和酸杆菌门呈负相关,有研究表明,随土壤含水率增加,土壤中变形菌门的相对丰度逐渐升高[43],这可能是因为在不同的土壤环境条件下,变形菌门对含水量的需求不同。本研究表明施用磷肥后土壤环境变化是导致细菌群落结构差异的主要原因。
4 结 论
磷添加可显著提高土壤有机质、降低土壤pH和电导率。磷添加能够增加细菌多样性,改变土壤细菌群落结构;土壤中具有溶磷作用的浮霉菌门、慢生根瘤菌属和链霉菌属相对丰度在施磷处理中明显升高。土壤理化性状能显著影响细菌的群落组成,土壤pH、电导率、有机质和容重均为影响土壤细菌群落结构的重要环境因素。
