基于铁死亡相关长链非编码RNA 的卵巢癌预后模型的构建及分析
2024-04-24王圣坦庄珩之叶克润
郑 朗,洪 澜,王圣坦,成 洁,庄珩之,叶克润
(海南省人民医院,海南医学院附属海南医院妇科,海南 海口 570311)
卵巢癌(OV)是女性常见的恶性肿瘤之一,全球每年约有25 万人被诊断为OV,其中约有15 万人因此疾病死亡[1]。年龄、遗传因素、家族史、肥胖、乳腺癌、吸烟、酗酒等与OV 的发生风险相关[2-3]。OV 细胞具有高度侵袭性和耐药性,导致治疗效果不佳[4]。铁死亡是由细胞内铁离子过载和氧化应激引起的细胞死亡方式[5]。长链非编码RNA(lncRNA)是一类长度超过200 个核苷酸的RNA 分子,可以通过多种机制调控基因的表达[6-7],影响细胞增殖、转移、凋亡等生物学行为[8-9]。lncRNA在肿瘤中扮演着多种重要角色,与肿瘤的发生、发展和治疗密切相关。目前关于OV 中铁死亡的作用和机制尚不清楚。因此,本文旨在构建并分析铁死亡相关的OV预后模型,从而探讨铁死亡在OV 发病和预后中的潜在作用。
1 材料与方法
1.1 研究数据
从TCGA(https://portal.gdc.cancer.gov)公共数据平台中筛选2015 年6 月至2017 年6 月收录并具有完整随访信息的OV 患者正常样本及肿瘤样本的RNA 测序等数据及临床相关数据。从FerrDb v2 网站(http://www.zhounan.org/FerrDb/)获取铁死亡相关基因。
1.1.1 与OV 预后和铁死亡相关lncRNA 筛选 以共表达分析方法筛选铁死亡相关差异表达的lncRNA,其筛选条件为|log FC|≥1.0,P<0.05。合并铁死亡相关差异表达lncRNA 和TCGA 数据库中生存时间、生存状态等临床相关信息行Cox 单因素回归分析,以P<0.05 回归因素信息进行筛选。
1.1.2 差异lncRNA 功能富集及蛋白质-蛋白质互作网络分析 采用DAVID 数据库对与OV 预后和铁死亡相关lncRNA 基因进行基因本体论(GO)富集分析和京都基因与基因组百科全书(KEGG)通路分析。GO 分析主要包括生物过程(BP)、细胞组分(CC)、分子功能(MF)三部分。采用GO seq 和KOBAS 对筛选出的差异表达RNA 进行GO 富集和KEGG 通路分析,筛选条件均为P<0.05。采用相互作用基因库检索工具(STRING)(https://string-db.org/)数据库预测蛋白质之间的相互作用,设置筛选阈值为:结合分值>0.4。用颜色的深浅表示 Degree 算法预测的评分高低。
1.1.3 OV 预后风险模型构建及验证 依据Cox 回归分析方法筛选与铁死亡和OV 预后相关lncRNA,并构建基于OV 预后风险模型,基于模型计算出各个样本风险评分,依据截断值将样本患者分为高风险组和低风险组。比较高风险组和低风险组的生存情况并绘制Kaplan-Meier 生存曲线,采用单多因素Cox 回归分析方法和受试者工作特征曲线(ROC)对模型性能进行分析。
1.2 统计学方法
差异lncRNA 比较采用t检验进行,用Kaplan-Meier方法绘制OV 患者生存曲线,并使用对数秩检验对结果进行分析。
2 结果
2.1 与OV 预后和铁死亡相关lncRNA
与OV 预后和铁死亡相关lncRNA 筛选结果如图1所示,依据FDR 和logFC >1 筛选得到与OV 预后和铁死亡相关lncRNA 差异表达基因共48 个。见图1。

图1 与OV 预后和铁死亡相关lncRNA
与OV 预后和铁死亡相关lncRNA 基因GO 分析结果如图2 所示,这些基因在生物学过程(BP)中的主要作用与蛋白质ADP 核糖基化、基因表达的负调控、内质网未折叠蛋白质应激反应、铁离子转运、蛋白质稳定性调控等过程相关(见图2A)。在细胞组分(CC)方面主要与核膜、细胞核、细胞质溶液、大分子复合物线粒体、核质、细胞外囊泡等组分相关(见图2B);在分子功能方面主要与蛋白ADP 核苷酸糖基化、核苷酸转移、转录共抑制因子、蛋白丝氨酸/苏氨酸激酶激活因子、受体DNA 结合、钠离子通道抑制等过程相关(见图2C)。

图2 差异lncRNA 的GO 功能富集图
与OV预后和铁死亡相关lncRNA 基因主要参与的生物通路分析结果如图3 所示,主要包括:铁死亡、碱基切除修复、烟酸和烟酰胺代谢、AMPK 信号通路、细胞凋亡、HIF-1 信号通路、代谢途径等。
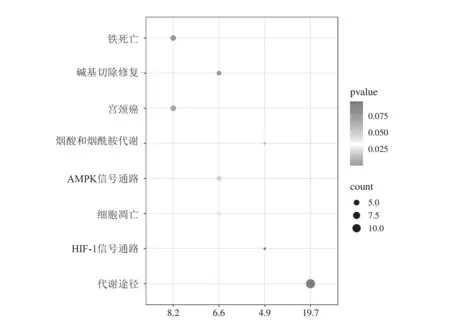
图3 与OV 预后和铁死亡相关lncRNA 基因的KEEG 富集图
2.2 PPI 互作网络分析
差异lncRNA 基因编码蛋白PPI 网络如图4 所示,差异lncRNA 基因编码蛋白PPI 网络图节点数为60,边数为138,平均节点度为4.6,平均局部聚类系数为0.51,预期的边数为46。

图4 PPI 互作网络图
2.3 Cox 回归结果分析
将与OV 预后和铁死亡相关lncRNA 与临床指标中的生存时间及生存状态进行合并,将其作为影响因素进行单因素Cox 回归分析,以P<0.05 筛选符合条件的lncRNA,结果发现共有35 个lncRNA 与OV 患者生存预后显著相关。进一步经过多因素Cox 回归分析,最终获得了10 个lncRNA(见表1)。

表1 OV 预后影响lncRNA 多因素Cox 回归
2.4 OV 预后模型构建结果分析
依据多因素Cox 回归分析后获得的10 个lncRNA构建OV 预后模型。采用OV 预后风险评分(Risk score)对模型进行表示,则本研究构建的预后模型可表示为下式:
2.5 预后模型生存状况分析
根据OV 预后模型计算各样本的风险值,并将计算得到的中位数作为截断值,将纳入OV 样本分为高风险组和低风险组,每组35 例。Kaplan-Meier 生存曲线分析结果显示,高风险组的平均生存时间为(2.38±1.06)年,低风险组的平均生存时间为(4.78±1.62)年,高风险组的平均生存时间显著低于低风险组(P<0.001)(见图5)。

图5 OV 不同风险生存状态分析
2.6 OV 预后模型ROC 曲线分析
ROC 分析结果显示,模型预测OV 患者3 年生存率ROC 曲线下面积为0.781(见图6)。

图6 OV 预后模型预测ROC 曲线
3 讨论
OV的高死亡率主要归因于其隐匿性和缺乏特异性的早期症状,导致大多数患者在就诊时病情已处于晚期[10]。OV 的早期症状不明显,往往被忽视或误诊,导致大部分患者在确诊时已经进入晚期。此时,OV 已经扩散到其他器官,难以进行手术切除,从而严重影响患者的生存率和生活质量。在正常条件下,细胞会通过抗氧化系统来维持铁离子平衡,以防止氧化应激对细胞的损伤[11-12]。然而,在某些情况下,细胞无法有效清除过多的铁离子,导致细胞内产生大量的有害自由基,进而引发细胞膜的氧化破坏、线粒体功能障碍等细胞结构和功能的紊乱,最终导致细胞死亡[13]。肿瘤细胞内铁离子过载时,铁死亡机制可以被激活,从而导致肿瘤细胞的死亡。lncRNA 可以与染色质相互作用,参与染色质三维结构的调整和染色质修饰的介导。这些作用可以影响染色质的开放状态,进而影响基因的表达[14]。在肿瘤中,异常的染色质结构和修饰往往伴随着癌基因的激活和抑癌基因的失活,从而促进肿瘤的发展。一些lncRNA 被发现参与细胞凋亡信号通路的调控,影响肿瘤细胞的生存和死亡决策。此外,lncRNA 也可以通过调节肿瘤微环境中的免疫细胞和免疫因子的表达,影响肿瘤对免疫系统的识别和攻击[15]。本文中的结果发现,高风险组生存时间显著低于低风险组(P<0.001),ROC 曲线下面积大于0.7,提示该模型特异性和敏感性较好。
4 结论
文中基于TCGA 数据库构建了OV 预后模型,最终筛选了10 个相关的lncRNA,并基于这些lncRNA 构建了敏感度和特异度较高的预测模型。在今后的工作中,我们将进一步对研究中涉及的lncRNA 进行分子实验验证,以明确其在OV 发生中的具体作用机制。总之本研究结果为OV 治疗及预后干预方案制定提供了一定的参考依据。
